多西他赛联合奈达铂在局部晚期鼻咽癌中的近远期疗效、安全性及预后分析
刘同欣 孙权权 陈晶

[摘要] 目的 探讨多西他赛联合奈达铂(TP)及氟尿嘧啶联合顺铂(PF)的诱导化疗方案在局部晚期鼻咽癌的有效性及安全性。 方法 回顾性分析2012年1月~2014年5月在浙江省肿瘤医院接受TP或PF诱导化疗方案的271例患者,8例失访,最终263例纳入分析,其中PF组92例,TP组171例,比较两组患者的疗效、安全性及预后。结果 两组5年总生存率(OS)、无进展生存率(PFS)、局部无复发生存率(LRFS)、无远处转移生存率(DMFS)比较,差异均无统计学意义(均P > 0.05)。进一步多因素分析显示,N分期是5年OS、PFS和DMFS的独立预后因素(P < 0.05)。不良反应分析显示,TP组更容易发生3~4级的白细胞、中性粒细胞和血小板减少,而PF组更容易发生3~4级的恶心和呕吐,差异有统计学意义(P < 0.05)。两组其余不良反应比较,差异无统计学意义(P > 0.05)。结论TP和PF的诱导化疗治疗局部晚期鼻咽癌效果相当,不良反应均可耐受,可用于治疗局部晚期鼻咽癌。
[关键词] 诱导化疗;奈达铂;多西他赛;鼻咽癌
[中图分类号] R739.6 [文献标识码] A [文章编号] 1673-7210(2019)08(b)-0150-06
[Abstract] Objective To evaluate the efficacy and safety of Docetaxel combined with Nedaplatin (TP) and Fluorouracil combined with Cisplatin (PF) in the treatment of locally advanced nasopharyngeal carcinoma. Methods Retrospective analysis of 271 patients who received TP or PF induction chemotherapy in Zhejiang Cancer Hospital from January 2012 to May 2014, 8 cases were lost to follow-up, and 263 cases were finally included in the analysis, including 92 cases in PF group and 171 cases in TP group. Efficacy, safety and prognosis of the two groups were compared. Results The 5-year overall survival rate (OS), progression-free survival rate (PFS), local recurrence free survival rate (LRFS), and distant metastasis free survival rate (DMFS) were compared, the differences were not statisticdly significant between the two groups (all P > 0.05). Further multivariate analysis showed that N staging was an independent prognostic factor for 5-year OS, PFS and DMFS (P < 0.05). Adverse reaction analysis showed that grade 3-4 leukopenia, neutrophilia and thrombocytopenia were more likely to occur in the TP group, while grade 3-4 nausea and vomiting were more likely to occur in the PF group, with statistically significant differences (P < 0.05). There were no statistically significant differences in other adverse reactions between the two groups (P > 0.05). Conclusion The efficacy of TP and PF induction chemotherapy in the treatment of locally advanced nasopharyngeal carcinoma is similar, and the adverse reactions are tolerable, which can be used in the treatment of locally advanced nasopharyngeal carcinoma.
[Key words] Neoadjuvant chemotherapy; Nedaplatin; Docetaxel; Nasopharyngeal carcinoma
鼻咽癌是起源于鼻咽上皮的惡性肿瘤,好发于中国的南部和东南亚地区[1]。放疗是目前鼻咽癌主要的治疗手段。T1N0M0的早期鼻咽癌患者采用单纯放疗就可达到根治的效果,5年生存率为84%~90%[2]。但70%左右的患者就诊时已属于中晚期,易发生局部复发及远处转移,单纯放疗已不能达到根治的效果。目前,以铂类为基础的同步放化疗是鼻咽癌的一线治疗手段[3]。但同步放化疗对于鼻咽部病灶广泛或颈部大肿块、广泛淋巴结转移的患者疗效欠佳[4]。近年来,诱导化疗联合含铂的同步放化疗已经成为局部晚期鼻咽癌治疗的首选方案,但最佳的诱导化疗方案尚无定论。因此,本研究回顾性分析多西他赛联合奈达铂(docetaxel plus nedaplatin,TP)对比氟尿嘧啶联合顺铂(fluorouracil plus cisplatin,FP)诱导化疗方案序贯顺铂为基础的同期放化疗在局部晚期鼻咽癌中的疗效及不良反应。
1 资料与方法
1.1 一般资料
本研究回顾性分析2012年1月~2014年5月在浙江省肿瘤医院接受TP或PF方案化疗的鼻咽癌初治患者271例。纳入标准:①病理学证实为鼻咽癌;②根据2010 AJCC分期标准为Ⅲ~Ⅳ期[5];③Karnofsky功能状态评分(KPS)≥70分;④治疗前血常规、肝肾功能及心电图无明显异常。排除标准:①有放化疗禁忌症;②肝肾功能异常或严重心脏病史;③妊娠或哺乳期女性;④有精神疾病者;⑤既往有恶性肿瘤病史,接受过放化疗。治疗前,患者进行病史采集、全身体格检查、血常规及生化、心电图、鼻咽镜、鼻咽颈部MRI、胸片或胸部CT、腹部B超或CT、全身骨显像等检查。在271例患者中,8例失访,最后263例患者纳入最后分析。两组患者的基线资料比较,差异无统计学意义(P > 0.05),具有可比性。见表1。
1.2 治疗方法
1.2.1 化疗方法 诱导化疗,TP组:多西他赛(艾素,江苏恒瑞医药股份有限公司)75 mg/m2,第1天;奈达铂(奥先达;江苏奥赛康药业股份有限公司)75 mg/m2,第1~3天;21 d为1周期,共1~4周期。PF组:氟尿嘧啶(氟尿嘧啶注射液,浙江诚意药业股份有限公司)800 mg/(m2·d)第1~5天;顺铂(诺欣,江苏豪森药业股份有限公司)75 mg/m2,第1~3天;21 d为1周期,共1~4周期。同期化疗:顺铂80~100 mg/m2,第1~3天方案化疗;21 d为1周期,共1~2周期。
1.2.2 放疗方案 所有的患者均接受调强放疗(intensity modulated radiation therapy,IMRT)。定义临床和影像学发现的鼻咽原发肿瘤及阳性咽后淋巴结为GTVnx;转移的颈部淋巴结为GTVnd;CTV1包括GTVnx、GTVnd周围亚临床灶及高危淋巴引流区。CTV2包括CTV1外扩3~5 mm及低危淋巴引流区。PTV定义为GTV或CTV外扩3~5 mm。具体剂量:PGTVnx 66~70 Gy,PGTVnd 66~70 Gy,PTV1 60 Gy,PTV2 54 Gy。采用6-MV线放疗,每周5次,每次1.8~2.2 Gy、共30~33次。根据RTOG 0225标准,肿瘤周围危及器官的剂量在其最大耐受量以内[6]。
1.3 随访
患者治疗后,前两年每3个月随访1次,3~5年每半年随访1次,5年以后每年随访1次直至死亡或失访。失访2次以上的患者被剔除。本研究最后随访截止时间为2018年10月30日,中位随访时间为66.7个月(7.6~82.9个月)。
1.4 统计学方法
采用SPSS 19.0软件进行统计分析,卡方检验或Fisher确切概率法比较患者的基线特征及近期有效率;Kaplan-Meier法及Log rank检验计算患者的总生存(OS)、无进展生存(PFS)、局部无复发生存(LRFS)、无远处转移生存(DMFS);计数资料采用百分率表示,组间比较采用χ2检验;COX回归模型進行多因素分析。以P < 0.05为差异有统计学意义。
2 结果
2.1 两组患者的近期疗效比较
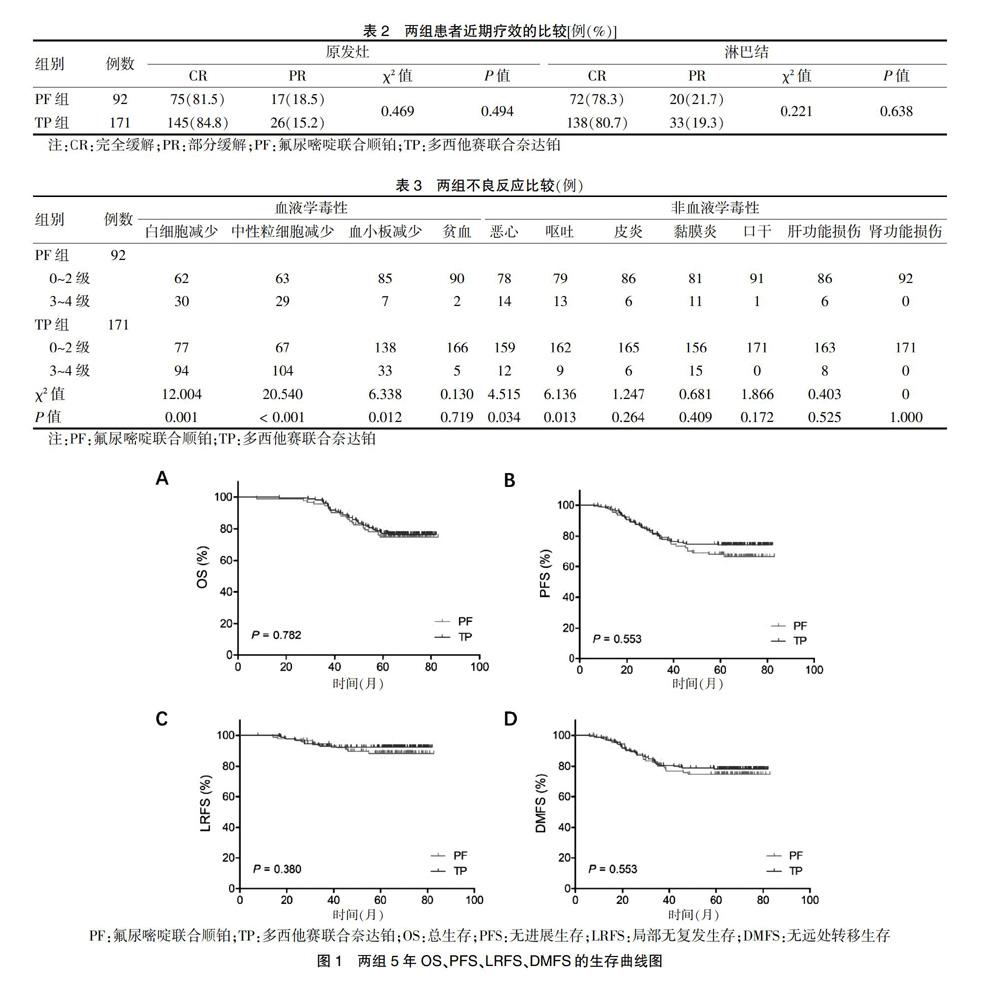
两组患者的近期疗效评价依据RECIST1.1版实体瘤疗效评价标准,分为:完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、稳定(stable disease,SD),进展(progression disease,PD)。放疗结束3个月后进行近期疗效评价。有效缓解率(response rate,RR)为CR+PR,本研究两组患者治疗后RR率为100%,无SD和PD患者。两组近期有效率比较,差异无统计学意义(P > 0.05)。见表2。
2.2 两组不良反应比较
分析血液学毒性发现,TP组更易发生3~4级白细胞、粒细胞、血小板减少;分析非血液学毒性发现,PF组更易发生3~4级的恶心、呕吐,差异均有统计学意义(均P < 0.05)。两组贫血、皮炎、黏膜炎、口干、肝肾毒性的发生率比较,差异无统计学意义(P > 0.05)。见表3。
2.3 两组长期效果比较
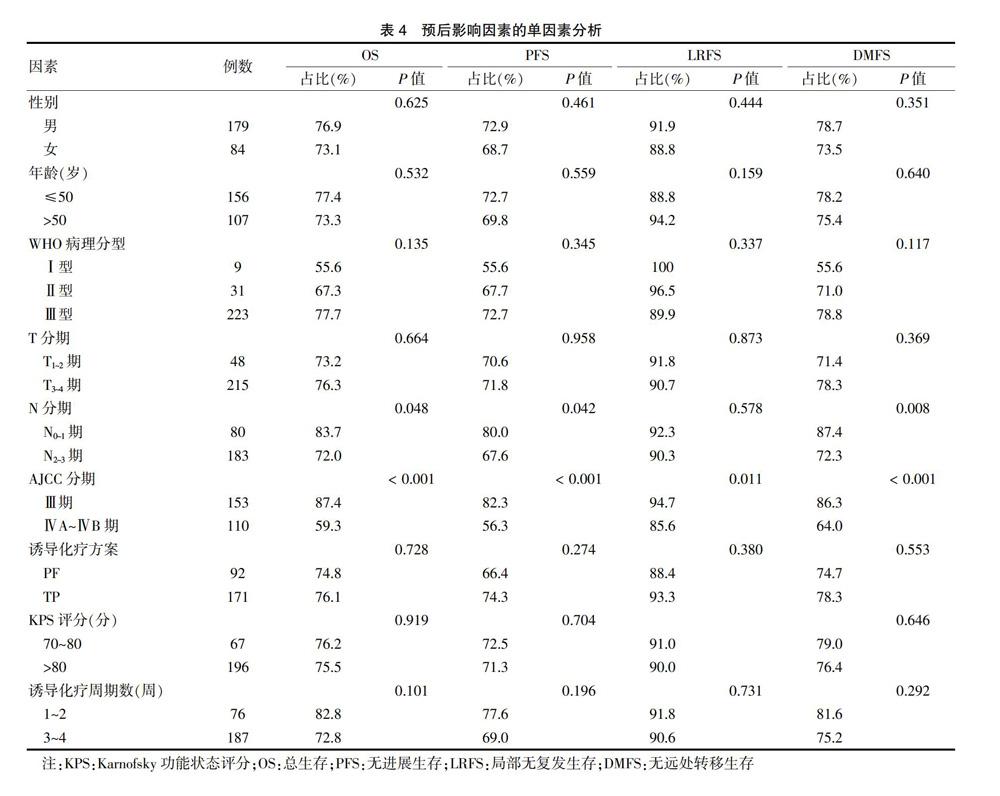
两组5年OS、PFS、LRFS、DMFS比较,差异均无统计学意义(均P > 0.05)。见图1、表4。
2.4 单因素、多因素分析影响预后的因素
为了明确影响预后的因素,通过单因素分析来评估性别、年龄、病理类型、T分期、N分期、总分期、化疗方案、KPS评分及化疗周期数对患者预后的影响。研究发现,N2~3的患者5年OS、PFS、DMFS比N0~1的患者差(P < 0.05)。Ⅳ期患者5年OS、PFS、LRFS、DMFS比Ⅲ期患者差(P < 0.05)。见表4。进一步多因素分析发现,N分期是影响OS、PFS、DMFS的独立预后因素。见表5。
3 讨论
近来,以铂类为基础的同期放化疗是局部晚期鼻咽癌的标准治疗手段[7]。但大肿块和/或广泛淋巴结转移的高危患者发生远处转移的概率更高,单纯同期放化疗的效果不佳[4],而联合诱导化疗是一种有效的治疗方案,它可以减轻肿瘤负荷及乏氧细胞,利于增强放疗敏感性,提高局控率、还可以杀灭潜在微小转移灶,降低远处转移发生率,患者耐受性良好[8-9]。
目前,最佳的诱导化疗方案尚不明确。Lee等[10]研究表明采用PF诱导化疗方案可以降低35%的患者T分期,提高局控率。但有学者研究[11]却得出阴性结果。此外,由于顺铂的肾毒性及胃肠道反应,限制了PF方案的广泛应用。奈达铂是第二代铂类类似物,具有与顺铂类似的抗肿瘤机制及抗瘤谱,但肾毒性和胃肠道反应明显减轻,已经广泛用于临床。Tang等[12]的一项非劣性随机Ⅲ期临床研究表明奈达铂可替代顺铂为基础的同步放化疗。本团队前期研究[13]也发现奈达铂联合氟尿嘧啶与顺铂联合氟尿嘧啶的诱导化疗方案疗效相似,胃肠道反应轻,是局部晚期鼻咽癌患者治疗的一种选择。
多西他赛是半合成的紫杉类抗肿瘤药物,抗肿瘤作用优于紫杉醇,并且能诱导肿瘤细胞凋亡,发挥辐射增敏的作用[14]。Sun等[15]的一项Ⅲ期临床研究发现,多西他赛、氟尿嘧啶和顺铂组成的TPF的诱导化疗方案联合同期放化疗显著改善了患者的DMFS和OS。Kong等[16]和Ou[17]等的研究也得出类似的结论。但是三药联合的TPF方案由于治疗毒性大,患者依从性差,仅有30%的患者完成了3周期的化疗。有学者研究[18]发现与TPF方案比较,TP方案的疗效无明显差异,不良反应却明显减少,患者依从性更佳。马雄辉等[19]比较TPF及PF方案的诱导化疗联合同期放化疗治疗局部晚期鼻咽癌,发现两组5年PFS、OS差异无统计学意义(P > 0.05),但TPF组在粒细胞、血小板低下,肝肾功能损伤,腹泻及黏膜坏死发生率均高于PF组,差异有统计学意义(P < 0.05)。
本研究與国内外报道的生存数据类似[20],TP组与PF组在5年OS、PFS、LRFS及DMFS方面均差异无统计学意义(P > 0.05)。本研究TP组更易发生3~4级的白细胞、粒细胞及血小板减少;经过粒细胞集落因子处理后白细胞和粒细胞下降可以恢复,血小板降低通常可以通过重组人白细胞介素11(rhIL-Ⅱ)、重组人血小板生成素(rhTPO)的处理恢复,必要时可联合输入血小板。PF组更易发生3~4度的恶心、呕吐;患者的恶心呕吐症状通常可通过5-HT3受体拮抗剂、地塞米松、NK-1受体拮抗剂的三联止吐治疗缓解,必要时可联合劳拉西泮、H2受体阻断剂或质子泵抑制剂。本研究所有的不良反应经对症处理后均可耐受,无治疗相关的死亡发生。结合临床治疗上的经验,认为对于一些高龄体弱和对化疗引起的血液学毒性比较敏感的患者,可以采用PF方案的化疗,避免了由于血象抑制引起的化疗减量、化疗延迟甚至终止治疗的情况。对于比较容易发生恶心呕吐的患者,则选用TP方案化疗,可以减轻胃肠道反应,此外,氟尿嘧啶需要连续5 d静脉给药,而多西紫杉醇可以1 d内静脉输注完成,减少了患者住院时长和发生静脉炎及感染的风险,治疗依从性和耐受性较好。总之,临床中可以结合患者的自身情况,为患者选择个体化的治疗方案。
综上所述,本研究发现TP与PF诱导化疗方案治疗局部晚期鼻咽癌疗效相当,不良反应均可耐受,可作为晚期鼻咽癌患者治疗的一种选择。
[参考文献]
[1] Cao SM,Simons MJ,Qian CN. The prevalence and prevention of nasopharyngeal carcinoma in China [J]. Chin J Cancer,2011,30(2):114-119.
[2] Lee AW,Sze WM,Au JS,et al. Treatment results for nasopharyngeal carcinoma in the modern era:the Hong Kong experience [J]. Int J Radiat Oncol Biol Phys,2005,61(4):1107-1116.
[3] Shah BA,Qureshi MM,Jalisi S,et al. Analysis of decision making at a multidisciplinary head and neck tumor board incorporating evidence-based National Cancer Comprehensive Network (NCCN) guidelines [J]. Pract Radiat Oncol,2016,6(4):248-254.
[4] Lin JC,Liang WM,Jan JS,et al. Another way to estimate outcome of advanced nasopharyngeal carcinoma--is concurrent chemoradiotherapy adequate? [J]. Int J Radiat Oncol Biol Phys,2004,60(1):156-164.
[5] Edge SB,Compton CC. The American Joint Committee on Cancer:the 7th edition of the AJCC cancer staging manual and the future of TNM [J]. Ann Surg Oncol,2010,17(6):1471-1474.
[6] Lee N,Harris J,Garden AS,et al. Intensity-modulated radiation therapy with or without chemotherapy for nasopharyngeal carcinoma:radiation therapy oncology group phase Ⅱ trial 0225 [J]. J Clin Oncol,2009,27(22):3684-3690.
[7] Al-Sarraf M,Leblanc M,Giri PG,et al. Chemoradiotherapy versus radiotherapy in patients with advanced nasopharyngeal cancer:phase Ⅲ randomized Intergroup study 0099 [J]. J Clin Oncol,1998,16(4):1310-1317.
[8] 马骏.鼻咽癌治疗的研究进展[J].中山大学学报:医学科学版,2010,31(2):179-185.
[9] 徐云华,杜伟,童涛,等.诱导化疗对局部晚期鼻咽癌放疗远期疗效的影响[J].现代肿瘤医学,2010,18(7):1294-1295.
[10] Lee AW,Lau KY,Hung WM,et al. Potential improvement of tumor control probability by induction chemotherapy for advanced nasopharyngeal carcinoma [J]. Radiother Oncol,2008,87(2):204-210.
[11] Hareyama M,Sakata K,Shirato H,et al. A prospective,randomized trial comparing neoadjuvant chemotherapy with radiotherapy alone in patients with advanced nasopharyngeal carcinoma [J]. Cancer,2002,94(8):2217-2223.
[12] Tang LQ,Chen DP,Guo L,et al. Concurrent chemoradiotherapy with nedaplatin versus cisplatin in stage II-IVB nasopharyngeal carcinoma:an open-label,non-inferiority,randomised phase 3 trial [J]. Lancet Oncol,2018, 19(4):461-473.
[13] Liu T,Sun Q,Chen J,et al. Neoadjuvant Chemotherapy with Fluorouracil plus Nedaplatin or Cisplatin for Locally Advanced Nasopharyngeal Carcinoma:a Retrospective Study [J]. J Cancer,2018,9(20):3676-3682.
[14] Herman LC,Chen L,Garnett A,et al. Comparison of carboplatin-paclitaxel to docetaxel-cisplatin-5-flurouracil induction chemotherapy followed by concurrent chemoradiation for locally advanced head and neck cancer [J]. Oral Oncol,2014,50(1):52-58.
[15] Sun Y,Li WF,Chen NY,et al. Induction chemotherapy plus concurrent chemoradiotherapy versus concurrent chemoradiotherapy alone in locoregionally advanced nasopharyngeal carcinoma:a phase 3,multicentre,randomised controlled trial [J]. Lancet Oncol,2016,17(11):1509-1520.
[16] Kong L,Zhang Y,Hu C,et al. Effects of induction docetaxel,platinum,and fluorouracil chemotherapy in patients with stage Ⅲ or ⅣA/B nasopharyngeal cancer treated with concurrent chemoradiation therapy:Final results of 2 parallel phase 2 clinical trials [J]. Cancer,2017,123(12):2258-2267.
[17] Ou X,Zhou X,Shi Q,et al. Treatment outcomes and late toxicities of 869 patients with nasopharyngeal carcinoma treated with definitive intensity modulated radiation therapy:new insight into the value of total dose of cisplatin and radiation boost [J]. Oncotarget,2015,6(35):38381-38397.
[18] Wang FZ,Jiang CE,Wang L,et al. Addition of 5-fluorouracil to first-line induction chemotherapy with docetaxel and cisplatin before concurrent chemoradiotherapy does not improve survival in locoregionally advanced nasopharyngeal carcinoma [J]. Oncotarget,2017,8(53):91 150-91 161.
[19] 馬雄辉,梁彩霞,江丹贤,等.TPF诱导化疗或PF诱导化疗联合同期放化疗治疗局部晚期鼻咽癌的临床观察[J].中国癌症杂志,2016,26(12):1018-1024.
[20] Xu J,He X,Cheng K,et al. Concurrent chemoradiotherapy with nedaplatin plus paclitaxel or fluorouracil for locoregionally advanced nasopharyngeal carcinoma:Survival and toxicity [J]. Head Neck,2014,36(10):1474-1480.
(收稿日期:2019-02-14 本文编辑:封 华)

