超声造影边缘增强特征对BI-RADS4类乳腺肿块良、恶性鉴别的诊断价值
陈菲 贾春梅 吕琪 王婧婕 胡田
[摘要] 目的 探討二维超声(2D-US)及超声造影边缘相关特征对BI-RADS 4类良、恶性乳腺肿块的诊断价值。方法 选取2016年1月~2018年7月就诊于山西医科大学附属第一医院超声科并获得明确病理结果的乳腺病例76例(共77个病灶)。按良、恶性肿块分为两组,对比良、恶性肿块边缘2D-US及超声造影增强特征,对比良性组、恶性组边缘区与中央区时间强度曲线(TIC)参数,包括基础强度(BI)、峰值强度(PI)、曲线下面积(AUC)、达峰时间(TTP)、梯度(Grad)。共分析3次,取平均值。 结果 与良性组比较,恶性组2D-US多表现为边界不清晰、多有毛刺、高回声晕、有分叶,差异有统计学意义(P < 0.05);超声造影表现为边缘增强、放射状增强、环状增强、穿支增强、造影后边界不清、造影后范围扩大,差异有统计学意义(P < 0.05)。恶性组边缘区BI、PI、AUC、Grad均大于中央区,TTP快于中央区,差异有统计学意义(P < 0.05);而良性组边缘区与中央区相关参数比较,差异无统计学意义(P > 0.05)。 结论 良、恶性肿块边缘2D-US及超声造影征象存在明显差异,在诊断乳腺癌的贡献中,恶性肿块边缘区超声征象大于中央区,因此对超声造影边缘征象重点关注可提高良、恶性乳腺肿块的鉴别诊断能力。
[关键词] 乳腺肿块;边缘;BI-RADS 4类;超声造影
[中图分类号] R445.1 [文献标识码] A [文章编号] 1673-7210(2019)10(a)-0154-04
The diagnostic value of marginal zone enhancement features of contrast-enhanced ultrasound in the benign and malignant breast masses identification of BI-RADS 4
CHEN Fei JIA Chunmei LYU Qi WANG Jingjie HU Tian
Department of Ultrasound, the First Hospital of Shanxi Medical University, Shanxi Province, Taiyuan 030001, China
[Abstract] Objective To explore the diagnostic value of two-dimensional ultrasound (2D-US) and contrast-enhanced ultrasound features in marginal zone for benign and malignant breast masses in BI-RADS 4. Methods From January 2016 to July 2018, 76 patients were collected from the Department of Ultrasound, the First Affiliated Hospital of Shanxi Medical University. A total of 77 breast masses were confirmed by biopsy or surgical pathology. Benign and malignant tumors were divided into two groups. 2D-US and contrast-enhanced ultrasound characteristics of marginal zone in benign and malignant tumors were compared. And the marginal zone and the inside of the masses time-intensity curve (TIC) parameters of the benign and malignant groups were analyzed. Base strength (BI), peak intensity (PI), area under the curve (AUC), peak time (TTP), and gradient (Grad) were observed. They were analyzed for 3 times and the average value was taken. Results Compared with benign group, 2D-US of malignant group showed more irregular edge, spiculate margin, acoustic halo and lobulated edge, the differences were statistically significant (P < 0.05). Contrast-enhanced ultrasound showed radial enhancement, perforator enhancement and circular enhancement, perforation enhancement, unclear boundary, enlarged range after angiography were more common in malignant group, the differences were statistically significant (P < 0.05). In malignant group, BI, PI, AUC and Grad were bigger in marginal zone than the inside of the masses, and TTP was faster than the inside of the mass, the differences were statistically significant (P < 0.05). In benign group, the marginal zone of lesion was not significantly different from the internal mass in the above parameters (P > 0.05). Conclusion There are significant differences between the benign and malignant masses in the 2D-US and contrast-enhanced ultrasound of the marginal zone. The ultrasound signs of the marginal zone of the malignant masses contribute more to the diagnosis of breast cancer than the internal, therefore, focusing on the marginal zone ultrasound characteristics can improve the ability of differential diagnosis between benign and malignant breast mass.
[Key words] Breast masses; Marginal zone; Breast imaging reporting and data system 4; Contrast-enhanced ultrasound
美国放射学会发布的乳腺影像学报告和数据系统(breast imaging reporting and data system,BI-RADS)指出BI-RADS 4类乳腺肿块恶性理论概率为3%~94%[1]。良、恶性肿块征象存在交叉,如何准确鉴别良、恶性肿块是研究的重点和难点。同时有研究指出,恶性肿块边缘常见的间质反应带是肿瘤生物学行为最活跃的部分[2]。本研究主要探讨BI-RADS 4类乳腺肿块边缘超声造影的征象差异,结合二维超声评价其对BI-RADS 4类乳腺良、恶性肿块的鉴别诊断价值。
1 对象与方法
1.1 研究对象
选取2016年1月~2018年7月就诊于山西医科大学附属第一医院超声科并获得明确病理结果的乳腺病例76例(共77个病灶),按良、恶性肿块分为两组。患者均为女性,年龄21~76岁,平均(47.0±12.1)岁。所有患者均经术后组织病理学证实且术前均未行任何相关治疗。
1.2 超声检查
1.2.1 二维超声检查方法 嘱患者充分暴露乳房及腋窝,采用GE logiqE9 彩色多普勒超声仪观察其二维特征,重点观察病灶的边界是否有毛刺状边缘、周边异常高回声晕及分叶现象。
1.2.2 超声造影检查方法 选择血流最丰富的切面切换造影模式。造影剂声诺维(SonoVue,意大利博莱科公司),经肘静脉团注5.0 mL/人,随即注入5 mL生理盐水,记录造影全过程并存盘。采用双盲法,由2位医师对图像进行分析,出现分歧时需进行讨论达成一致,观察造影后边缘有无增强特征(放射状增强、环状增强及穿支增强等一种或几种均认为有边缘增强特征)及造影后边界是否清晰、有无范围扩大。使用QLAB软件,选择肿块中央区及边缘区各一处血流较丰富的区域为感兴趣区(ROI),自动生成各区域时间-强度曲线(TIC),观察基础强度(BI)、峰值强度(PI)、曲线下面积(AUC)、达峰时间(TTP)、梯度(Grad)参数。分析3次,取平均值。
1.2.3 中央区及边缘区域ROI选取方法 边缘区选取方法:以超声造影后肿块最大范围作为肿块的边界,ROI外界尽量靠近超声造影后病灶增强范围的边界,包含更多的边缘组织,选择椭圆形ROI。中央区选取方法:保证边缘区ROI面积与中央区面积相等,且两个区域ROI位于同一深度,同时两边缘区之间留下间隔,避免圆重合或接触,避开肿瘤粗大滋养血管及坏死区。见图1。
ROI:感兴趣区
1.3 統计学方法
采用SPSS 20.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用百分率表示,组间比较采用χ2检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 病理结果
77个病灶中,恶性组共41例,分别为浸润性导管癌37例,导管内原位癌2例,浸润性小叶癌1例,乳头状癌1例;良性组共36例,分别为纤维腺瘤23例,增生结节11例,导管内乳头状瘤2例。
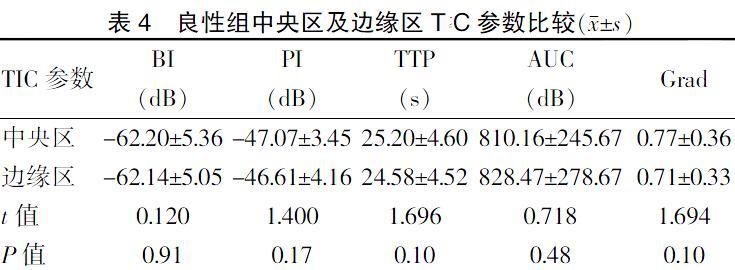
2.2 两组二维超声及超声造影边缘征象比较
与良性组比较,恶性组二维超声多表现为边界不清、边缘毛刺、高回声晕、边缘分叶;超声造影表现为边缘增强、放射状增强、环状增强、穿支增强,造影后边界不清、范围扩大,差异均有统计学意义(均P < 0.05)。见表1~2、图2。
2.3 两组中央区及边缘区TIC参数比较
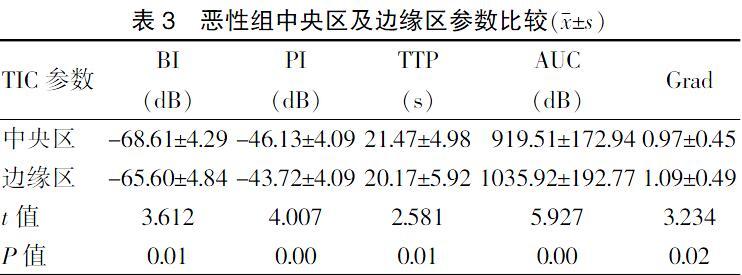
2.3.1 恶性组边缘区与中央区TIC参数比较 恶性组边缘区BI、PI、AUC、Grad均大于中央区,差异均有统计学意义(均P < 0.05);恶性肿块边缘区TTP快于中央区,差异有高度统计学意义(P = 0.01)。见表3、图3(封三)。
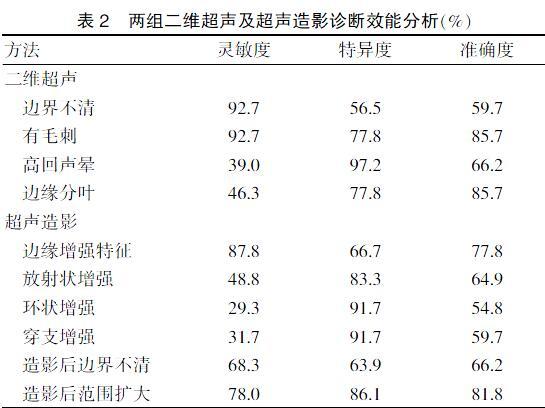
2.3.2 良性组中央区及边缘区TIC参数比较 良性肿块边缘区各参数与中央区比较,差异均无统计学意义(P > 0.05)。见表4。
3 讨论
恶性生长过程中,乳腺癌细胞沿结缔组织和脂肪间隙向外蔓延,周围产生间质反应带,促进肿瘤生长、侵袭、转移及血管生成。本研究通过对肿瘤周边间质反应相关的二维超声及超声造影征象进行研究,发现BI-RADS 4类良、恶性肿块边缘征象存在显著差异(P < 0.05),可帮助提高诊断率。恶性肿瘤细胞及活跃的间质细胞分泌的生长因子及趋化因子多位于肿瘤-间质交界处[3],可促进肿瘤细胞、血管向周围组织浸润性生长,且纤维结缔组织及周围间质先于癌细胞向外延伸[4],形成瘤周毛刺。瘤周毛刺的病理组织学结构有3种:①毛刺中央区为癌细胞团,边缘区为纤维组织;②毛刺基底宽,近根部含癌细胞团,外部主要为增生的纤维组织;③毛刺细长如针,其中没有癌细胞,主要是纤维组织[5]。因此,乳腺癌多表现为边界不清。与中央区比较,肿瘤边缘的血管生长旺盛。乳腺癌新生血管从瘤体实质穿入周围组织,形成放射状增强[6]。为满足肿瘤的生长营养需要形成穿入血管,且恶性肿瘤生长代谢旺盛,随瘤体体积的增大,瘤组织中心微血管密度(MVD)相对减少以致供血不足,出现坏死纤维化[7-8];同时肿瘤周边MVD高于中央区[9],导致肿瘤周边明显增强,超声征象表现为环状强化。
恶性肿瘤多为多中心生长,各部分生长速度不同,互相重叠。杂乱血管影响生长方向,形成分叶状边缘[10]。脂肪组织浸润是高回声晕形成的基础,癌组织、非典型增生、正常的导管和小叶及间质组织等多种成分混杂的不规则界面,与周围脂肪组织形成不规则阻抗差,表现为异常高回声晕[11]。其在本研究中特异度最高,可帮助降低误诊率。本实验显示,与中央区TIC曲线比较,恶性肿块边缘区PI高、TTP快,AUC大,究其原因,有以下几点:①恶性肿块微血管空间分布不平衡,最大MVD位于边缘区[12-13],而中央区多为纤维成分,新生血管少,易变性、坏死及钙化[14];②肿块边缘新生血管排列无序,结构形态杂乱,常见盲端、动静脉吻合等[15-16],形成异常血管网;③新生血管基底膜不完整,细胞裂隙大,缺乏平滑肌,导致血管血流量大、流速快;④多种因素造成恶性肿块边缘区较中央区TIC曲线BI、PI、Grad大,TTP快;⑤恶性肿瘤新生血管通透性增加,肿瘤静脉、淋巴管内癌栓形成造成间质水肿[17-18],故大量造影剂滞留于血管内,造成边缘区的AUC大于中央区。
良性肿块多为膨胀性生长,不侵犯周围组织,超声造影后边界清晰,范围多无扩大[19-20]。本实验良性肿块多为纤维瘤及增生结节,病理基础均可认为是与正常乳腺组织相似的实质及间质成分增生形成的肿块,缺乏血供,血管较均匀的分布于肿块实质及间质内,区域血流灌注差异小。因此,良性肿块边缘多无粗大供血血管且造影后范围多无扩大,边缘区与中央区超声造影的定量参数也未见明显差异,这一部分与李颖嘉等[17]的研究结果一致。但是存在少数边缘增强特征的良性病例,其较恶性肿块的血管管径细,走行自然,增强强度低。
本研究中有2例导管内原位癌,二维超声显示肿块形态规则但边界不清、毛刺较明显;超声造影后显示边界不清、范围扩大,TIC参数与研究结果相符,且肿块在非典型增生阶段已经有血管生成开关的启动,肿块内血管数目增加[21-24],故处于重度不典型增生到恶性演变阶段。但是,本研究未考虑肿块的临床病理特征对恶性肿瘤的影响,有待扩大样本量进一步研究。
综上所述,良、恶性肿块边缘二维超声及超声造影征象存在明显差异,在诊断乳腺癌的贡献中,恶性肿块边缘区超声征象大于中央区,因此对超声造影边缘征象重点关注可提高良、恶性乳腺肿块的鉴别诊断能力。
[参考文献]
[1] DOrsi CJ,Bassett LW,Berg WA,et al. Breast Imaging Reporting and Data System:ACR BI-RADS-Mammography [M]. 4th ed. Reston,VA:American College of Radiology,2003.
[2] 李志宇,何之彦.乳腺癌间质反应的影像学表现研究进展[J].医学影像学杂志,2012,22(4):669-671.
[3] 吴娟,孙圣荣,袁静萍.肿瘤微环境与乳腺癌[J].中国组织化学与细胞化学杂志,2018,27(1):82-86.
[4] 赵妮,姚秀芬,赵素萍.乳腺癌彩色多普勒超声与细胞蛋白表达的相关性研究[J].中国临床医学影像杂志,2016, 27(7):462-466.
[5] 陈红梅.乳腺癌间质反应的X线表现与其侵袭程度关系的研究[D].郑州:郑州大学,2013.
[6] 徐海燕,赵红,邹立巍,等.利用3.0T MR血管成像探讨乳腺癌周围血供特点及相关因素[J].中华全科医学,2016, 14(1):108-110.
[7] 杨晓婧,王法,娜迪热·铁列吾汗.超声造影在乳腺癌新辅助化疗疗效评价中的价值[J].中华实用诊断与治疗杂志,2016,30(4):396-398.
[8] Mcphail LD,Robinson SP. Intrinsic susceptibility MR imaging of chemically induced rat mammary tumors:relationship to histologic assessment of hypoxia and fibrosis [J]. Radiology,2010,254(1):110-118.
[9] Zeng RX,Huang W,Zou Q,et al. MRI in the diagnosis of breast cancer and the correlation between expression of specific receptors and MVD [J]. Journal of Southeast University:Medical Science Edition,2016,35(5):731-736.
[10] 左玮玮,贾亚男,齐赛.乳腺癌钼靶X线肿块边缘征象与Her-2表达的相关性分析[J].河北医科大学学报,2017, 38(4):485-488.
[11] 卓家伟,何以敉,张美恋,等.乳腺癌常规超声及剪切波弹性成像表现与淋巴结转移关系的研究[J].中华超声影像学杂志,2018,27(8):709-713.
[12] 黄小莉,黄向红,王小燕,等.三陰性乳腺癌与非三阴性乳腺癌的超声造影特征探讨[J].中国超声医学杂志,2016,32(9):844-847.
[13] Sarica O,Kaymaz G,Ucar N. Effectiveness of Additional Diagnostic Parameters in Magnetic Resonance Mammography:A Comparative Study with the BI-RADS Classification and Scoring System [J]. J Comput Assist Tomogr,2014,38(6):985-991.
[14] 曾茹雪,黄文,邹庆,等.乳腺癌磁共振诊断表现与特异受体表达和微血管密度特征的相关性研究[J].东南大学学报:医学版,2016,35(5):731-736.
[15] Goddard LM,Iruela-Arispe ML. Cellular and molecular regulation of vascular permeability [J]. Thromb Haemost,2013,109(3):407-415.
[16] Wong PP,Demircioglu F,Ghazaly E,et al. Dual-Action Combination Therapy Enhances Angiogenesis while Reducing Tumor Growth and Spread [J]. Cancer Cell,2015, 27(1):123-137.
[17] 李颖嘉,文戈,何洁.超声造影定量分析对乳腺良恶性肿瘤血流灌注异质性的评价[J].中华超声影像学杂志,2009,18(6):517-520.
[18] 王小燕,贺琰,凌冰,等.乳腺肿块的超声造影特征与病理对照分析[J].中华肿瘤防治杂志,2016,23(10):667-671,676.
[19] 柯霓,陈文卫.乳腺良恶性结节的超声造影模式与病理学对比分析[J].武汉大学学报:医学版,2018,39(4):536-540.
[20] 郭勇军.多普勒超声在乳腺癌诊断中的应用[J].中外医学研究,2018,16(2):60-61.
[21] 李颖嘉,文戈,杨莉.超声造影及其定量分析对乳腺癌恶性转化过程中血管生成作用的评价[J].中华医学杂志,2009,89(9):587-591.
[22] 李超,李明,刘现栋,等.乳腺超声与钼靶X线检查对乳腺癌影像学表现的对比分析[J].医学综述,2017,23(23):4752-4755,4761
[23] 罗晔.超声检查对乳腺肿瘤的诊断价值[J].中外医学研究,2018,16(23):60-61.
[24] 刘真,赵继革,刘全新.高频彩色超声对乳腺导管内乳头状瘤的诊断价值分析[J].中外医学研究,2017,15(30):67-69.
(收稿日期:2019-01-23 本文编辑:任 念)

