模拟增温对小麦生长、土壤酶活性和呼吸的影响
高丽莉, 李凤丹
(1.甘肃农业职业技术学院 园林工程系, 兰州 730020; 2.西北大学 城市与环境学院, 西安 710127)
在社会经济不断深入发展的过程中,居民生活得到了不断改善,但是在对自然资源进行开发利用的过程中也产生了明显的环境问题,对于生态系统健康发展产生了不利影响,原有的气候生态被改变[1-2],气温上升、冰川融化等问题日益突出,使得可持续发展受到了较大挑战,且农业生产也深受影响。随着二氧化碳排放量的不断上升,局地气温上升明显[3],呈现了典型的气候变暖问题,这不仅导致冰川融化加剧,迫使海平面上升,最终导致温室效应的产生[4-5],并带来了较大的影响,不仅直接影响植被生长发育,还影响动植物新陈代谢等。由于气温上升给农作物生长带来了巨大影响,不少学者开展了此方面研究,深入探讨了农作物生长机理的改变,以寻求提升作物抗逆性的途径。对于作物生长初期而言,其发芽状况受到气温的直接影响,过高的温度不利于水分保持及胚芽萌发[6],从而明显降低了其嫩芽成活率,对幼苗生长产生了不利影响;而在其后期生长发育过程中,高温天气不利于作物开花,对于花粉传播也产生不利影响,且在气温过高的情况下籽粒不够饱满,最终降低的是作物产量[7]。此外,微生物活动也受到温度的直接影响,过高的温度不适宜微生物进行有效的有机质分解,同时对于其新陈代谢也起着抑制作用,而养分作用的发挥也离不开适宜的温度,光合作用更是与日照息息相关,因此温度不仅能直接作用土壤生态,更能间接地影响着土壤生态[8]。综合来看,农作物的生长环境受到气候的直接影响,其抗逆性受到气候条件的制约,其生长的土壤环境等也被改变。
对于我国而言,主要的粮食作物是小麦、水稻,水稻因其产量高等优点在南方大面积种植[9],而小麦在北方大面积种植,成为北方大部分地区最主要的粮食作物,其不仅产量较高,更具有较强的生态适应性,因其种植面积广,甚至可以说在调节气候方面起着重要意义[10]。对于内陆甘肃而言,其小麦面积已由原来的133万hm2下降到了100万hm2,主要原因在于种植结构的调整,随着种植技术的提升[11-12],该省在“十二五”时期开展了优质品种的推广,以确保“稳面积提单产”。当前全球变暖成为事实的情况下,作物生长已经不可避免地受到了影响,因此探讨气温升高如何影响小麦生长发育及土壤的理化机理及生态适应性[13]具有重要的现实意义,可为提升小麦产量和质量奠定基础。基于此,本研究在前人研究的基础上,通过小尺度的生态模拟来进行小麦的控制试验,在模拟增温的条件下探究小麦的生长发育特点,同时分析此影响下土壤的理化特性等,进而一方面从小麦生长的角度来分析小麦对气温上升的响应,另一方面从土壤的角度来分析增温对土壤的影响,从而提升小麦适应性,更好地保障甘肃省粮食种植安全,以期为优质高产小麦育种提供有益参考和借鉴。
1 材料与方法
1.1 试验材料
本试验由2015年开始,连续进行3年增温试验,在试验过程中选择的是甘肃农业大学校内春小麦试验田,具体品种是“兰天35号”,增温处理贯穿在整个小麦生长期。该试验区域年均气温接近8.5℃,年均降雨量为550 mm,该区域土壤类型为黄绵土,土壤pH值7.86,有机碳8.03 g/kg,全氮0.89 g/kg,全磷0.86 g/kg,有效磷35.02 mg/kg,速效氮18.31 mg/kg。
1.2 试验设计和方法
试验中将小麦种植在开顶生长室内,模拟增温利用国际通用方法,同时通过随机设区的方式建立5套生长室;然后在其中设置长、宽均为2 m的试验小区共10个,要求高度达到2.5 m,并用氟化玻璃构造,玻璃厚度为0.8 cm,为了降低气体交换则需要在顶部开口且略收紧;之后将其中的5个小区分为增温区开项式生长室(OTC),为了加强试验对比,特设置5个试验小区为对照组(CK)。为了进行模拟增温,各个生长室布放1 000 W的红外辐射加热管,增温采取全天候的模式,为了提升增温效果一致,则要求温差低于0.2℃,对照组则无需加热处理。本试验小区内部采取砖石质栈道,这样能够尽可能地降低动物对小麦的破坏,为了降低试验误差,本试验区内小麦管理举措一致。此外,为了进行数据收集,各个试验小区均布放了AR5数据采集器,每间隔1 h进行1次地面温度及湿度的数据采集,同时对土层10 cm的温度和湿度进行测量,土壤含水量的监测每周1次。
为准确测量土壤呼吸,在试验小区的边缘布放土壤呼吸底座,要求直径及高度分别为20,10 cm,同时对其中的杂草定期清理以提升测量准确性。此外,为提前平衡起生态环境,提前1个月在土壤中将PVC测量圈布放其中,并在上午定期进行土壤呼吸数据采集,频率为每周1次。
1.3 小麦生长各指标测定
为了进行成熟叶片的指标测定,本试验于2016年—2017年8月底进行地上生物量采集,以0.25 m2为单位进行小麦地上部分收割,并分别在OTC和CK小区内进行,之后将采集的成熟叶片送回实验室,首先65℃烘干处理,待其达到恒重则备用指标测量。然后进行土壤采集,要求从地表向下15 cm,重量超过2 kg,速封后带回,在过筛前去除杂质,置于4℃下保存。
1.3.1 小麦生长和生理指标的测定
(1) 小麦的生理指标在各个小区选取10株小麦,要求长势基本接近,之后对株高、茎粗进行测量,要求精度达到0.01 cm;然后利用扫描仪对其叶面积进行测定,最后在收割,在其晒干后称重[14]。
(2) 根冠比(R/S)为了测量小麦的地下生长部分,将其根系挖出,并利用塑料袋将地上及地下部分分开,过40目筛后流水冲洗,在最终称重之前在65℃下烘干。
(3) 叶片的养分。首先采集成熟叶片并将其洗净,之后再烘干粉碎,分别利用染色法、比色法对可溶蛋白及糖进行测定[15]。
1.3.2 小麦土壤酶活性的测定 针对不同生长阶段的小麦,分别按照上述方法进行土样采集,并对土壤养分进行指标测定,对其蔗糖及脲酶活性的测定借助于比色法进行,对转化酶活性的测定借助于光度法[16]。
1.4 数据分析
采用SPSS 21.0和Excel 2007.0进行方差分析(One-way ANOVA)和数据统计,LSD检验各处理之间的显著性。
2 结果与分析
2.1 模拟增温对小麦根区土壤温度和湿度的影响
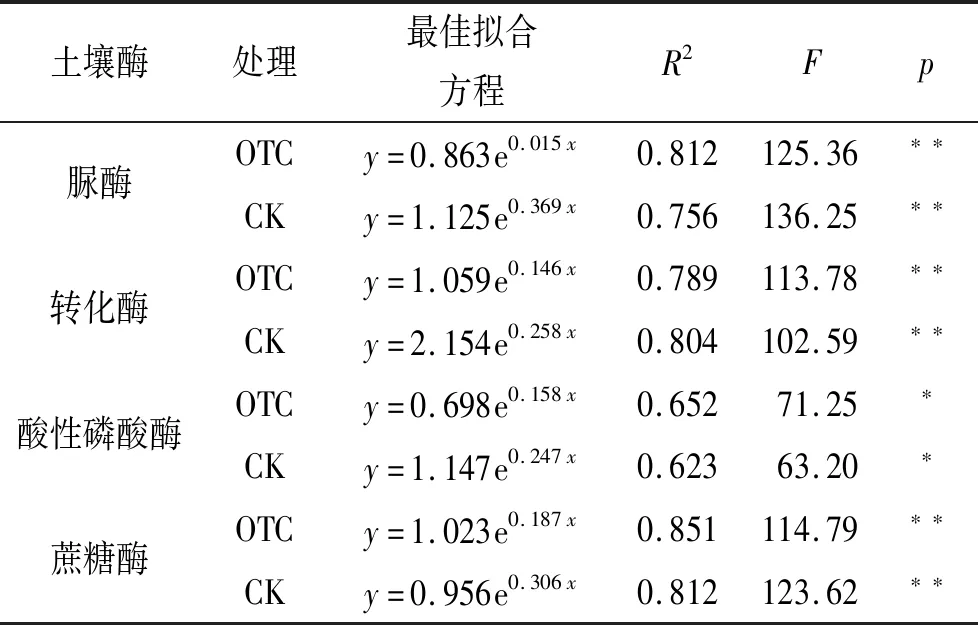
由图1可知,小麦的整个生长期土壤温度和湿度均呈现出季节性变化规律,OTC和CK土壤温度变化范围为9.2~15.3℃,7.5~12.6℃,随着生长季的增加呈先增加后降低趋势,在拔节期最大,相同时期土壤温度均表现为OTC>CK,二者之间在拔节期和抽穗期差距较大,在二者差距最小。OTC和CK土壤湿度变化范围为4.9%~8.3%,5.7%~12.3%,随着生长季的增加呈先降低后增加而后降低趋势,相同时期土壤湿度均表现为OTC 图1 模拟增温对小麦根区土壤温度和湿度的影响 由图2可知,模拟增温显著影响了小麦根区土壤酶活性,OTC土壤脲酶、转化酶、酸性磷酸酶和蔗糖酶变化范围为2.6~8.5,1.6~4.9,1.9~7.6,0.9~4.2 mg/(g·d),CK土壤脲酶、转化酶、酸性磷酸酶和蔗糖酶变化范围为2.3~8.1,1.5~4.1,1.8~5.3,0.8~4.1 mg/(g·d);随生长期的变化,土壤脲酶、转化酶、酸性磷酸酶和蔗糖酶呈先增加后降低趋势,在抽穗期达到最大,相同时期小麦土壤酶活性均表现为OTC>CK;与CK相比,在不同生长时期,OTC小麦土壤脲酶分别高出13.04%,10.42%,4.94%,5.13%;土壤转化酶分别高出6.67%,18.75%,19.51%,3.85%;土壤碱性磷酸酶分别高出5.56%,7.69%,43.40%,-2.78%;土壤蔗糖酶分别高出12.50%,19.05%,2.44%,12.50%。土壤酶活性与土壤温度进行回归分析,筛选出最佳拟合曲线(一元指数模型),由表1可知,在小麦的整个生长期,OTC和CK土壤酶活性和土壤温度呈显著的指数关系(p<0.05),且OTC土壤对温度具有较高的敏感性。 表1 小麦根区土壤酶活性与增温的指数关系 注:y为土壤酶活性,x为土壤温度,*代表p<0.05,**代表p<0.01,下表同。 由图3可知,模拟增温显著影响了小麦根区土壤呼吸,OTC和CK土壤呼吸变化范围为1.62~6.24,1.52~6.19 μmol/(m2·s);随生长期的变化,土壤呼吸呈先增加后降低趋势,在抽穗期达到最大,相同时期小麦土壤呼吸均表现为OTC>CK;与CK相比,在不同生长时期,OTC小麦土壤呼吸分别高出6.58%,10.49%,0.81%,36.65%;由表2可知,在小麦的整个生长期,OTC和CK土壤酶活性和土壤温度呈显著的指数关系(p<0.05)。 图2 模拟增温对小麦土壤酶活性的影响 表2 小麦土壤呼吸与增温的指数关系 由表3可知,模拟增温显著影响了小麦生长特性。小麦生长特性各指标均表现为OTC>CK,其中小麦株高、叶面积指数和穗粒数均表现为OTC>CK(p<0.05),比叶重、R/S没有显著差异(p>0.05);与CK相比,OTC小麦株高、茎粗、叶面积指数(LAI)、比叶重、R/S、穗粒数和千粒重分别高出14.49%,19.510%,1.57%,15.70%,3.25%,32.82%,8.14%。 图3 模拟增温对生长期小麦土壤呼吸的影响 表3 模拟增温对小麦生长特性的影响 注:同列相同小写字母表示在0.05水平差异不显著。 为了探究温度对作物的生长发育影响,常用模拟增温的方法进行试验对比分析,其中开放式红外增温较为常用[17-18]。本研究通过小尺度的生态模拟来进行小麦的控制试验,在模拟增温的条件下探究小麦的生长发育特点,同时分析此影响下土壤的理化特性等,进而一方面从小麦生长的角度来分析小麦对气温上升的响应,另一方面从土壤的角度来分析增温对土壤的影响。通过试验发现,就整个小麦生长季而言,同期内OTC条件下土壤温度高于对照组CK,而湿度则与之相反,这也印证了以往学者的研究[19-21]。在增温处理下,土壤温度上升,但湿度下降,植株长势快,具有更多的分蘖,同时具有更大的叶面积,比叶重及R/S也更高,这说明在增温处理下小麦生长发育得以提升[19-21],究其原因在于增温促进了小麦的光合作用,加速了物质合成,发达的根系利用吸收土壤的养分和水分以促进小麦生长发育,因此来说,本试验的增温处理对小麦的光合作用和新陈代谢起着重要的促进作用,这也是小麦对温度的适应机理之一[8-10]。 作为小麦生长发育的基础,物质和能量代谢明显受到温度影响[22]。在试验过程中的相同时期,增温处理下的小麦叶绿素含量上升,从而提升了光合作用能力,利于物质和能量转化,利于小麦生长发育和产量的提升;此外,可溶性蛋白及糖含量也不断上升[5-6,22],在此影响下,小麦机体构建物质的能力提升,有利于营养干物质的积累[23]。对于小麦而言,不同的生长期对增温的反应不尽相同,但整体来说增温利于小麦生长,主要原因在于不同温度下小麦合成及分解营养物质的能力有所差异,此外,土壤温度对微生物活动产生了影响,进而微生物活动参与到小麦对养分的利用。 土壤生物化学反应不仅受到酶活性的直接制约,同时还和土壤呼吸密切相关,生化反应的方向受到这两方面的影响,而且反应强度也受到制约[18]。温度作为重要的环境因子,在酶活性作用过程中发挥着无可替代的作用,尤其是当前温度上升已然成为事实的情况下,酶活性对于土壤及作物生长尤为重要[24-26]。通过实现发现,在OTC处理下小麦试验区的土壤呼吸得以明显提升,而且土壤酶活性也得到了明显增强[18],这也印证了以往学者的研究;此外,研究得知温度与土壤呼吸、酶活性之间存在显著的指数关系[20],这表明在温度上升的情况下,对土壤呼吸和酶活性起促进作用,而且土壤养分有效性也得以提升,利于土壤微生物活动和新陈代谢,从而增强土壤物质循环和能量转化[25-26],提升土壤活性和肥力,最终利于作物生长发育。 本试验是在小尺度的控温下进行,难以避免地与自然状态下升温产生差异,因此温度上升对小麦的影响还需要从多个方面进行探究,尤其是自然状态下温度上升对小麦生长发育的作用机理及小麦的响应,此外,水分、光照及二氧化碳通量等微环境因子也会对小麦生长产生重要影响,依然有待于进一步研究,这也是未来温度上升对小麦影响需要探究的方向,从而更深入了解温度上升情况下小麦的生长发育过程与机理。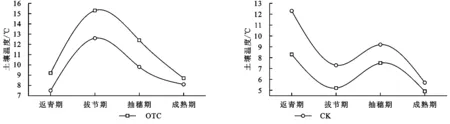
2.2 模拟增温对小麦根区土壤酶活性的影响
2.3 模拟增温对小麦根区土壤呼吸的影响


2.4 模拟增温对小麦生长特性的影响


3 讨论与结论

