木蹄层孔菌产锰过氧化物酶的碳氮源优化及酶学性质
尚洁


摘要:锰过氧化物酶是环境工程研究领域广泛关注的酶之一,它能够促进生物燃料合成,促使木质素和污染物降解等工业生物过程更好进行。研究木蹄层孔菌产锰过氧化酶的最适碳源和氮源,揭示锰过氧化物酶的培养方式、最适pH值和pH耐受性、最适温度和温度耐受性、金属离子对其影响等特征。木蹄层孔菌在静置培养时产锰过氧化物酶显著高于振荡培养。小麦麸皮23 g/L和蛋白胨2 g/L是最佳组合的碳源和氮源。锰过氧化物酶在pH值为4.5或温度为50 ℃时酶活力最高。酶在pH值4.0~4.5或温度30 ℃以下处理24 h后,仍可保持80%以上的酶活力。底物为愈创木酚时,锰过氧化物酶的Km值为0.34 mmol/L,Vmax为0.12 mmol/L·min。当添加的金属离子浓度为1 mmol/L,与对照相比,K+、Ca2+、Ba2+、Co2+和Na+可极显著抑制MnP活力。当添加的金属离子浓度为10 mmol/L,与对照相比,除Mg2+外,其他金属离子均能极显著抑制酶的活力。Mg2+ 1、10 mmol/L对酶的活力没有影响。木蹄层孔菌适合在静置培养时产锰过氧化物酶,最适碳源和氮源分别为小麦麦麸和蛋白胨,酶在室温和偏酸性环境中耐受性较好,并对Mg2+有较好耐受性。
关键词:木蹄层孔菌;锰过氧化物酶;碳氮源;酶学性质
中图分类号: S182
文献标志码: A
文章编号:1002-1302(2019)15-0273-05
木质素是自然界中在数量上仅次于纤维素的第二大生物高分子材料,在能源和日用化工品应用方面具有巨大的潜在价值。锰过氧化物酶(MnP,E.C. 1.11.1.13)是一种含有血红素和Mn2+结合部位的过氧化物酶,它在木质素降解过程中发挥着重要的作用。MnP通过氧化Mn2+为Mn3+直接氧化木质素,并将Mn3+分泌到胞外。除了解聚天然和合成木质素,MnP还具有修复工业废料的巨大潜能,如降解难处理的工业污染物。MnP能够有效地进行合成染料的脱色,如甲基橙[1]和三苯甲烷类染料[2],这种潜在的能力已经引起了广泛的关注。除了染料脱色,白腐真菌分泌的MnP还可以用于降解持久性有机污染物,如多环芳烃[3]、2,4,6-三硝基甲苯[4]和联苯中间代谢物[5]。如何提高白腐真菌MnP产量,提高酶的活性成为人们日益关心的问题。因此,产酶条件的优化和酶学特性的研究,将有助于MnP的产量增加,酶活力的提高,使MnP能够在未来更好地应用于各个领域。木蹄层孔菌(Fomes fomentarius)是担子菌门的一种白腐真菌,常见于桦树和杨树,广泛存在于非洲、亚洲、欧洲和北美洲,在我国主要分布于东北地区、西北地区和西南地区。前期研究发现,木蹄层孔菌能够有效降解白桦中的木质素,保留较高含量的纤维素和较低含量的1% NaOH和苯醇抽出物[6],在白桦生物转化中具有潜在的应用价值。本研究进行了木蹄层孔菌产MnP的碳氮源优化及酶学性质研究,旨在为今后MnP的利用提供相关理论依据。
1 材料与方法
1.1 材料
试验于2013年9月至2014年3月在宁夏回族自治区北方民族大学进行。木蹄层孔菌为北方民族大学生物化学实验室保存,4 ℃生长于木屑麦麸培养基(78%白桦木屑、20%麦麸、1% CaSO4·H2O、1%蔗糖)。马铃薯葡萄糖琼脂(PDA)培养基(1 L):马铃薯200 g、葡萄糖20 g、琼脂20 g、pH值自然。基础培养基[7](1 L):葡萄糖 10.0 g、酒石酸胺0.2 g、KH2PO4 2.0 g、MgSO4 0.5 g、CaCl2 0.1 g、琥珀酸(二)甲酯 1.3 mL、微量元素70.0 mL、硫胺素(维生素B1)1.0 mg。其中微量元素1 L:MgSO4 3.0 g、MnSO4 0.5 g、NaCl 1 g、FeSO4·7H2O 0.1 g、CaCl2 0.1 g、ZnSO4·7H2O 0.1 g、CuSO4 0.1 g、KAl(SO4)2·12H2O 10.0 mg、NaMoO4·2H2O 10.0 mg、次氮基三乙酸酯(NTA)1.5 g。
1.2 方法
1.2.1 粗酶液的制备 将木蹄层孔菌接种到PDA固體培养基上,28 ℃避光培养约7 d待菌丝长满培养皿。取2个直径6 mm的菌饼接入装有15 mL液体培养基的三角瓶(100 mL)中,28 ℃避光静置培养。另取6个直径为6 mm的菌饼接入装有45 mL液体培养基的三角瓶(100 mL)中,28 ℃ 180 r/min 避光振荡培养。取液体培养基,4 ℃ 10 000 r/min离心10 min,取上清液即为粗酶液。
1.2.2 MnP活力测定 MnP酶活定义为1 min内催化氧化 1 μmol/L 愈创木酚所需的酶量为1个酶活力单位(U)。酶活测定体系包括500 μL的粗酶液,300 μL的4 mmol/L的愈创木酚溶液,1 500 μL的酒石酸钠缓冲溶液(0.1 mol/L,pH值5),60 μL的10 mmol/L的MnSO4溶液,60 μL的5 mmol/L H2O2,580 μL的H2O。测定温度为30 ℃时,465 nm[ε=1.21×104 L/(mol·cm)]波长处2 min内吸光度的变化。
1.2.3 碳源和氮源的优化 试验采用单因素试验,考察不同碳源和氮源对木蹄层孔菌产MnP的影响。根据单因素试验结果,对最佳碳源和氮源进行2个因素4个水平正交试验,以获得碳源和氮源的最佳浓度。正交试验因素水平见表1。
1.2.4 酶反应的最适pH值和pH值耐受性 分别在温度 4 ℃,pH值为3.5、4.0、4.5、5.0、5.5、6.0的缓冲液中测定粗酶液中MnP活力。同时,将粗酶液和pH值为3.0、3.5、4.0、45、5.0、5.5、6.0的缓冲液混合温度为在4 ℃保持1 h和 24 h,测定粗酶液中MnP活力。试验中的最高酶活定义为100%。
1.2.5 酶反应的最适温度和热耐受性 在最适pH值,温度为20、30、40、50、60、70、80 ℃条件下分别测定粗酶液中MnP活力。同时,分别在温度为20、30、40、50、60 ℃条件下将粗酶液保温1 h和24 h,测定粗酶液中MnP活力。试验中的最高酶活力定义为100%。
1.2.6 金属离子对酶反应的影响 在粗酶液中分别添加终浓度为1 mmol/L和10 mmol/L的钙(Ca2+)、铁(Fe2+)、镁(Mg2+)、铜(Cu2+)、钡(Ba2+)、锰(Mn2+)、锌(Zn2+)、钠(Na+)、钴(Co2+)、钾(K+)。最适pH值条件下,温度为 30 ℃ 保温1 h后测定粗酶液中MnP活力。试验中未添加金属离子的酶活定义为100%。
1.2.7 MnP的动力学研究 当愈创木酚浓度为0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.10 mmol/L时,测定粗酶液中的MnP活力。
1.2.8 统计分析 本试验中所有数据均平行重复3次,结果为“平均值±标准差”。结果使用统计分析软件SPSS进行邓肯多重比较。
2 结果与分析
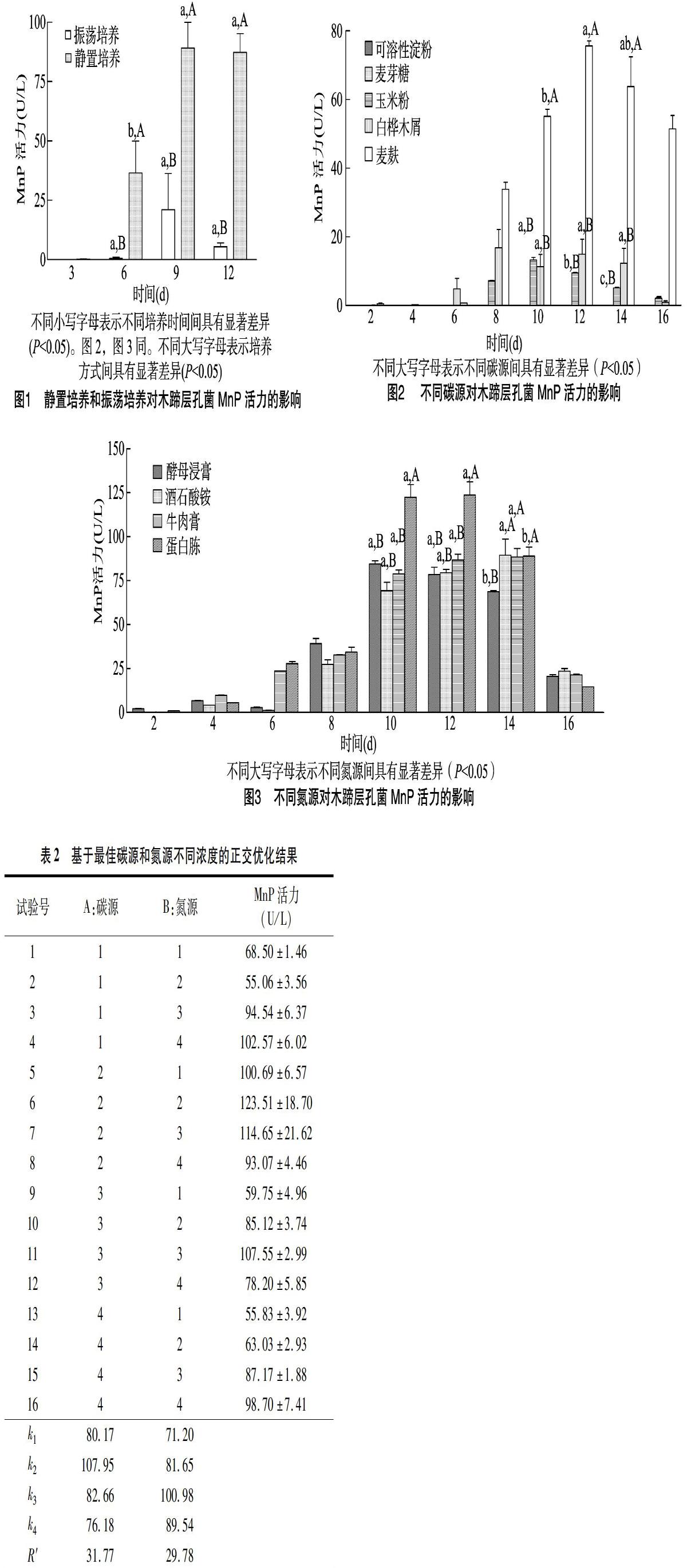
2.1 培养方式对木蹄层孔菌产MnP的影响
振荡培养和静置培养对木蹄层孔菌MnP活力的影响,结果见图1。将木蹄层孔菌在液体培养基中分别培养6、9、12 d后,静置培养产生的MnP活力均显著高于振荡培养。其中,静置培养9 d产生的MnP活力最大,达到89.16 U/L,相同条件下静置培养是振荡培养(21.04 U/L)的4.2倍。同时研究发现,静置培养9 d与静置培养12 d的酶活力差异不显著。
2.2 碳源和氮源的选择
2.2.1 不同碳源的选择 在培养基中分别添加10 g/L的可溶性淀粉、麦芽糖、玉米粉、白桦木屑、麦麸作为碳源,研究不同碳源对木蹄层孔菌MnP活力的影响。试验结果见图2,以麦麸作为碳源时,在10、12、14 d产生的MnP活力均显著高于以玉米粉、白桦木屑作为碳源产生的酶活力。以麦麸作为碳源时,在12、14 d所产生的MnP活力无显著差异。以可溶性淀粉、麦芽糖作为碳源时,在整个培养期间,均未测得酶活。结果表明,以麦麸作为碳源,可以有效促进木蹄层孔菌MnP的产生,而可溶性淀粉和麦芽糖作为碳源不利于MnP的分泌。
2.2.2 不同氮源的选择 在培养基中添加10 g/L麦麸为碳源,分别添加0.2 g/L的酵母浸膏、酒石酸铵、牛肉膏、蛋白胨作为氮源,研究对木蹄层孔菌MnP活力的影响。试验结果见图3,4种不同的氮源处理所产MnP的活力,均在10~14 d内达到最大值,其中以蛋白胨作为氮源时,在10、12 d测得的MnP活力最高,均显著高于其他氮源测得的酶活。研究发现以蛋白胨为氮源时,10、12 d所产MnP活力并无显著差异。结果表明,蛋白质可以作为木蹄层孔菌产MnP的有效氮源,培养10 d即可获得理想的MnP产量,延长培养时间不利于MnP的有效积累。
2.3 碳源和氮源正交试验
基于上述碳源和氮源不同浓度的影响结果,设计2个因素4个水平正交表优化木蹄层孔菌产MnP的碳源和氮源浓度(表2)。正交试验结果显示,碳源对木蹄层孔菌MnP活力的影响最明显,氮源其次。本试验以培养10 d的MnP活力为主要指标,确定最佳MnP活力条件为麦麸23 g/L,蛋白胨 2 g/L。在此条件下MnP活力可达123.51 U/L,比优化前MnP活力提高了38.52%。
2.4 酶反應的最适pH值和pH耐受性
取静置培养10 d的粗酶液,以愈创木酚作为底物,在pH值3.5~6.0范围内,测定木蹄层孔菌MnP的最适pH值。结果显示,随着pH值的增加,MnP的活力逐渐增加,在pH值4.5时达到最大值,之后随着pH值的进一步升高,酶活力逐渐降低。其中,在pH值为4~5之间时,MnP均具有较高的酶活力,相对酶活均大于80%。在pH值4.5时MnP酶活力与pH值4和pH值5时相比差异显著,结果表明,木蹄层孔菌MnP的最适pH值为4.5(图4-A)。
在温度为4 ℃时,分别将粗酶液置于pH值为3~6的缓冲液中处理1 h和24 h,研究木蹄层孔菌pH值耐受性。结果显示,在pH值4.5和pH值5.0条件下分别处理 1 h 和24 h后,木蹄层孔菌MnP相对酶活力均能保持在89%以上,2种条件下测得的酶活力差异不显著。结果表明,木蹄层孔菌MnP在pH值4.5~5.0之间具有较好的耐受性(图4-B)。
2.5 酶反应的最适温度和温度耐受性
取粗酶液在温度为20~80 ℃条件下测定木蹄层孔菌MnP活力,研究其最适温度,结果见图5-A。随着温度的升高,MnP活力逐渐增加,当温度达到50 ℃时MnP活力达到最大,随着温度的进一步升高,MnP活力逐渐降低。其中,在温度为50、60 ℃条件下测得的MnP活力差异不显著,因此,确定木蹄层孔菌MnP的最适反应温度在50~60 ℃之间。
取粗酶液分别在温度为20~60 ℃条件下保温1 h和 24 h,研究木蹄层孔菌MnP的温度耐受性。结果见图5-B,当温度超过30 ℃时,粗酶液在保温1 h和24 h以后,酶活均开始降低。同一温度下MnP保温时间越长,酶活丧失越多。保温 1 h 时,温度为30、40 ℃的相对酶活几乎都保持在90%以上,并且2个温度的酶活变化差异不显著。保温24 h时,温度为20、30 ℃的酶活都保持在87%以上,但是温度超过 30 ℃ 时,酶活急剧丧失,当温度达40 ℃时,相对酶活只有63.92%。
2.6 金属离子对酶活力的影响
选取10种金属离子,研究1、10 mmol/L金属离子对木蹄层孔菌MnP活力的影响,结果见图6。当金属离子浓度为 1 mmol/L 时,与对照相比,粗酶液中添加Ba2+、K+、Ca2+、Co2+和Na+对木蹄层孔菌MnP活力具有显著抑制作用;而添加Zn2+、Cu2+和Fe2+对MnP活力无显著影响。当金属离子浓度为10 mmol/L时,除了Mg2+与对照无显著差异外,其他金属离子均表现出对MnP活力具有极显著的抑制作用,其中Mn2+和Co2+对酶活的抑制作用最大,相对酶活分别降低至20.92%和29.93%。在反应液中Mg2+浓度为1 mmol/L和10 mmol/L时,MnP相对酶活分别为93.76%和97.72%,表明Mg2+对MnP酶活几乎没有影响,差异不显著。
2.7 MnP的酶动力学研究
以愈创木酚作为底物的Lineweaver-Burk见图7,木蹄层孔菌MnP的米氏常数(Km)是0.34 mmol/L,最大速度(vmax)是0.12 mmol/(L·min)。Km值的大小一般能够体现酶对底物的亲和力大小。以愈创木酚作为底物,木蹄层孔菌MnP测得的Km较小,说明木蹄层孔菌MnP对愈创木酚亲和力较大。
3 讨论与结论
已有相关文献报道,白腐真菌产木质素酶的培养方式多选择振荡培养[8-9],可能因为振动培养可以增加细胞和培养基之间氧的传递,同时增加生物量以及酶的产量。但是在木蹄层孔菌中发现,振荡培养测得的MnP酶活力远远低于静置
培养时,可能因为振荡培养会使木蹄层孔菌形成菌丝球,不利于分泌MnP,也可能振荡培养会使部分MnP因机械损伤失去活力。在对Pleurotus ostreatus的研究中也发现,其产生的木质素酶漆酶在静置培养时产量明显高于振荡培养[10]。
木蹄层孔菌MnP活力的最适pH值是4.5,在pH值 4.5~5.0之间时的耐受性最好,这与大多数研究报道的真菌[8,11-13]MnP相同,也介于4.0~5.5之间。木蹄层孔菌MnP的最适反应温度是50 ℃,温度为20~30 ℃时MnP的稳定性较好,在木质层孔菌和Echinodontium taxodii 2538中发现的MnP的最适温度分别为52、55 ℃[9]。
Mg2+(1、10 mmol/L)对木蹄层孔菌MnP活力没有影响,本结果与对木质层孔菌MnP酶的研究结果[13]相同。数据显示,1 mmol/L的Mn2+对木蹄层孔菌MnP活力没有显著影响,10 mmol/L Mn2+显著抑制MnP活力。尽管已有研究表明,金属离子Mn2+在很多白腐真菌中被认为是一种强有力的产酶诱导剂[14-15],但是在木蹄层孔菌中却表现了对锰过氧化物酶产生抑制作用,具体原因还有待于进一步研究阐明。
本研究获得了木蹄层孔菌产MnP的最适培养方式为静止浅层培养,最佳碳源和氮源组合为小麦麸皮23 g/L、蛋白胨2 g/L。同时发现含木质纤维素的碳源有利于MnP的合成。木蹄层孔菌MnP的pH值耐受范围位于酸性区域,室温条件下稳定性较好,对Mg2+具有较好的耐受性。
参考文献:
[1]董 明,于晓龙,孙 暠,等. 不同培养条件下锰过氧化物酶(MnP)的合成及其对甲基橙的降解[J]. 环境工程学报,2015,9(5):2510-2514.
[2]杨秀清,李树仁,沈 翀,等. 耐过氧化氢的锰过氧化物酶对三苯甲烷类染料的脱色[J]. 微生物学通报,2013,40(8):1356-1364.
[3]Gupte A,Tripathi A,Patel H,et al. Gupte S. bioremediation of polycyclic aromatic hydrocarbon(PAHs):a perspective[J]. Open Biotech J,2016,10(1):363-378.
[4]van A B,Hofrichter M,Scheibner K,et al. Transformation and mineralization of 2,4,6-trinitrotoluene(TNT)by manganese peroxidase from the white-rot basidiomycete Phlebia radiata[J]. Biodegradation,1999,10(2):83-91.
[5]楊秀清,张新宪. 白腐菌SQ01锰过氧化物酶对联苯中间代谢物的转化[J]. 微生物学报,2016,56(6):1044-1055.
[6]Shang J,Yan S P,Wang Q Y. Degradation mechanism and chemical component changes in Betula platyphylla wood by wood-rot fungi[J]. BioResources,2013,8(4):6066-6077.
[7]Tien M,Kirk T K. Lignin-degrading enzyme from the hymenomycete Phanerochaete chrysosporium burds[J]. Science,1983,221(4611):661-663.
[8]Zhang H,Zhang S,He F,et al. Characterization of a manganese peroxidase from white-rot fungus Trametes sp. 48424 with strong ability of degrading different types of dyes and polycyclic aromatic hydrocarbons[J]. J Hazard Mater,2016,320:265-277.
[9]Kong W,Chen H,Si L,et al. Characterization of a novel manganese peroxidase from white-rot fungus Echinodontium taxodii 2538,and its use for the degradation of lignin-related compounds[J]. Process Biochemistry,2016,51(11):1776-1783.
[10]Hou H M,Zhou J T,Wang J,et al. Enhancement of laccase production by Pleurotus ostreatus and its use for the decolorization of anthraquinone dye[J]. Process Biochemistry,2004,39(11):1415-1419.
[11]Knop D,Yarden O,Hadar Y. The ligninolytic peroxidases in the genus Pleurotus:divergence in activities,expression,and potential applications[J]. Applied Microbiology and Biotechnology,2015,99(3):1025.
[12]Sklenar J,Niku-Paavola M L,Santos S,et al. Isolation and characterization of novel pI 4.8 MnP isoenzyme from white-rot fungus Irpex lacteus[J]. Enzyme and Microbial Technology,2010,46(7):550-556.
[13]崔艳红,韩庆功,常魁珍,等. 木质层孔菌产锰过氧化物酶条件的优化及酶学性质研究[J]. 饲料工业,2012,33(12):55-59.
[14]Boer C G,Obici L,de Souza C G,et al. Decolorization of synthetic dyes by solid state cultures of Lentinula (Lentinus) edodes producing manganese peroxidase as the main ligninolytic enzyme[J]. Bioresource Technology,2004,94(2):107-112.
[15]Asgher M,Ramzan M,Bilal M. Purification and characterization of manganese peroxidases from native and mutant Trametes versicolor IBL-04[J]. Chinese Journal of Catalysis,2016,37(4):561-570. 陳小敏,李伟光,陈汇林,等. 海南岛橡胶割胶气候适宜度评价指标的建立及应用——以儋州市为例[J]. 江苏农业科学,2019,47(15):278-281.

