防治西洋参立枯病木霉菌株的筛选鉴定及其小区防治效果
李纪顺,陈凯,王贻莲,李红梅,唐永辉,魏艳丽,扈进冬,赵忠娟,杨合同
(1.齐鲁工业大学(山东省科学院),山东省科学院生态研究所,山东省应用微生物重点实验室,山东 济南 250103;2.荣成市农业农村事务服务中心,山东 荣成 264300)
西洋参PanaxquinquefoliumL.又名花旗参、洋参等,五加科人参属植物,具有抗肿瘤、抗疲劳、抗心律失常、増强机体免疫力等多种功效,既是名贵上品中药,又是高级滋补佳品[1-3]。西洋参原产于美国和加拿大,我国于20世纪70年代末期开始引种,主产区集中在东北、华北、华东的胶东半岛和西北的汉中地区[4-5]。西洋参成药周期一般为4年,忌地性极强,在生产上存在严重的连作障碍,其中土壤微生态失衡和土传病害的泛滥是导致连作障碍的重要原因[6-8]。立枯病是西洋参苗期的主要病害,其病原菌为立枯丝核菌(Rhizoctoniasolani),一般发病率在20%以上,严重地块高达50%,甚至造成参苗成片死亡,目前主要的防治措施是化学药剂防治,但容易造成农药污染以及病原菌产生耐药性[9-10]。对西洋参真菌病害特别是苗期立枯病的生物防治研究报道较少,张爱华等[11]通过木霉30371菌剂和放线菌F05菌剂复配使用,使西洋参立枯病的防效达46%,使西洋参锈腐病的盆栽和田间相对防效分别达88.93%和44.57%,防治效果不理想。如何有效控制西洋参病害,提高产品品质,保护生态环境,成为西洋参生产中亟需解决的问题。
木霉(Trichodermaspp.)是自然界广泛分布的真菌,研究表明木霉具有多种生防机制,至少对18个属20余种病原真菌和多种病原细菌有拮抗作用,可在多种逆境下生存和定殖,能够有效利用环境中的营养物质,抑制植物病害,促进植物生长和诱导植物系统抗性等。目前国际上有60多个国家使用100多种含有木霉菌成分的生物制剂产品[12-14]。不同木霉菌株的生防效果不同,故筛选高效广谱的木霉菌株以及正确的施用方法至关重要[15]。
本实验室一直从事木霉菌株的筛选与生物活性研究,前期已分离到多株木霉菌株,研究表明其对多种植物真菌病害具有较好的防治效果及抗逆增产功能[16-17]。本文在前期工作基础上,通过抑菌实验筛选高效抑制西洋参立枯病的木霉菌株,并在小区条件下进行防治效果评价,为病害防治及高效无毒微生物农药的推广应用奠定基础。
1 材料与方法
1.1 供试菌株
生防木霉为实验室前期筛选的10株效果较好的木霉菌株。病原真菌为西洋参立枯病菌(RhizoctoniasolaniKuehn)、西洋参黑斑病菌(AlternariapanaxWhetz)、西洋参疫病菌(Phytophthoracactorum)、西洋参猝倒病菌(PythiumdelaryanumHess)、西洋参灰霉病菌(Botrytiscinerea)、西洋参炭疽病菌(ColletotrichumpanacicolaUyeda et Takim),由本实验室分离自山东荣成西洋参感病植株。西洋参锈腐病菌(Cylindrocarpondestructans)ACCC39132及西洋参根腐病菌(Fusariumsolani)ACCC37121,购自中国农业微生物菌种保藏管理中心。
1.2 试剂与培养基
PDA(potato dextrose agar)培养基:马铃薯200 g、葡萄糖20 g、琼脂15 g、蒸馏水1000 mL。
SNA(synthetic low nutrient agar)培养基:KH2PO41.0 g、KNO31.0 g、MgSO4·7H2O 0.5 g、KCl 0.5 g、葡萄糖0.2 g、蔗糖0.2 g、琼脂15 g、蒸馏水1000 mL。
CMD(corn meal dextrose)培养基:玉米粉30 g、葡萄糖20 g、琼脂15 g、蒸馏水1000 mL。
西洋参种子:供试西洋参种子为自采。
化学药剂:体积分数为2.5%的咯菌腈悬浮种衣剂、33.5 g/L精甲霜灵、25 g/L咯菌腈。
仪器:Fungal DNA Mini Kit试剂盒(Omega公司);Ta KaRaTaqTM聚合酶(宝生物工程(大连)有限公司),CX31显微镜(Olympus公司);MyCycler PCR仪(Bio-Rad公司);GenoSens 1880凝胶成像分析系统(上海勤翔科学仪器有限公司)。
1.3 木霉与病原真菌的平板对峙培养实验
利用对峙实验筛选对立枯病菌抑制效果较好的木霉,并测定优良木霉的抑菌谱。PDA平板直径两端距中心35 mm处分别接种直径5 mm的木霉菌株和病原真菌,以只接种病原真菌为对照,25 ℃培养6 d,对于生长缓慢的病原真菌,预培养1~2 d后再接种木霉对峙培养,记录病原真菌对峙方向生长半径,计算抑制率(RI)。
(1)
其中r0为对照病菌生长半径,r为与木霉对峙培养的病菌生长半径。
1.4 木霉可湿性粉剂制备
通过对峙培养,筛选可用于小区试验的木霉菌株。以硅藻土为载体,制备木霉的可湿性粉剂,制剂初始分生孢子量为2亿/g,水分为5%~10%。
1.5 木霉制剂防治西洋参立枯病小区试验
1.5.1 拌种处理
试验时间为2015-10-30—2016-11-07,在山东省荣成市上庄镇东上庄村西洋参种植地进行,该地块上年立枯病发病率中等偏上。试验设5个处理:CK(清水对照);化学药剂,体积分数为2.5%的咯菌腈悬浮种衣剂,10 mL稀释为原浓度1/5后拌种2~3 kg西洋参种子;HB20111可湿性粉剂,200~300 g稀释为原浓度1/5后拌种10 kg西洋参种子;QT21979可湿性粉剂,200~300 g稀释为原浓度1/5后拌种10 kg西洋参种子;TW21990可湿性粉剂,200~300 g稀释为原浓度1/5后拌种10 kg西洋参种子。小区面积10 m2,每小区播种数量一致的西洋参种子,设保护行,随机分布,每处理设3个重复,常规管理。
西洋参完全出苗28 d后调查病株数,每次处理随机抽取5行进行调查(每行播种26粒种子),计算病株率(d)和防治效果(c),如式(2)~(3)。于2016-10-20—2016-11-10期间挖出参苗,统计1年生西洋参的单株参鲜重和总参鲜重,计算单株参增重率(wgs)和总参增重率(wga),如式(4)~(5)。
(2)
其中di为病株数,da为总调查株数。
(3)
其中d为处理组病株率,d0为对照组病株率。
(4)
其中ws为处理组单株参鲜重,ws0为对照组单株参鲜重。
(5)
其中wa为处理组总参鲜重,wa0为对照组总参鲜重。
1.5.2 蘸根处理
试验期为2016-11-07—2017-10-11,在1.5.1试验的基础上,挖取1年生参苗,蘸根后移栽。试验设5个处理:(Ⅰ)CK(清水对照);(Ⅱ)化学药剂对照,33.5 g/L精甲霜灵+25 g/L咯菌腈10 g兑水30 kg蘸根1 min;(Ⅲ)HB20111可湿性粉剂稀释为原浓度的1/50蘸根10 min;(Ⅳ)QT21979可湿性粉剂稀释为原浓度的1/50蘸根10 min;(Ⅴ)TW21990可湿性粉剂稀释为原浓度的1/50蘸根10 min。小区面积5 m2,每小区移栽数量一致的西洋参幼苗,设保护行,随机分布,每处理设3个重复,常规管理。
第2年移栽30~40 d后调查病株数,每次处理随机抽取5行进行调查(每行移栽16株幼苗),计算d和c。于2017-10-1—2017-10-11期间挖出参苗,统计2年生西洋参的单株参鲜重和总参鲜重,计算wgs和wga。计算公式同1.5.1。
1.6 木霉菌株鉴定
1.6.1 形态学观察
分别在SNA、PDA和CMD平板上培养木霉菌株,定期观察菌落形态及分生孢子梗、瓶梗的发育形态。
1.6.2 分子鉴定
利用Omega公司的Fungal DNA Mini Kit试剂盒提取木霉基因组DNA,用ITS(internal transcribed spacer)通用引物ITS1-F/ITS4进行PCR扩增,PCR产物交上海生工生物股份有限公司进行测序,结果分别提交NCBI(national center for biotechnology information)[18]和ISTH(international subcommission onThrichodermaandHypocrea)[19]网站进行比对分析。选取NCBI上与目标菌株同源性较高的ITS序列,利用MEGA 5.0中的Upgma构建系统发育进化树,自展数据集为1000次,分析其亲缘关系。
1.7 数据统计与分析
本文数据采用SPSS 21.0统计软件中的Duncan’s方法进行分析,结果为3次重复的平均值±标准差,以不同小写字母表示各处理间在0.05水平上存在显著性差异,以不同大写字母表示各处理间在0.01水平上存在极显著性差异。
2 结果与分析
2.1 木霉菌株对立枯丝核菌的抑制作用
供试木霉菌株在PDA平板上对R.solani均有一定的抑制作用,不同木霉菌株的抑制率不同。其中菌株HB20111的抑制效果最好,抑制率达99.33%,与其他菌株间存在极显著性差异(P<0.01),另外菌株QT21979和TW21990的抑制效果也达到了93.00%以上,效果稍低于HB20111,结果见图1。下文将利用这3株木霉制备可湿性粉剂,进行西洋参立枯病的小区防治效果评价。
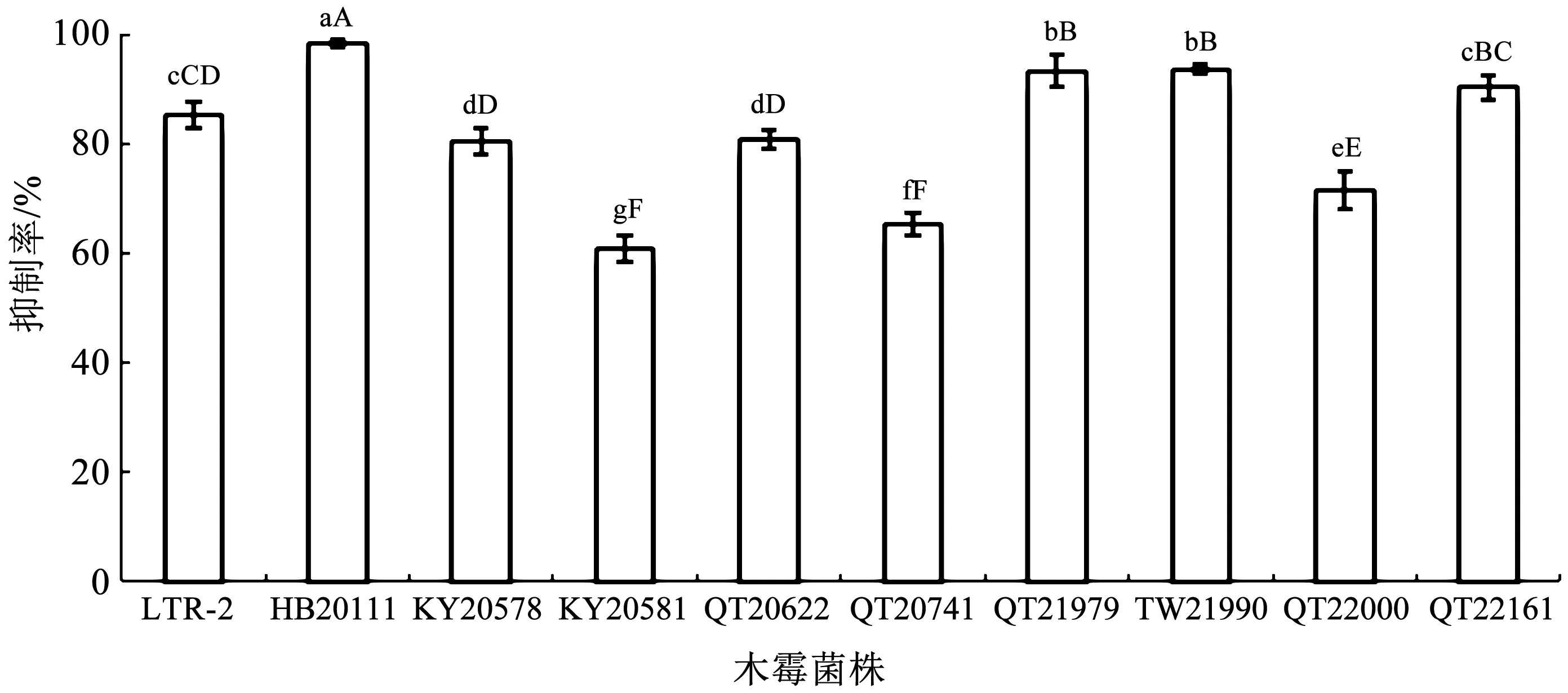
图1 木霉菌株在PDA平板上对立枯丝核菌的抑制作用Fig.1 Inhibition ratio of Trichoderma spp. strains against R. solani on a PDA plate
2.2 木霉可湿性粉剂对西洋参立枯病的小区防治效果
2.2.1 拌种处理
木霉可湿性粉剂拌种处理结果见表1。木霉处理和化学包衣处理对西洋参立枯病均有一定的防治效果,不同处理的病株率不同。3种木霉制剂处理的病株率与清水对照间均存在极显著性差异(P<0.01)。不同木霉处理与化学包衣间的差异不同,其中木霉QT21979效果比化学包衣差,木霉TW21990与化学包衣间无差异,木霉HB20111效果最好,与化学包衣处理间存在极显著性差异(P<0.01),拌种处理后防治效果达到了71.81%。

表1 木霉可湿性粉剂拌种处理对西洋参立枯病的小区防治效果
注:结果为3次重复的平均值±标准差
木霉可湿性粉剂对西洋参有促生长作用,3种木霉处理后的1年单株参鲜重与清水对照间均存在极显著性差异(P<0.01),其中HB20111和TW21990与化学包衣间也存在极显著性差异(P<0.01),单株参增重率分别达到了33.54%和24.63%。
3种木霉处理后的1年总参鲜重与清水对照间均存在极显著性差异(P<0.01),其中HB20111和TW21990与化学包衣处理间也存在极显著性差异(P<0.01),总参增重率分别达到了92.75%和68.97%。
2.2.2 蘸根处理对西洋参立枯病的小区防治效果
在2.2.1拌种处理的基础上,继续用木霉蘸根处理西洋参防治立枯病,结果见表2。各处理组的病株率与清水对照间存在极显著性差异(P<0.01),但木霉QT21979处理与化学包衣间无差异,木霉TW21990处理与化学包衣间存在显著性差异(P<0.05),木霉HB20111效果最好,与化学包衣间存在极显著性差异(P<0.01),蘸根处理后防治效果达到了91.04%。
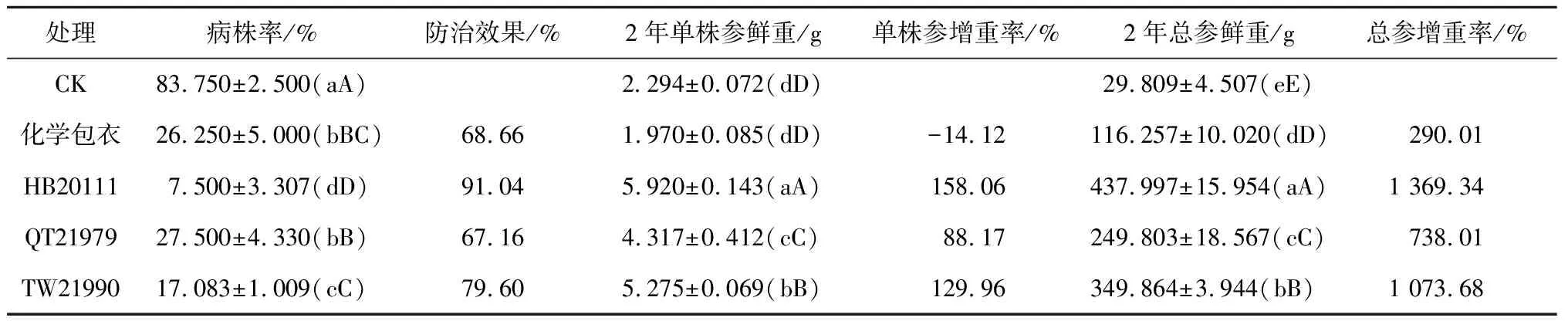
表2 木霉可湿性粉剂蘸根处理对西洋参立枯病的小区防治效果
注: 结果为3次重复的平均值±标准差
3种木霉处理后的2年单株参鲜重与清水对照及化学包衣间均存在极显著性差异(P<0.01),其中HB20111效果最好,单株参增重率达到了158.06%。
3种木霉处理后的2年总参鲜重与清水对照及化学包衣间均存在极显著性差异(P<0.01),其中HB20111效果最好,总参增重率达到了1 369.34%。
2.3 木霉菌株HB20111的抑菌谱
将上述效果最好的木霉菌株HB20111进行抑菌谱检测,结果见图2。HB20111在PDA平板上对供试8种西洋参病原真菌均有拮抗作用,对不同病原真菌的抑制率间存在极显著性差异(P<0.01),其中对R.solani、F.solani、B.cinerea、P.delaryanum、C.panacicola抑制效果最好,25℃对峙培养6 d的抑制率均达到了98.5%以上。
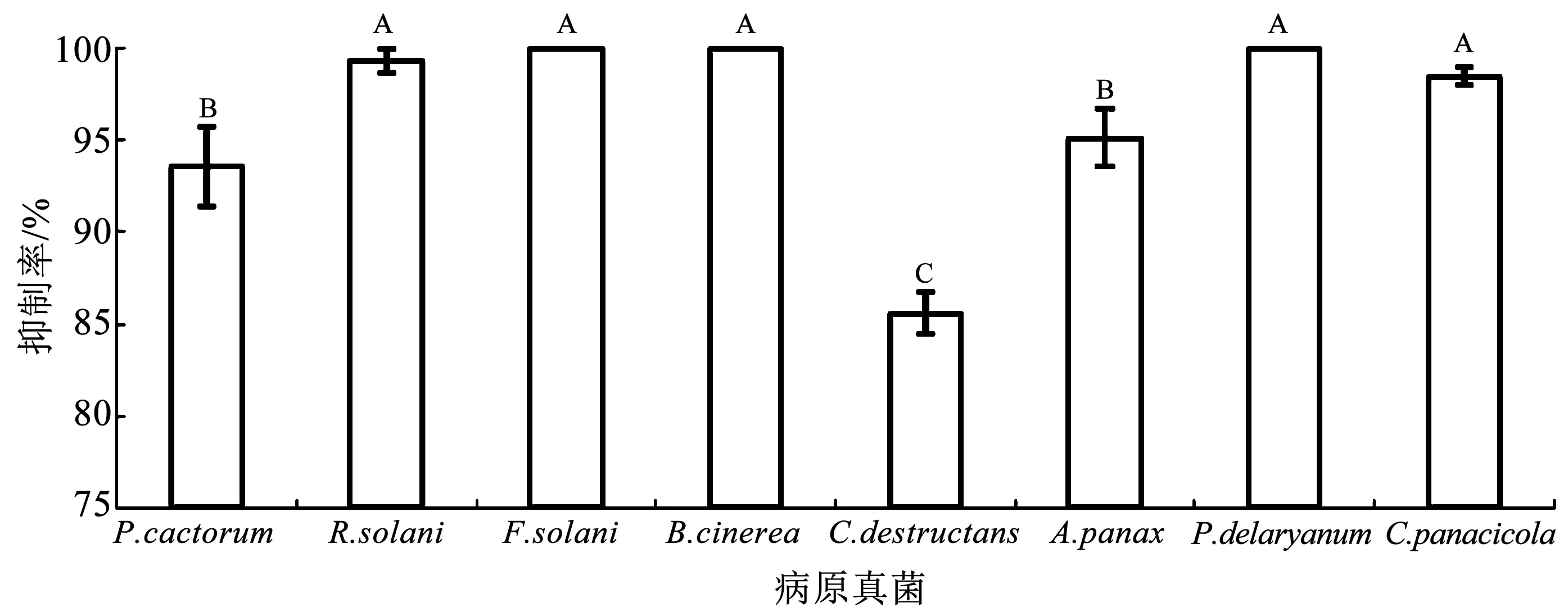
图2 木霉菌株HB20111的抑菌谱Fig.2 Antimicrobial spectrum of Trichoderma spp. strain HB20111
2.4 木霉菌株HB20111的种类鉴定
2.4.1 菌株形态学特征
对木霉菌株HB20111进行种类鉴定,该菌株采集自山东省滨州黄河湿地土壤,该地区经度117.964°E,纬度32.292°N,在中国微生物菌种保藏管理委员会普通微生物中心的保藏编号为CGMCC No. 16963。
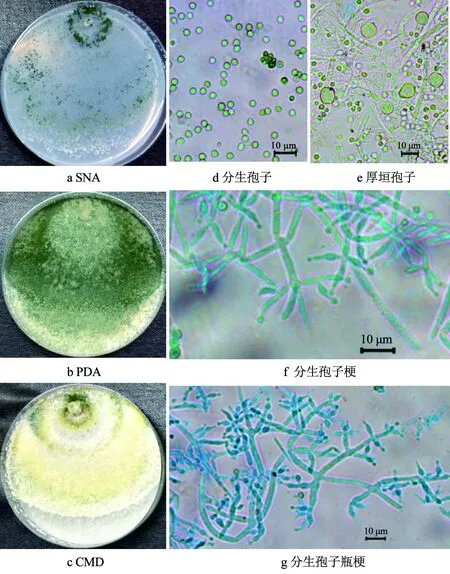
图3 木霉菌株HB20111的形态特征Fig. 3 Morphological characteristics of Trichoderma spp. strain HB20111
木霉菌株HB20111的形态特征见图3,其中,图3a~c为在不同培养基上25 ℃培养7 d的菌落特征。菌株HB20111在SNA培养基上20、25、30、35 ℃培养72 h,菌落半径分别为15.0~17.0 mm、26.0~28.5 mm、30.0~32.0 mm、2.5~4.0 mm,高于40 ℃不生长,最适生长温度为25~30 ℃。在SNA培养基上25 ℃培养7 d,菌落表面气生菌丝疏松,分生孢子绿色,产生锯齿状同心轮纹,边缘有绿色产孢簇,基质中无水溶性色素分布,菌落反面无色。
在PDA培养基上20、25、30、35 ℃培养72 h,菌落半径分别为43.0~44.5 mm、56.5~58.5 mm、40.0~42.0 mm、2.0~3.5 mm,高于40 ℃不生长,最适生长温度为25~30 ℃。在PDA培养基上25 ℃培养7 d,菌落表面呈丝绒状,边界清晰,中央有一菌丝相对致密的圆盘状结构,是分生孢子的主要产生区域,分生孢子绿色浓密,菌落反面白色,有椰香味气体产生。
在CMD培养基上25 ℃培养7 d,菌落表面呈粉尘颗粒状,菌丝疏松、有两圈绿色同心轮纹,菌落边缘分布直径为2.0~3.0 mm的产孢簇,分生孢子绿色,菌落反面白色,基质中无水溶性色素产生,有椰子气味。
分生孢子梗分枝特征与深绿木霉(T.atroviride)一致[20],为典型的单侧分枝,分枝角度近似90°,但也常见成对着生分枝。瓶梗长度(4.2~)6.0~9.7(~15.0) μm,长宽比例(1.1~)1.8~3.5(~6.3),基部宽度为(1.2~)1.7~2.5(~3.5) μm,无间生瓶梗。
分生孢子绿色,亚球型或卵圆形,表面光滑,(2.3~)2.8~3.5(~4.0) μm,长宽比例为(0.8~)1.0~1.3(~1.6)。
在CMD培养基上25 ℃培养7 d可产生大量的厚垣孢子,球形至亚球形,端生或间生,直径为(5.0~)8.5~7.5(~11.0) μm。
2.4.2 菌株序列分析
菌株HB20111的ITS序列为608 bp,在GenBank上的登录号为EU272523.1,经http:∥www.isth.info中的TrichOKEY进行比对,分别在73、94、241、399、503处发现了木霉的5个DNA寡核苷酸条形编码,种类鉴定结果表明菌株HB20111为深绿木霉(T.atroviride)。
将ITS序列提交NCBI进行比对,菌株HB20111与T.atroviride菌株ACCC32886 [MF871543.1]同源性最高,为100.0%。选取NCBI中与菌株HB20111的ITS同源性较高的序列构建系统发育进化树,结果见图4。进化树中HB20111与T.atroviride位于同一分枝,同源性最高,故HB20111应为T.atroviride。

图4 基于ITS序列构建的系统发育进化树Fig.4 Phylogenetic tree based on ITS sequences
3 讨论
本试验中清水对照西洋参病株率较高,第1年病株率为38.20%、第2年病株率为83.75%,第2年清水对照病株率升高可能与立枯病情加重有关。3种供试木霉制剂在西洋参立枯病的小区防治结果表明,菌株不同,效果差异显著。其中菌株QT21979对西洋参立枯病的防治效果比化学药剂差,菌株TW21990对西洋参立枯病的防治效果与化学药剂无极显著性差异(P≥0.01),菌株HB20111效果最好;第1年拌种处理对西洋参立枯病的防治效果、单株参增重率及总参增重率分别为71.81%、33.54%和92.75%;第2年蘸根处理对西洋参立枯病的防治效果、单株参增重率及总参增重率分别为91.04%、158.06%和1369.34%。由于在第1年的基础上继续施用木霉,故第2年效果更显著。主要原因是木霉处理后大大降低了西洋参的病株率,单位面积总参增重率更加明显,且木霉可产生植物生长素,促进参苗生长[21],故对单株参鲜重也有明显的增产作用,其机理有待进一步研究。
2年蘸根处理后,化学包衣处理较清水对照,虽降低了病株率,但单株参鲜重较清水对照有所降低,推测原因可能是试验过程中用化学药剂蘸根1 min,处理时间较长(可能处理时间10~20 s较合适),对根造成了伤害,故处理后参苗生长缓慢。
本试验筛选得到的木霉菌株HB20111,经形态学和分子序列鉴定,结果均为深绿木霉(T.atroviride),该菌株生长速度快,产孢能力强,抑菌谱结果表明对西洋参多种真菌病害均有较高的抑制效果。另外,菌株HB20111在西洋参上效果较好,也可能与西洋参生长的土壤湿度、温度与木霉生长条件一致,木霉可以在根际及土壤中有效定殖,抑制病菌生长及侵染植物。
试验结果表明,HB20111能够替代化学杀菌剂应用于西洋参生产,具有潜在应用价值。下一步将进行杀虫剂替代技术和土壤绿色消毒技术研究,构建西洋参全程绿色防控和种植技术,为乡村振兴提供高效、绿色、环保、可持续的技术和产品。

