HER2阳性早期乳腺癌患者的预后分析
欧开萍,罗扬,吕剑虹,桑蝶,刘维丽,张金涛,周华,蔡有菊
1北京市朝阳区三环肿瘤医院内科,北京100122
2国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院内科,北京100021
约20%的乳腺癌存在人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)基因的扩增或过表达,HER2阳性早期乳腺癌患者术后易发生复发和转移,生存期较短[1]。曲妥珠单抗是一种重组脱氧核糖核酸(deoxyribonucleic acid,DNA)衍生的人源化克单隆抗体,可选择性地作用于HER2的胞外域,不但可以抑制HER2阳性肿瘤细胞内酪氨酸激酶的活性,从而抑制HER2阳性肿瘤细胞的增殖和存活,还能够介导抗体依赖的细胞介导的细胞毒作用[2]。多项大型研究结果显示,HER2阳性早期乳腺癌患者术后接受曲妥珠单抗治疗能够使复发风险降低23%~40%,死亡风险降低24%~37%[3-5]。尽管曲妥珠单抗显著改善了HER2阳性早期乳腺癌患者的预后,但仍有部分患者不可避免地出现了复发和转移。随着拉帕替尼、帕妥珠单抗、来那替尼等抗HER2药物的广泛应用,联合靶向治疗(如曲妥珠单抗联合帕妥珠单抗)在提高治疗效果的同时也增加了治疗费用和不良反应[6],因此,探索HER2阳性早期乳腺癌患者预后不良的影响因素对于高危复发风险患者的筛查和诊断具有重要的意义。本研究对121例接受曲妥珠单抗辅助治疗1年的HER2阳性早期乳腺癌患者的临床特征与HER2阳性早期乳腺癌发生复发和转移的关系进行了分析,并进行预后指数评分,探讨了HER2阳性早期乳腺癌患者预后的影响因素,现报道如下。
1 资料与方法
1.1 一般资料
收集2012年1月至2016年5月于中国医学科学院肿瘤医院借床病房(北京市朝阳区三环肿瘤医院)收治的HER2阳性早期乳腺癌患者的临床资料。纳入标准:①经中国医学科学院肿瘤医院的病理科医师诊断,HER2阳性定义为免疫组织化学染色结果显示HER2(+++)或荧光原位杂交证实存在HER2基因扩增;②患者均为女性;③接受了1年的曲妥珠单抗靶向治疗。排除标准:①合并第二原发肿瘤;②合并严重的心、肝、肾功能不全;③术前影像学检查结果提示存在远处可疑转移;④临床资料不完整。根据纳入和排除标准,本研究共纳入121例HER2阳性早期乳腺癌患者,患者的年龄为24~65岁,中位年龄为48岁;病理类型均为非特殊型浸润性癌;38例患者接受了前哨淋巴结活检,前哨淋巴结活检个数为1~10个(中位数为4个);83例患者行改良根治术,腋窝淋巴结清扫个数为5~81个(中位数为23个);参照第7版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)乳腺癌分期标准[7]进行分期:Ⅰ期33例,Ⅱ期37例(ⅡA期25例,ⅡB期12例),Ⅲ期51例(ⅢA期15例,ⅢB期20例,ⅢC期16例)。
1.2 治疗方法
所有患者均接受了手术治疗,其中,25例患者接受了保乳术联合前哨淋巴结活检术,13例患者接受了单纯切除术联合前哨淋巴结活检术,83例患者接受了改良根治术。121例HER2阳性早期乳腺癌患者中,76例患者接受了术后放疗,包括15例行保乳术患者、10例保乳术合并腋窝淋巴结转移患者、1例肿瘤分期为T3期患者、2例改良根治术后肿瘤分期为T3期同时合并腋窝淋巴结转移数目≥4个的患者、22例腋窝淋巴结转移数目≥4个的患者,26例腋窝淋巴结转移数目为1~3个同时合并其他不良因素(如脉管瘤栓、神经侵犯)的患者。121例HER2阳性早期乳腺癌患者均接受了术后辅助化疗和术后辅助曲妥珠单抗治疗,治疗时间为1年;其中,107例患者接受了术后辅助化疗同期曲妥珠单抗治疗(化疗方案:60例患者接受了环磷酰胺联合表柔比星序贯紫杉醇治疗,45例患者接受了多西他赛联合卡铂治疗,2例患者接受了紫杉醇单药治疗),14例患者接受了术后辅助化疗序贯曲妥珠单抗治疗(化疗方案:9例患者接受了表柔比星联合紫杉醇治疗,4例患者接受了多西他赛联合环磷酰胺联合表柔比星治疗,1例患者接受了环磷酰胺联合表柔比星治疗)。66例雌激素受体(estrogen receptor,ER)和(或)孕激素受体(progesterone receptor,PR)阳性的HER2阳性早期乳腺癌患者接受了辅助内分泌治疗(包括21例患者接受他莫昔芬治疗,13例患者接受卵巢功能抑制治疗联合他莫昔芬治疗,17例患者接受卵巢功能抑制治疗联合芳香化酶抑制剂治疗,15例患者接受芳香化酶抑制剂治疗)。
1.3 随访
通过门诊、住院复查及电话的方式对全部患者进行了随访,随访内容包括患者的局部复发、远处转移和死亡情况。末次随访时间为2018年9月1日,中位随访时间为51个月(10~66个月)。无病生存(disease-free survival,DFS)时间定义为自乳腺原发性肿瘤手术日期起至首次出现疾病复发或转移的时间。无远处转移生存(distant disease-free survival,DDFS)时间定义为自乳腺原发性肿瘤手术日期起至首次出现远处转移(不包括局部复发)的时间。
1.4 统计学方法
采用SPSS 19.0软件对数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验。采用Cox比例风险回归模型进行多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 复发、转移及生存情况
121例HER2阳性早期乳腺癌患者中无失访病例,通过随访发现,共有2例患者出现局部复发,22例患者发生远处转移,其中,12例发生转移的患者在随访过程中死亡。首发远处转移的部位为骨转移(7例)、肝转移(6例)、淋巴结转移(5例)和肺转移(4例)。121例HER2阳性早期乳腺癌患者的DFS率、DDFS率分别为80.2%(97/121)、81.8%(99/121)。
2.2 HER 2阳性早期乳腺癌患者预后影响因素的单因素分析
单因素分析结果显示,年龄≤35岁、组织学分级为Ⅲ级、肿瘤最大径>2 cm、腋窝淋巴结转移阳性的HER2阳性早期乳腺癌患者的DFS率均低于年龄>35岁、组织学分级为Ⅰ~Ⅱ级、肿瘤最大径≤2 cm、腋窝淋巴结转移阴性的患者,差异均有统计学意义(χ2=14.619、4.006、4.408、6.829,P<0.05);不同神经侵犯情况、脉管瘤栓情况、ER/PR状态、Ki-67阳性细胞比例的HER2阳性早期乳腺癌患者的DFS率比较,差异均无统计学意义(P>0.05)。单因素分析结果显示,年龄≤35岁、腋窝淋巴结转移阳性的HER2阳性早期乳腺癌患者的DDFS率均低于年龄>35岁、腋窝淋巴结转移阴性的患者,差异均有统计学意义(χ2=11.428、4.952,P<0.05);不同神经侵犯情况、脉管瘤栓情况、组织学分级、ER/PR状态、Ki-67阳性细胞比例、肿瘤最大径的HER2阳性早期乳腺癌患者的DDFS率比较,差异均无统计学意义(P>0.05)。(表1)
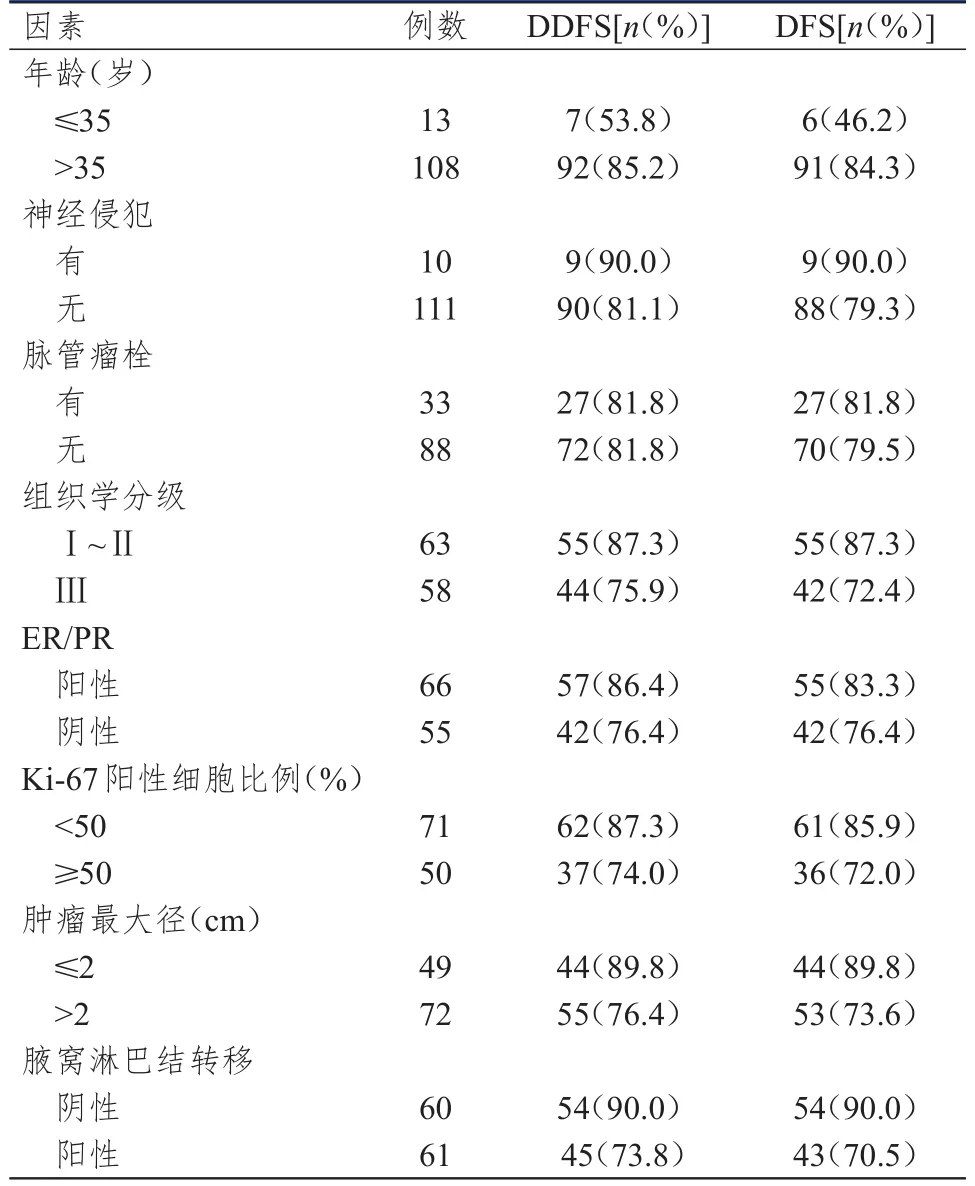
表1 121例HER 2阳性早期乳腺癌患者预后影响因素的单因素分析
2.3 HER 2阳性早期乳腺癌患者预后影响因素的多因素分析
将单因素分析中差异有统计学意义的变量(年龄、组织学分级、肿瘤最大径和腋窝淋巴结转移情况)纳入Cox比例风险回归模型中进行多因素分析,结果显示,年龄≤35岁和组织学分级为Ⅲ级是HER2阳性早期乳腺癌患者DFS率低的独立危险因素(P<0.05)。(表2)

表2 121例HER 2阳性早期乳腺癌患者DFS影响因素的多因素分析
2.4 不同复发风险HER 2阳性早期乳腺癌患者的DFS情况
根据单因素分析结果,将存在不良因素(年龄≤35岁、组织学分级为Ⅲ级、肿瘤最大径>2 cm、腋窝淋巴结转移阳性)的HER2阳性早期乳腺癌患者均定义为1分,将年龄>35岁、组织学分级为Ⅰ~Ⅱ级、肿瘤最大径≤2 cm、腋窝淋巴结转移阴性的HER2阳性早期乳腺癌患者定义为0分,对每例患者按照其存在的不良因素数量分别进行复发风险评分,并进行进一步的分组:0~1分为低风险组(n=46),2分为中风险组(n=45),3~4分为高风险组(n=30),低风险组、中风险组和高风险组分别有3例、7例和14例患者出现了复发或转移。随访期间,低风险组、中风险组和高风险组患者的DFS率分别为93.5%、84.4%和53.3%,组间比较,差异有统计学意义(χ2=20.223,P<0.01)(图1)。
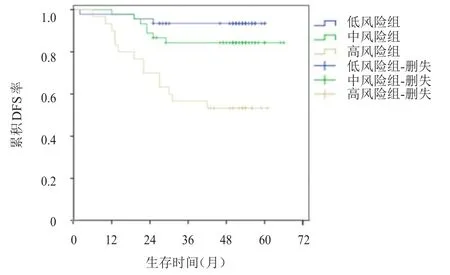
图1 低风险组(n=46)、中风险组(n=45)和高风险组(n=30)HER 2阳性早期乳腺癌患者的DFS曲线
3 讨论
HER2阳性早期乳腺癌患者术后容易出现复发和转移,恶性程度较其他乳腺癌高,患者预后较差。有研究报道,即使是腋窝淋巴结转移阴性、肿瘤直径≤2 cm的HER2阳性早期乳腺癌,其发生远处转移的风险仍可达到20%~30%[8]。曲妥珠单抗能够改善此部分患者的预后。2008年12月31日,曲妥珠单抗被国家食品药品监督管理局(the State Food and Drug Administration,SFDA)批准用于HER2阳性早期乳腺癌的辅助治疗。
《2015年St Gallen早期乳腺癌国际专家共识》指出,除了术后腋窝淋巴结转移阴性且肿瘤最大径<0.5 cm(T1a)的早期乳腺癌合并激素受体阴性等高危因素患者是否需要进行抗HER2治疗仍存在争议外,其他的HER2阳性早期乳腺癌患者均可从抗HER2治疗中获益[2]。NSABP B-31和NCCTG N9831试验联合分析的结果显示,接受化疗联合曲妥珠单抗辅助治疗的患者,其10年DFS率和总生存(overall survival,OS)率分别为73.7%和84.0%,即接受了化疗联合1年的曲妥珠单抗治疗后,仍有部分患者不可避免地出现复发和转移[3]。APHINITY研究结果显示,在曲妥珠单抗的基础上联合帕妥珠单抗可以进一步降低高危患者(腋窝淋巴结转移阳性或激素受体阴性)的复发、转移风险[9]。虽然患者对曲妥珠单抗的耐受性良好,却增加了患者发生充血性心力衰竭的风险。研究显示,接受了1年的曲妥珠单抗辅助治疗后,约2.5%的HER2阳性早期乳腺癌患者发生了严重充血性心力衰竭,而仅有0.4%的接受6个月曲妥珠单抗辅助治疗的HER2阳性早期乳腺癌患者发生了严重充血性心力衰竭(相对风险比为5.11)[10]。鉴于曲妥珠单抗具有心脏毒性,陆续有研究探索了缩短曲妥珠单抗疗程的可行性,但均未证实缩短曲妥珠单抗疗程的非劣效性[11-13],然而对于腋窝淋巴结转移阴性的低危HER2阳性早期乳腺癌患者,通过减少化疗药物的使用以减少不良反应的发生的可行性已经得到了认可[14]。因此,深入分析接受曲妥珠单抗治疗的HER2阳性早期乳腺癌患者预后的影响因素,根据患者复发、转移风险的高低决定个体化的化疗靶向治疗方案是未来研究的方向。目前尚缺乏单独针对HER2阳性早期乳腺癌患者,尤其是针对曲妥珠单抗治疗后的HER2阳性早期乳腺癌患者的预后情况进行分析的报道。
本研究回顾性分析了接受了1年曲妥珠单抗治疗的HER2阳性早期乳腺癌患者的临床特征与患者DFS的关系。本研究结果证实了年龄≤35岁和组织学分级为Ⅲ级均是HER2阳性早期乳腺癌患者DFS率低的独立危险因素(P<0.05)。有研究认为,年龄是影响乳腺癌患者预后的因素,其原因为年轻乳腺癌患者中浸润性乳腺癌、组织学分级为Ⅲ级、发生淋巴结转移、雌激素受体阴性的比例均高于中老年乳腺癌患者[15]。本研究结果显示,ER/PR受体状态可能与HER2阳性早期乳腺癌患者的DFS无关,虽然ER/PR受体阴性患者的DFS率为76.4%,低于ER/PR受体阳性患者的83.3%,但差异无统计学意义,原因可能为ER/PR受体阴性的HER2阳性早期乳腺癌患者可以从曲妥珠单抗联合化疗的治疗中获益,从而削弱了受体状态对预后的影响,也可能是因为本研究的样本量较小,尚不足以区分受体状态所造成的差异,与既往研究结果不同[9-10,16]。本研究中,肿瘤直径≤2 cm和腋窝淋巴结转移阴性的HER2阳性早期乳腺癌患者的DFS率分别为89.8%和90.0%,高于肿瘤直径>2 cm和腋窝淋巴结转移阳性的患者(P<0.05),与既往研究结果相似[8,17]。APT研究的入组条件为淋巴结阴性且肿瘤直径<3 cm的HER2阳性乳腺癌患者,患者均接受了12周紫杉醇单药和41周的曲妥珠单抗治疗。406例HER2阳性乳腺癌患者的7年DFS率为93.3%,此研究的结果除了证实在低危HER2阳性乳腺癌患者中减少化疗药物使用的可行性外,也说明了综合肿块大小和腋窝淋巴结转移状况能够更好地区分出低危的HER2阳性患者[14]。只有综合各种预后不良因素,才能更好地对患者进行预后分层,因此,本研究对全部患者的复发风险进行了评分,并根据评分的不同分为低风险组、中风险组和高风险组,低风险组、中风险组和高风险组分别有3例、7例和14例患者出现了复发或转移。随访期间,低风险组、中风险组和高风险组患者的DFS率分别为93.5%、84.4%和53.3%,3组比较,差异有统计学意义(P<0.01),这对临床上评价HER2阳性早期乳腺癌的预后具有一定的辅助作用,对于肿瘤直径小、腋窝淋巴结转移阴性、组织学分级低的HER2阳性早期乳腺癌患者能否减少辅助化疗的强度,尤其是减少蒽环类药物的使用,具有提示作用,可避免心脏毒性的发生,而曲妥珠单抗靶向治疗对于高危年轻HER2阳性早期乳腺癌患者是否足够,是否应联合应用帕妥珠单抗或拉帕替尼、来那替尼等进行双靶向治疗以期进一步降低复发转移风险,值得临床进一步研究。
早期乳腺癌的治疗目标是治愈,尽管曲妥珠单抗已极大改善了HER2阳性早期乳腺癌患者的预后,但仍有部分HER2阳性早期乳腺癌患者会发生复发或转移,尤其是对于存在多种影响因素的高复发风险患者的预后仍有待改善。对于预后影响因素的探讨及分层仍需要进行大规模的前瞻性随机对照研究加以证实,从而更好地帮助临床甄别可以仅接受短疗程曲妥珠单抗治疗或需要联合帕妥珠单抗等双靶向治疗的患者,给患者带来更多的获益,避免治疗过度或治疗不足,减轻患者的经济负担。

