小肠细菌过度生长与慢性胰腺炎关系的研究进展
冯 新,李晓晴,姜 政
冯新,李晓晴,姜政,重庆医科大学附属第一医院消化内科 重庆市400016
核心提要:小肠细菌过度生长(small intestinal bacterial overgrowth,SIBO)与慢性胰腺炎(chronic pancreatitis,CP)关系密切,SIBO既是CP的重要临床表现,又是影响CP患者临床症状的原因之一,已有研究发现针对SIBO的抗菌治疗可改善CP患者肠道症状.本文从多个方面阐述两者间的相关性,以期为CP患者的治疗提供新的思路.
0 引言
慢性胰腺炎(chronic pancreatitis,CP)是指由遗传和环境等因素引起胰腺组织结构和功能持续性损害,胰腺实质弥漫性的发生慢性进行性炎症,导致胰腺组织和(或)胰腺功能不可逆的损害[1].随着疾病的进展,可出现不同程度的胰腺萎缩和纤维化、胰管扭曲、狭窄和扩张、胰腺实质钙化、假性囊肿、内外分泌功能不全、门静脉及脾静脉血栓形成等.临床表现为反复腹痛、脂肪泻、消瘦、营养不良、血糖升高甚至黄疸等.在全球范围内,CP的发病率为9.62/10万,死亡率为0.09/10万,其中以男性为主,其数量约为女性的2倍[2].
小肠细菌过度生长(small intestinal bacterial overgrowth,SIBO)是指小肠内细菌总量增加、菌群发生改变、优势菌转化并引起消化吸收障碍等病理生理异常的综合征,主要表现为腹胀、腹痛、腹泻等[3],严重者可有贫血、营养不良、维生素和铁缺乏等全身症状.SIBO与CP症状相似,两者间可能存在某些内在联系,本文就近年来关于两者间相关性的研究做一系统阐述,以期对CP的诊疗提供新的思路.
1 SIBO的诊断技术及诊断标准
1.1 小肠抽吸液培养 一直以来,小肠抽吸液培养被认为是诊断SIBO的金标准,近端小肠液菌落数≥105CFU/mL,可诊断为SIBO[4,5],近年来也有人提议将SIBO的诊断阈值降低为103CFU/mL[6].但该方法成本高、耗时长、具有侵入性、可重复性低,且存在诸多限制,如易受口腔细菌污染而造成假阳性,难以检测到远端小肠细菌而易造成假阴性,专性厌氧菌难以培养等[4,7],使其在临床中难以得到广泛的开展与应用.
1.2 呼气试验 健康成人肠道中平均有100 mL气体,其中H2和CH4仅通过肠道微生物发酵碳水化合物产生,产生的气体通过肠壁被吸收,随着血液流经肺部,随呼吸排出体外并被气相色谱仪测量[6],这就是呼气试验的原理.最新北美专家共识[6]认为,在服用10 g乳果糖或75 g葡萄糖后的90 min内,H2水平较基础值上升≥20 ppm或者CH4水平较基础值上升≥10 ppm,并排除碳水化合物吸收不良之后,可诊断为SIBO.相比于小肠抽吸液培养,呼气试验具有简单、廉价、无创及可重复性的特点,更容易受到病人的接受.但有研究[8,9]发现呼气试验的准确性会受到小肠运输时间的影响,部分患者在H2高峰来临前底物已到达盲肠,H2水平的升高可能是未被吸收的底物在结肠中被发酵所致的假阳性结果,因此建议联合呼气试验和核素闪烁扫描来检测SIBO.
1.3 胶囊技术 近年来,已有研究[10]将胶囊技术用于SIBO的诊断.气体传感胶囊在被吞入后,可随肠道蠕动实时测量肠腔内气体的浓度及温度,并将数据传输至接收器.相比于呼气试验间接测量气体浓度,气体传感胶囊能够在肠道中对气体进行直接测量,减少了生理干预,提高了检测灵敏度.目前其有效性及安全性已在临床试验中得到验证,有望在未来的临床工作中得到推广.
2 SIBO在CP中的流行情况
SIBO与CP关系密切,相关研究[11-20]已表明SIBO在CP中的患病率为14%-92%.Lee等[20]的研究除外了有胃肠道手术史的患者,纳入了98例CP患者,其结果表明CP患者SIBO发病率较高,达40.8%.Ní Chonchubhair等[19]在德国进行的一项研究中纳入了35例CP患者及31例健康对照组,观察到SIBO在CP患者中发病率为14.3%,而健康对照组为0%.同时,Therrien等[18]在相似研究中入选了31例CP患者和40例对照组,发现CP患者SIBO发病率为38.7%,显著高于对照组2.5%,也证实了SIBO在CP中有着较高的发病率.另外,Capurso等[21]对2015-08前的9项相关研究进行了荟萃分析,发现在336名CP患者中,SIBO患病率为36%,并对其中6项病例对照研究进行分析,显示CP患者和对照组的SIBO阳性比为4:1.尽管目前关于CP与SIBO关系的研究多为小规模研究,诊断标准及入选人群没有统一,且这些研究中CP患者的SIBO发生率不尽相同,然而多项研究结果均证实SIBO在CP患者中有较高的发病率,提示CP可能会导致SIBO(表1).
3 CP与SIBO之间的相互影响
3.1 CP导致SIBO的可能机制 CP导致SIBO的具体机制尚不完全明确,目前认为可能的机制有以下几点.
3.1.1 肠道运动障碍:通常来讲,肠道的蠕动会减少腔内细菌生长,而对于CP患者,有许多原因会减缓小肠运动从而导致SIBO.有研究表明[22],胰腺炎症可能会通过全身炎症反应而延长小肠移行性运动复合波,减少肠道的收缩与推进,诱发小肠内细菌过度生长和移位.糖尿病是CP病人的常见并发症,糖尿病神经病变会减慢小肠蠕动,有利于SIBO的发生.此外,CP病人阿片类止痛药的使用、外科手术均会影响小肠蠕动,易使细菌在肠道内定植.最后,CP患者胰腺腺泡细胞大量破坏,胰酶分泌不足易导致营养吸收不良,未被消化的营养物质(如脂肪、碳水化合物和蛋白质)进入回肠后将抑制胃排空及十二指肠-空肠蠕动,这种回肠制动效应[23]在SIBO的形成中也起着一定作用.
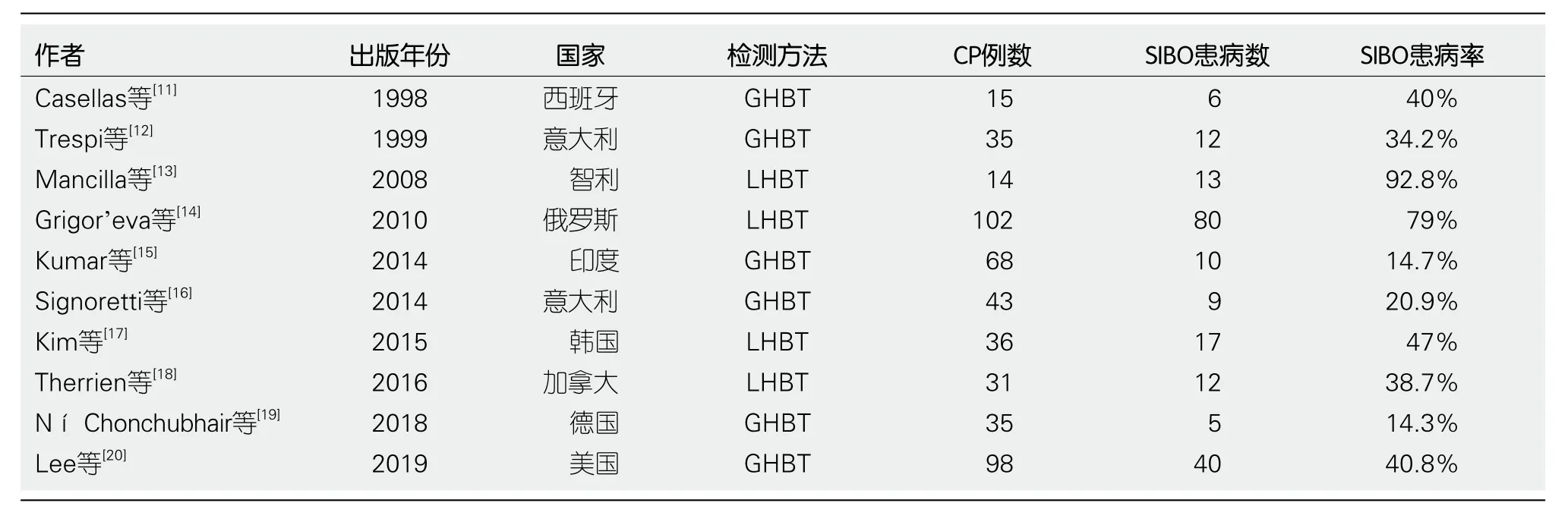
表1 SIBO在CP中流行情况的研究汇总
3.1.2 抗菌机制受损:人体内正常胃液酸碱度为1-2,足以杀灭胃内大部分细菌,是胃肠道内重要的抗菌物质.有指南建议[24,25],质子泵抑制剂(proton pump inhibitors,PPI)可作为CP患者胰酶治疗效果不佳时的辅助用药,但抑酸剂的长期应用会导致胃酸缺乏,破坏胃内酸性环境,增加细菌定植机会而使宿主更容易受到肠道感染.此外,正常胰液同样具有抗菌作用,CP患者因胰腺外分泌功能不全,其分泌的胰液抗菌活性受损,同样易使大量细菌在肠道定植[26].
3.1.3 饮酒:CP患者常有大量饮酒史,而饮酒可能与SIBO存在联系.酒精通过降低绒毛膜酶水平、破坏肠绒毛上皮细胞、使黏膜纤维化以及对黏膜上皮的直接毒性作用等改变小肠防御机制[27],利于细菌定植.酒精也可能影响黏膜免疫功能,减弱小肠的抗菌能力[28].此外,慢性酗酒者的口-盲肠转运时间延长,这可能是酒精对肠道平滑肌的直接毒性损伤所致,也可能与酒精干扰小肠收缩蛋白合成有关.酒精还可以作为某些革兰氏阴性菌的直接底物,为其生长提供营养,这也有利于细菌的过度繁殖.
3.1.4 宿主免疫功能的改变:有研究表明,免疫功能改变者,无论是抗体反应异常还是T细胞反应异常,都容易诱发细菌过度生长.人防御素-5(human defensin-5,HD-5)是人体小肠分泌的主要抗菌肽之一,其在小肠Paneth细胞颗粒内作为一种前肽而被合成和储存,并受胆碱能试剂或细菌抗原的刺激而分泌.肠腔中胰蛋白酶的激活会促使HD-5向活性形式转化,而活化的HD-5具有强大的杀菌作用[29].CP患者胰蛋白酶分泌不足,其介导的肠道抗菌素前肽向活性形式转化减少,将削弱肠道的抗菌能力.
3.2 SIBO对CP的影响
3.2.1 SIBO对CP症状的影响:CP与SIBO的胃肠道症状相似,近年研究发现CP患者的肠道症状可能与SIBO有关.SIBO可通过分解胆盐来造成肠内脂肪消化和吸收不良,并引起一定程度的继发性肠炎[30],导致患者出现许多胃肠道症状.而长期以来,各项研究关于SIBO对CP患者症状的影响结论不一,如Trespi等[12]的研究发现,在CP患者中,SIBO患者较非SIBO患者更容易引起腹泻.Grigor’eva等[14]在其研究中也表示伴有SIBO的CP患者在腹痛、腹泻、腹胀、恶性等症状方面更加明显.Kim等[17]报道了CP患者中,SIBO阳性组的便秘、腹胀等肠道症状评分显著高于SIBO阴性组,表明SIBO可能与CP患者肠道症状相关.但也有学者持反对意见,Lee等[20]在其研究中发现,CP患者消化道症状与SIBO并无多大关联,消化道症状不能预测SIBO.Ní Chonchubhair等[19]也在研究中得出,合并SIBO的CP患者除体重减轻之外,其余肠道症状与非SIBO患者相比无明显差异.既往研究所得出的结果不一致,其中一个原因可能是在治疗过程中抗生素的使用改善了胃肠道症状,此外,诊断方法和诊断标准的不统一也会导致结果的差异.因此,期待将来有更多高质量的研究来探索SIBO与CP患者症状之间的关系.
3.2.2 SIBO对小肠运动的影响:尽管小肠运动障碍是SIBO发生的重要因素之一,但SIBO本身也可能是导致肠道蠕动减慢的原因,并可能通过延长小肠运输时间(small bowel transit time,SBTT)来加重CP患者的肠道症状.Roland[31]等对接受了无线运动胶囊和乳果糖呼气试验(lactulose bremh test,LBT)检查的37名患者进行分析,结果表明LBT阳性患者的SBTT为6.6 h,而LBT阴性患者SBTT为4.2 h,有47.6%的LBT阳性患者显示出SBTT延长(≥6 h),而LBT阴性患者中仅有7.7%,表明SIBO可能会减缓小肠运动.而Suri等[32]在其研究中进一步将LBT阳性组分为产H2型SIBO(H-SIBO)和产CH4型SIBO(MSIBO),发现与H-SIBO相比,M-SIBO在小肠及结肠运输时间上有显著的延迟,提示CH4水平高的SIBO患者肠道运动迟缓更加明显.同样地,Kim等[17]在其研究中也观察到,在LBT阳性亚组中,H2、CH4混合组在腹胀、便秘等症状评分上明显高于H2组,这可能也与CH4会导致肠道蠕动减慢有关.关于CH4影响肠道运动的机制尚不明确,其中一种解释[33]是CH4会触发非推进性肠道收缩,并且当CH4进入远端小肠后会激活抑制近端小肠蠕动的反馈回路,导致小肠运输时间延迟.此外,LBT中CH4水平高的患者,其血清5-羟色胺水平较低也可能是其机制之一[34].关于SIBO导致小肠运输时间延迟的具体机制还需进一步研究,以便对SIBO的发病机制有更深入的了解并提供更具有针对性的治疗方案.
3.2.3 SIBO对CP营养状况的影响:CP患者由于胰酶分泌不足、过量酒精摄入及慢性腹痛等因素,常有营养不良的表现,国外一项荟萃分析[35]已表示CP患者普遍存在维生素D不足的情况.细菌过度生长可导致碳水化合物、蛋白质和维生素消耗增加,可能会进一步恶化CP患者营养状况.Lee等[20]在研究中表明CP患者的SIBO与低白蛋白血症、低锌水平相关,提示SIBO可能会影响CP患者的营养状况.同样地,Signoretti等[16]也在其研究中观察到,患有SIBO的CP患者较不伴SIBO的患者维生素D水平较低,这可能是与胰酶分泌不足及胆盐分解造成脂肪吸收不良和脂溶性维生素缺乏有关.且脂溶性维生素对于骨代谢非常重要,有研究报道[36]CP患者中相关代谢性骨病(如骨质减少、骨质疏松等)发病率较高,这可能也与SIBO引起维生素缺乏有关.
3.2.4 SIBO的治疗可改善CP患者肠道症状:CP与SIBO具有相似的消化道症状,已有研究发现,对合并SIBO的难治性CP患者进行抗生素治疗后其肠道症状将得到改善.Ní Chonchubhair等[19]在其研究中对SIBO阳性的CP患者进行了利福昔明治疗,随访结果显示所有患者的腹胀、腹痛、腹泻、便秘等肠道症状得到明显改善,这提示对于合并SIBO的CP患者,针对SIBO治疗可能改善相关症状.Kumar等[15]的一项研究发现在进行胰酶替代治疗后仍有10名CP患者有持续性腹泻,其中3名被诊断为SIBO,对这3名患者进行抗菌治疗后,有2名患者腹泻得以改善.这也证明了SIBO可能是导致CP患者顽固性肠道不适的原因之一,特别是临床上对足量胰酶和PPI治疗不敏感者,常合并SIBO,针对性使用抗生素或许能改善CP患者的消化道症状.在未来,期待有更多高质量的临床试验来验证这一观点.
4 结论
综上所述,目前SIBO的各种诊断技术都有其局限性,且诊断标准尚不统一,为临床上SIBO的诊治带来一定的困难.CP与SIBO关系密切,SIBO在CP患者中有着较高的发病率.CP导致SIBO的具体机制尚不完全明确,其机制可能涉及.
胰酶活性不足、糖尿病神经病变、阿片类药物及PPI的使用、回肠制动、饮酒等.而SIBO反过来可能会加重CP患者肠道症状并恶化其营养状况.临床上针对胰酶替代治疗后,消化道症状仍迁延不愈的CP患者,应注意筛查是否合并SIBO,对合并SIBO的CP患者予以抗菌药物治疗后,可能会使肠道症状得到改善,提高其生活质量,这为CP的治疗提供了新的思路.目前相关研究仍为小规模研究,未来仍需要有更多高质量、多中心的试验来进一步探究SIBO与CP的相关性,以期为此类患者的诊治提供一定的理论基础和临床实践依据.

