CYLD干扰对实验性视网膜脱离中光感受器细胞坏死性凋亡伴发自噬的影响
杨 南,丁 婕,闫原野,鲁 理,董 凯
视网膜脱离后光感受器细胞死亡的方式有多种,本课题组在国际上首次发现光感受器细胞的坏死性凋亡的形态学改变[1]。同时还发现,半胱氨酸的天冬氨酸蛋白水解酶抑制剂(carbobenzoxy-valyl-alanyl-aspartyl-fluoromethylketone, z-VAD-FMK)不仅诱导光感受器细胞的坏死性凋亡,同时还参与了自噬的激活[2]。另外,圆柱瘤基因(cylindromatosis,CYLD)干扰可以抑制视网膜脱离后光感受器细胞中的坏死性凋亡和凋亡[3],但是对坏死性凋亡中的自噬有无影响尚不清楚。另一方面,活性氧、Beclin1、雷帕霉素靶蛋白、磷酸肌醇三磷酸激酶、LC3-Ⅱ等多种蛋白质和信号通路参与了自噬的发生[4]。Beclin1是早期自噬体形成的必需组分,与自噬体膜的形成有关,并引导募集其他自噬相关蛋白定位于自噬体膜[5]。LC3-Ⅰ向LC3-Ⅱ的转换是自噬体形成的标志[6]。该研究探讨CYLD干扰对实验性视网膜脱离中光感受器细胞坏死性凋亡伴发自噬有无影响,为视网膜脱离后的视功能恢复提供一定理论基础和干预思路。
1 材料与方法
1.1 实验动物普通级健康雄性SD大鼠48只,体质量260~280 g,由安徽医科大学附属省立医院和上海交通大学附属第一人民医院提供,大鼠在室温18~25 ℃、湿度<60%环境下饲养。
1.2 实验方法
1.2.1视网膜脱离动物模型的建立 设计CYLD干扰靶序列为5′-GGTTGTACGGATGGAACTTTC-3′,根据靶序列构建慢病毒载体,转染大鼠视网膜细胞[3]。慢病毒干扰3周后,大鼠分为正常对照组、未干预组、CYLD干预组、阴性干预组,每组12只大鼠,用于电镜和Western blot检测各6只。实验大鼠腹腔注射10%水合氯醛(400 mg/kg)麻醉,术前0.5%的托吡卡胺扩瞳;左氧氟沙星滴眼液冲洗结膜囊(苏州参天制药有限公司),右眼注入透明质酸钠(1% 美国博士伦公司)50 μl于视网膜下建立网脱模型,网膜隆起范围约1/3~1/2。结膜10-0缝线标记脱离范围,以便取材时定位[1-3]。在各实验组建立视网膜脱离模型的同时,视网膜下注入z-VAD-FMK (300 μmol/L,美国Enzo公司)5 μl。实验组大鼠只在右眼建立模型,左眼不做处理做对照。
1.2.2电镜检测 建模第3天后,水合氯醛腹腔麻醉大鼠,摘取眼球,沿角巩膜缘剪开,清除角膜、晶体及玻璃体,剩下的眼杯使用2.5%戊二醛固定12 h,取出视网膜并制成1 mm×3 mm大小条块,用无水酒精脱水后用环氧树脂对标本包埋。做成超薄切片,枸橼酸铅和醋酸铀双染法染色[1]。切片的观察和摄片是使用JEM-1230EX透射电镜(日本电子公司),观察光感受器细胞层的超微结构改变。
确定光感受器位置,单个切片随机选取观察的光感受器细胞为200个,确定光感受器细胞的死亡方式是通过视网膜脱离后第3天观察其形态学改变。通常光感受器细胞凋亡形态学表现为细胞体积缩小和细胞核浓缩,细胞坏死的表现为细胞肿胀、溶解,细胞膜破裂、不完整[2,7]。
1.2.3Western blot 建模第3天取视网膜组织,用RIPA裂解液与1%的蛋白酶抑制剂充分裂解,组织匀浆、超声、离心BCA行蛋白浓度检测定量;取等量蛋白上样后凝胶电泳(SDS-PAGE),初始65 V,当蛋白位于浓缩胶、分离胶交界处,提升为125 V;冰上转膜2 h,25 V;5%脱脂牛奶室温封闭40 min;封闭后,膜与LC-3(1 ∶500)、Beclin-1(1 ∶1 000)、β-肌动蛋白(1 ∶1 000)抗体4 ℃孵育过夜。复温后TBST缓冲液洗膜3次,用HRP标记的二抗(在TBST中1 ∶5 000稀释,圣克鲁斯生物技术)室温孵育2 h,根据说明,通过化学发光剂ECL显现条带[2-3]。使用Bandscan 4.3软件(加拿大Glyko公司)检测电泳条带的灰度值。LC3蛋白、Beclin-1蛋白与内参照β-actin相比,作为其相对表达水平。
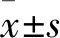
2 结果
2.1 CYLD干扰对视网膜脱离后光感受器细胞的影响建立视网膜脱离模型3 d后,电镜观察发现,视网膜脱离后光感受器细胞不仅出现凋亡和坏死,而且还可以观察到坏死性凋亡的形态学改变,其与坏死细胞类似,但染色质固缩边聚,同时可以观察到明显的空泡样改变和自噬泡。见图1。CYLD干预组感光细胞坏死数明显低于未干预组和阴性干预组,差异有统计学意义(F=19.19,P<0.05)。见图2。

图1 电镜下光感受器细胞形态学特点 ×4 000A:正常对照组;B: 未干预组;C:CYLD干预组;D:阴性干预组

图2 电镜下光感受器细胞坏死数与未干预组比较:*P<0.05;与阴性干预组比较:#P<0.05
2.2 CYLD干扰对LC3蛋白表达的影响Western blot检测结果显示,CYLD干预组的LC3蛋白相对表达较未干预组和阴性干预组明显降低,差异有统计学意义(F=1623.81,P<0.01)。见图3。
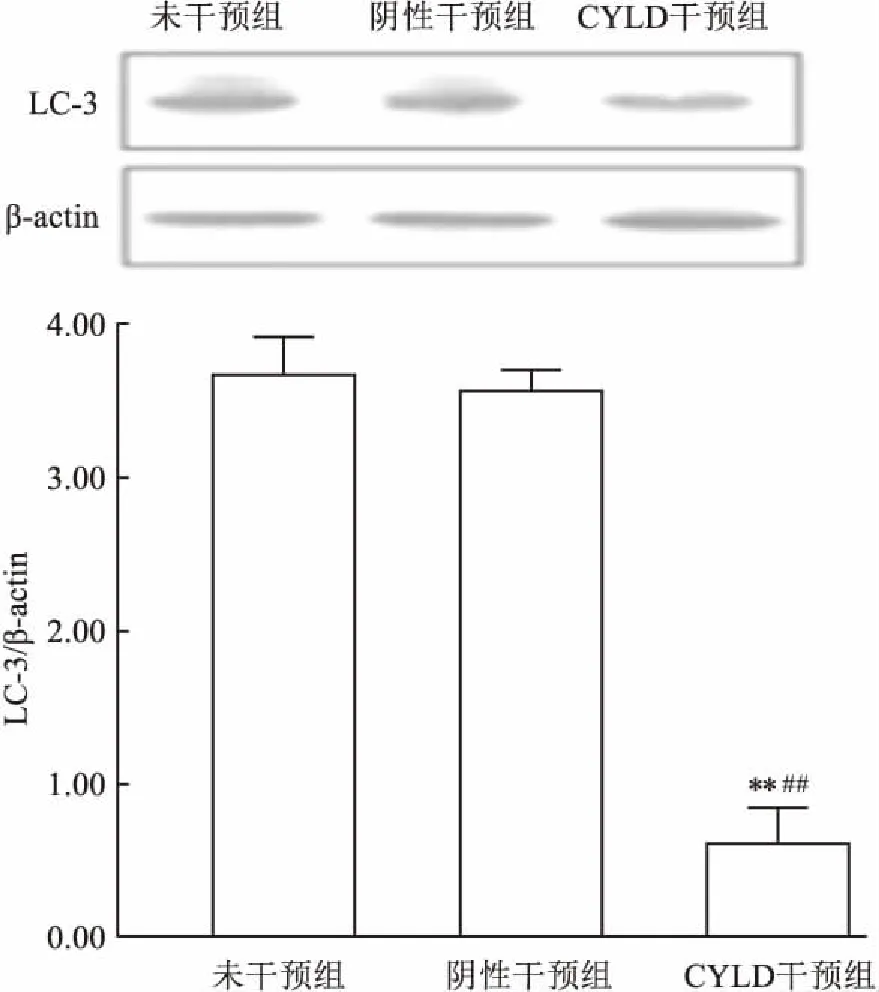
图3 Western blot检测大鼠视网膜LC3蛋白表达与未干预组比较:**P<0.01;与阴性干预组比较:##P<0.01
2.3 CYLD干扰对Beclin-1蛋白表达的影响Western blot检测结果显示,CYLD干预组的Beclin-1蛋白相对表达较未干预组和阴性干预组明显降低,差异有统计学意义(F=121.37,P<0.01)。见图4。

图4 Western blot检测大鼠视网膜Beclin-1蛋白表达与未干预组比较:**P<0.01;与阴性干预组比较:##P<0.01
3 讨论
本研究结果显示,慢病毒载体进行大鼠视网膜下注射3周后,建立视网膜脱离模型,网脱模型建立后3 d,取视网膜组织进行电镜检测,光感受器细胞的病理学形态改变不仅是凋亡和坏死,同时部分细胞也表现为染色质固缩边聚,同时可以观察到明显的空泡样改变和自噬泡,符合坏死性凋亡伴自噬的表现[8]。LC3、Beclin-1蛋白参与实验性视网膜脱离后光感受器细胞的坏死性凋亡伴自噬的发生,CYLD干扰后,LC3、Beclin-1蛋白表达明显降低,表明光感受器细胞的坏死性凋亡伴发的自噬受抑制,其机制可能是抑制了LC3和Beclin-1的活化。从而可以得出CYLD干扰后,不仅可以抑制光感受器细胞的坏死和凋亡,同时还可以抑制坏死性凋亡中自噬的发生。
早期研究[9]表明,使用zVAD(一种具有广泛特异性的泛半胱天冬酶抑制剂)可以诱导L929细胞的自噬和死亡。这种细胞死亡过程需要丝氨酸苏氨酸激酶1受体相互作用蛋白,提示自噬参与坏死性凋亡。有研究[10]已经证明自噬和坏死都参与了海马体的神经损伤,而姜黄素确实通过多方面的机制对神经元细胞死亡有神经保护作用。Degterev et al[11]发现在坏死性凋亡过程中,自噬也可以被激活,并且与微管相关蛋白LC-3I转化为LC-3II相关。Rosenbaum et al[12]在视网膜缺血模型中发现,使用z-VAD-FMK预处理后,坏死抑制素-1不仅能抑制坏死,还能抑制自噬,改善功能结果。这进一步验证了本实验结果,证实CYLD干扰后,不仅抑制视网膜脱离后光感受器细胞的坏死和凋亡,同时抑制了光感受器细胞的坏死性凋亡伴发的自噬。
目前认为自噬主要作为一种保护机制,可以防止细胞死亡,维持细胞完整性主要通过亚细胞碎片的清除和再生代谢前体[13]。在儿童急性淋巴细胞白血病细胞中,需要诱导自噬依赖性坏死性凋亡,以克服糖皮质激素的耐药性[14]。Kim et al[15]发现在肺癌的研究中利用紫草素抑制自噬后发现坏死性凋亡增加。相反,本课题组前期观察结果表明,自噬标志物LC-3II的活化受坏死信号的控制,这表明自噬参与坏死也导致细胞损伤[2]。这些都表明自噬和坏死性凋亡有对应关系,但是自噬是一个复杂的过程,在坏死性凋亡的过程中自噬是如何被激活的尚不清楚,因此在未来的研究中,有必要探索自噬和坏死性凋亡的联系。
综上所述,在小分子干扰RNA介导的CYLD干扰的大鼠实验性视网膜脱离模型中,通过抑制LC3和Beclin-1的活化,抑制光感受器细胞的坏死性凋亡伴发的自噬。进一步研究自噬、凋亡和坏死性凋亡之间的调控关系,为最大限度抑制细胞死亡,促进细胞存活,保护视网膜细胞提供新的理论依据和治疗思路是本课题后续研究方向。

