Pes1通过PI3K/AKT/GSK-3β信号通路对胆汁淤积性肝病小鼠的作用
杨仁俊,汪 婧,孙 颉,张 娜,孔德润
胆汁淤积性肝病在人群及临床中非常常见,它可由各种原因引起的胆汁生成、分泌和排泄障碍,导致胆汁在肝内淤积,而引起的肝细胞、肝内外胆管一系列器质性损害和功能性异常的肝胆系统疾病[1-2]。此病预后较差,无令人满意的治疗方案。Pescadillo 同源蛋白1 (Pescadillo homologue 1,Pes1)最初在斑马鱼的胚胎中被发现,与增殖阻断蛋白1(block of proliferation 1,BOP1)和WD重复蛋白12(WD repeat domain 12,WDR12)结合形成稳定的复合物,对于核糖体60 S亚基的合成至关重要[3]。Pes1是一种核仁蛋白,在鼠或人的正常胚胎发育和细胞周期调控中起重要作用。Pes1在其基序中含有保守的乳腺癌易感基因末端结构域,考虑到此结构域作为响应DNA损伤反应的整合信号模块,Pes1也可能参与DNA损伤和修复[4]。糖原合酶激酶-3β(glycogen synthase kinase 3β,GSK-3β)是已知在细胞凋亡信号传导中重要的丝氨酸/苏氨酸激酶[5]。该研究以胆汁淤积性肝病小鼠为模型,研究Pes1以及PI3K/AKT/GSK-3β信号通路中的蛋白在胆汁淤积性肝病小鼠中的表达,旨在更好地了解Pes1以及PI3K/AKT/GSK-3β信号通路在胆汁淤积性肝病中的作用。
1 材料与方法
1.1 实验动物与试剂20只6~7周龄的SPF级雄性C57BL/6小鼠购自南京模式动物研究所。总胆汁酸(total bile acid,TBA)、总胆红素(total bilirubin,TBIL)、碱性磷酸酶(alkaline phosphatase,AKP)、γ-谷氨酰转肽酶(glutamyl transpeptidase,GGT)测试盒均购自南京建成生物工程研究所;TRIzol试剂购自美国Invitrogen公司;逆转录反应试剂盒、实时定量荧光PCR(RT-PCR)专用试剂盒购自日本TaKaRa公司;PCR引物购自上海生工生物工程股份有限公司;多聚甲醛固定液、RIPA裂解液以及特超敏ECL化学发光试剂盒均购自上海碧云天生物技术研究所;Western blot一抗Pes1、β-actin、磷脂酰肌醇3-激酶(phosphoinositide-3-kinase,PI3K)、p-PI3K、蛋白激酶B(protein kinase B,PKB)、磷酸化Akt丝氨酸473位点(phospho-Akt ser473,p-Akt473)、磷酸化Akt苏氨酸308位点(phospho-Akt thr308,p-Akt308)、GSK-3β、p-GSK-3β均购自美国abcam公司;Western blot二抗(辣根过氧化物酶标记的山羊抗小鼠IgG、山羊抗兔IgG)均购自北京中杉金桥生物技术有限公司。
1.2 动物造模与处理所有小鼠在安徽医科大学动物中心饮食饮水,温度控制在20~26 ℃,湿度控制在50%左右,12 h光照周期单笼喂养。所有小鼠适应环境,正常饮食饮水1周后,随机分组,每组10只。对照组C57BL/6喂食普通基础饲料4周,实验组C57BL/6喂养含有0.1% 3,5-二乙氧基羰基-1,4-二氢-2,4,6-三甲基吡啶(3,5-diethoxycarbonyl-1,4-dihydrocollidine,DDC) 饲料4周。在实验麻醉之前先称量每只小鼠体质量,之后均先按小鼠每0.1 ml/10 g体质量腹腔注射10%水合氯醛麻醉,之后心脏取血获取血清,-80 ℃下保存;取肝脏用冰PBS清洗后立即在液氮中急速冷却,置-80 ℃储存。
1.3 方法
1.3.1肝脏病理学观察 取小鼠肝脏用4%多聚甲醛固定,石蜡包埋,切片,做常规病理HE染色,在光学显微镜下观察组织病理变化。
1.3.2小鼠血清生化指标检测 取小鼠血清,按照生化试剂测试盒说明书操作检测血清TBA、TBIL、AKP、GGT水平。
1.3.3Western blot 用RIPA裂解液补充1%蛋白酶抑制剂和2%磷酸酶抑制剂的总混合物在冰上操作提取肝组织总蛋白。各蛋白样品通过BCA试剂盒测定浓度并用RIPA配制成相同浓度,将每组蛋白质样品与上样缓冲液充分混合后,将其在100 ℃金属浴下煮沸10 min,使蛋白变性并在SDS-PAGE凝胶中进行电泳,并以恒流200 mA将蛋白转移至PVDF膜上,用5%BSA封闭液封闭1~1.5 h。之后的膜与Pes1、β-actin、PI3K、p-PI3K、AKT、p-Akt473、p-Akt308、 GSK-3β、p-GSK-3β等一抗4 ℃孵育过夜,用TBST清洗3次,每次10 min,在室温下与二抗(1 ∶5 000)孵育1~1.5 h,再次用TBST清洗后显影,应用自动凝胶成像仪曝光显影采集图像。
1.3.4RT-PCR 使用TRIzol试剂提取肝组织的总RNA,然后测RNA浓度,利用反转录试剂盒反转录为cDNA。按照说明书进行RT-PCR,扩增cDNA,以β-actin为内参,用2-ΔΔCt法分析计算mRNA表达量。每次实验重复3次。Pes1正向引物:5'-CCCAGTGGGTCTTTGACTGT-3',反向引物:5'-ACGAAGGGTGAAAGATGTGG-3';β-actin正向引物:5'-CTCTCCCTCACGCCATC-3',反向引物:5'-ACGCACGATTTCCCTCTC-3'。
2 结果
2.1 胆汁淤积性小鼠及正常小鼠体质量检测在喂养的4周内,DDC模型小鼠随着喂食时间增加出现呆滞少动,皮肤黄染;对照组小鼠情况基本正常。解剖后DDC模型小鼠有腹膜黄染,肝脏色稍黄,质稍硬;正常组小鼠肝脏呈粉红色、光滑柔软。开始喂养时正常对照组小鼠体质量为(24.32±0.19)g,与DDC组小鼠体质量(24.19±0.46)基本一致,差异无统计学意义。喂养4周后DDC小鼠体质量为(18.32±1.13)g,与对照组正常C57BL/6小鼠(25.30±0.94)g比较,DDC模型小鼠体质量明显减轻,差异有统计学意义(t=4.83,P<0.05)。见图1。
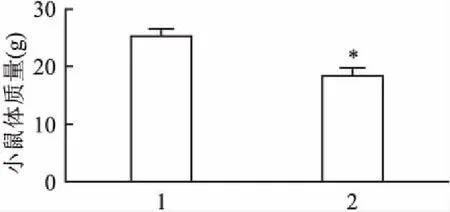
图1 4周后小鼠体质量变化1:对照组;2:DDC实验组;与对照组比较: *P<0.05
2.2 小鼠肝组织病理学观察肝脏常规病理HE染色光学显微镜下显示,对照组小鼠肝组织结构基本正常,胆管周围基本无炎性细胞,而DDC模型小鼠肝组织中可见汇管区扩大,汇管区以及胆管周围大量炎性细胞浸润,胆管变形以及胆管增生。见图2。
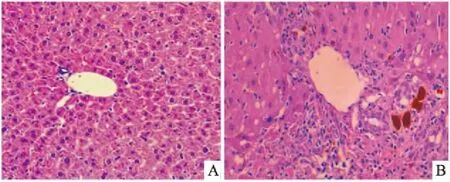
图2 小鼠肝组织光学显微镜下表现 HE×200A:对照组;B:DDC实验组
2.3 小鼠血清生化指标水平与对照组C57BL/6比较,胆汁淤积性肝病小鼠血清中TBA水平明显增加(t=18.46,P<0.01),见图3A;胆汁淤积性肝病小鼠血清中TBIL水平明显增加(t=9.64,P<0.01),见图3B;胆汁淤积性肝病小鼠血清中AKP活力明显增加(t=4.88,P<0.01),见图3C;胆汁淤积性肝病小鼠血清中GGT水平明显增加(t=6.79,P<0.01),见图3D。
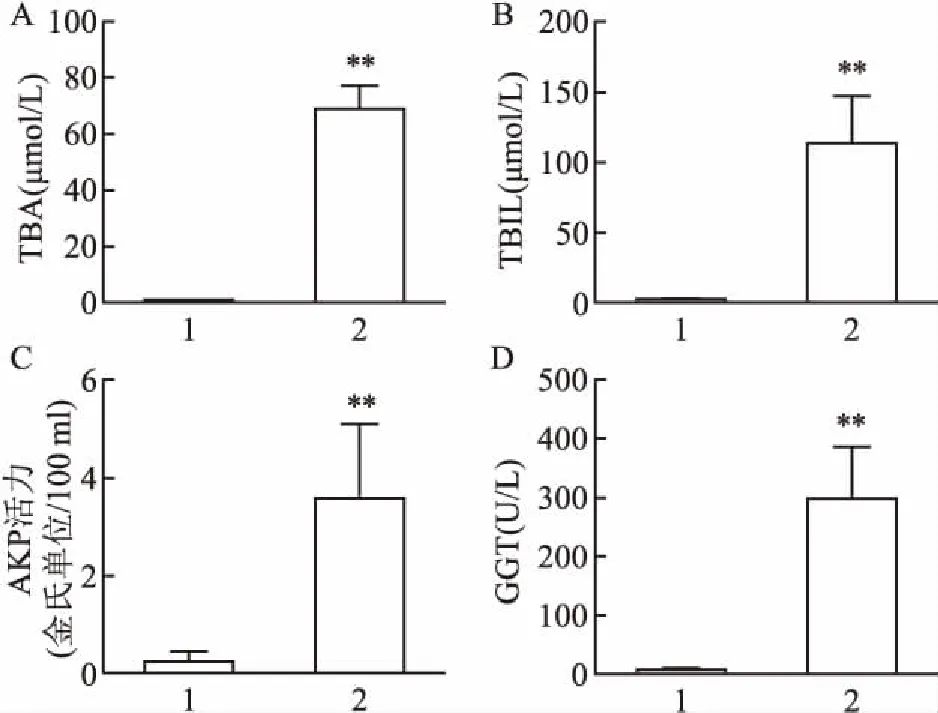
图3 小鼠血清生化指标的水平
A:TBA;B:TBIL;C:AKP活力;D:GGT;1:对照组;2:DDC实验组;与对照组比较:**P<0.01
2.4 胆汁淤积性小鼠以及正常小鼠肝脏中Pes1的表达水平Western blot和RT-PCR检测胆汁淤积性小鼠以及正常小鼠肝脏中Pes1蛋白以及mRNA的表达。GraphPad Prism 6.02分析显示,胆汁淤积性小鼠肝脏中Pes1蛋白(t=11.85,P<0.01)及mRNA(t=5.33,P<0.01)的表达水平均低于正常小鼠肝脏组织,两者结果是一致的。见图4。
2.5 胆汁淤积性小鼠中PI3K/AKT/GSK-3β信号通路中蛋白表达的水平Western blot法检测小鼠肝脏中PI3K/AKT/GSK-3β蛋白的表达。与对照组比较,胆汁淤积性肝病小鼠即DDC模型小鼠肝脏中总的PI3K蛋白表达水平无明显变化,而p-PI3K呈低表达,与对照组比较明显降低,差异有统计学意义(t=16.23,P<0.01),见图5A;两组小鼠肝脏中总的AKT蛋白表达水平无明显变化,而DDC小鼠肝脏中p-Akt473、p-Akt308呈低表达,与对照组比较明显降低,差异有统计学意义(t=6.62、8.62,P<0.05),见图5B;两组小鼠肝脏中总的GSK-3β蛋白表达水平无明显变化,而DDC小鼠肝脏中p-GSK-3β也是呈低表达,与对照组比较明显降低,差异有统计学意义(t=9.10,P<0.05),见图5C。
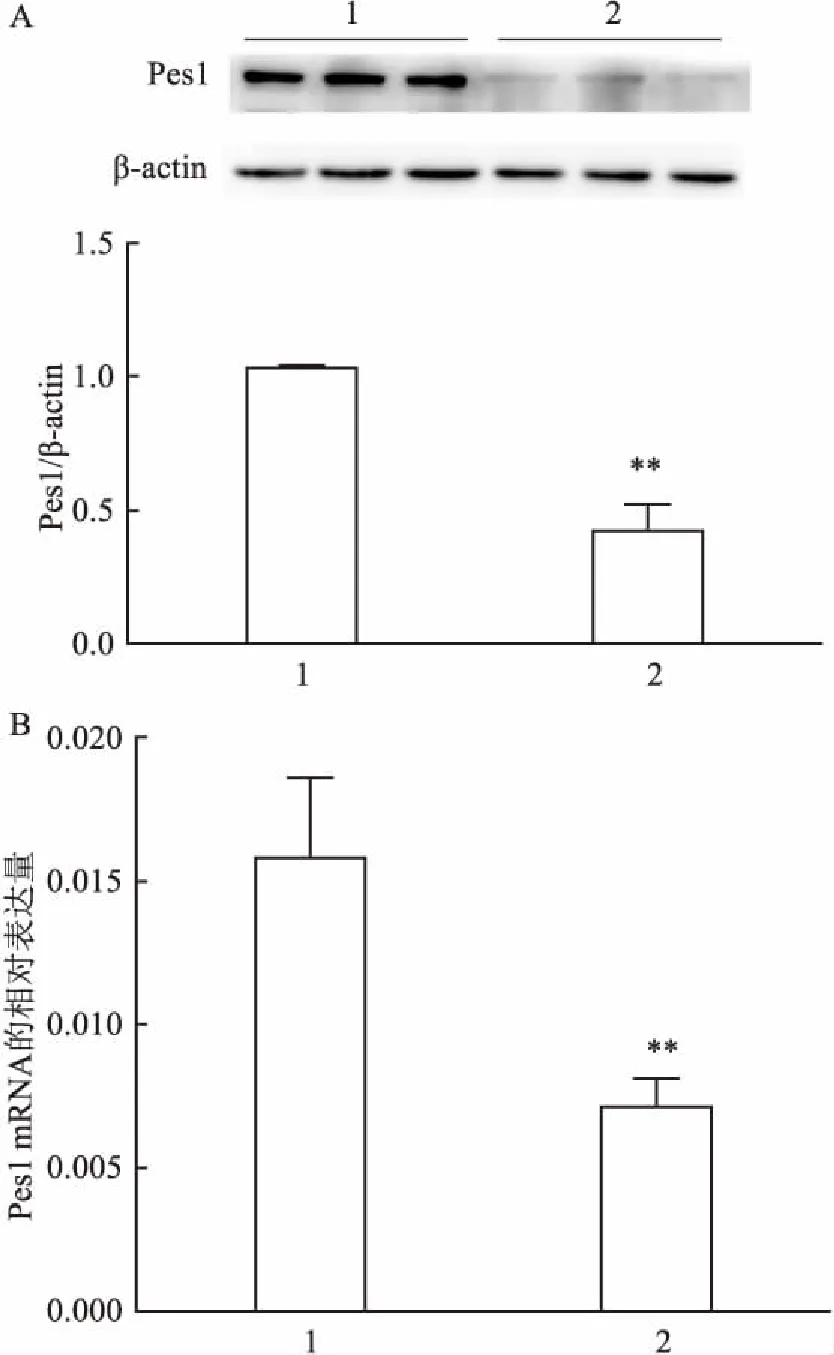
图4 小鼠肝脏中 Pes1 蛋白和mRNA的表达水平
A:Pes1在肝脏中蛋白的表达;B:Pes1在肝脏中mRNA的表达;1:对照组;2:DDC实验组;与对照组比较:**P<0.01
3 讨论
胆汁淤积性肝病如常见的原发性硬化性胆管炎好发于青壮年男性,起病较隐匿,以进行性肝内和肝外纤维闭塞性胆管炎为特征,引起肝内大胆管节段性狭窄,胆管闭塞,最终可发展为肝硬化和肝衰竭[6]。而小鼠DDC喂养是胆汁淤积性肝病的一种成熟模型,本研究中的DDC小鼠模型就是以肝内大胆管损伤为主要特点的原发性硬化性胆管炎的动物模型,随着造模时间的延长,出现胆管损伤、节段性胆管狭窄梗阻,长期持续性的胆汁淤积将进展为肝纤维化甚至肝硬化[7]。因此,上述模型是研究胆汁淤积肝病的发病机制和寻找治疗药物研究的理想模型。本研究旨在探讨Pes1以及PI3K/AKT/GSK-3β信号通路在胆汁淤积性肝病中的表达和作用,有助于将Pes1开发为胆汁淤积性肝病治疗的一个新靶点。
Pes1不仅参与核糖体生物发生即制造核糖体的过程,对细胞生长、增殖和动物正常发育至关重要[3], Pes1还参与调节DNA损伤应答与修复。有研究[8-9]表明,Pes1可直接结合DNA并调节基因转录,是一种多功能蛋白质,除了胚胎发育外,还有助于多种生理过程。此外,Pes1的沉默表达可以使AKT /GSK-3β信号通路失活[10]。同时,研究[11-12]表明,PI3K/AKT/GSK-3β信号传导通路在细胞中是广泛存在的,通过调节多种与细胞代谢、生长、凋亡及分化等过程,抑制细胞凋亡,而且可保护肝细胞免受胆汁酸所诱导的细胞凋亡。GSK-3β是一种多功能激酶,不仅在糖原代谢中起作用,还参与细胞凋亡,且已知它是细胞程序性死亡的上游调节因子,可促进 Caspase-3活化,活化的Caspase-3参与许多监管程序,是细胞凋亡的执行者;GSK-3β还会导致线粒体中细胞色素 C 释放,进一步诱导细胞凋亡。活化的AKT通过磷酸化GSK-3β上的残基丝氨酸-9,而抑制其生物活性,即磷酸化 GSK-3β(p-GSK-3β)是非活性的状态,从而抑制了Caspase-3 的活化以及细胞色素C 的释放,抑制肝细胞的凋亡,并减少细胞损伤[13-14]。
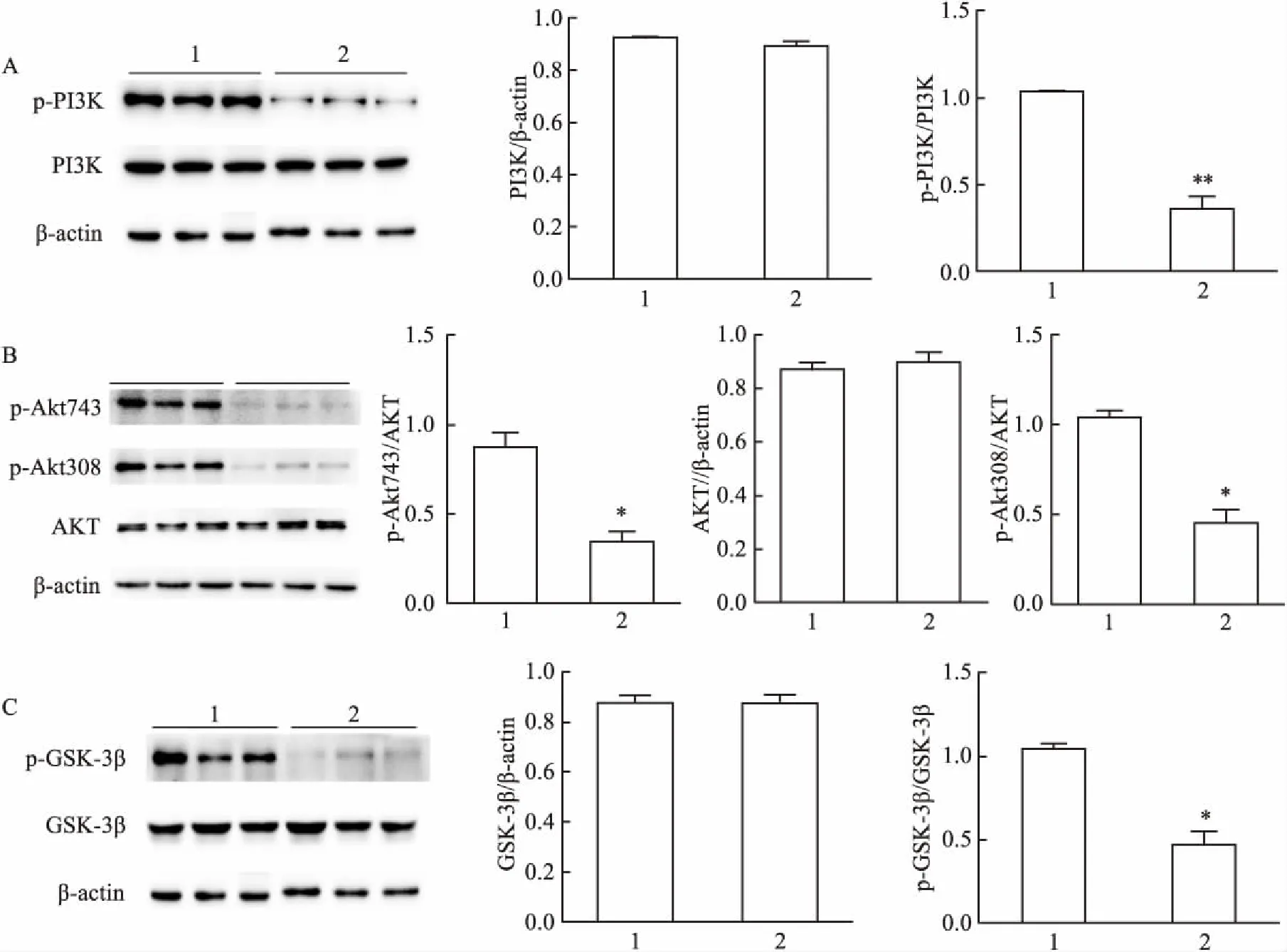
图5 两组小鼠中PI3K/AKT/GSK-3β信号通路中蛋白表达的变化
A:肝脏中PI3K、 p-PI3K的表达; B:肝脏中AKT及其磷酸化蛋白的表达; C:肝脏中GSK-3β、p-GSK-3β的表达;1:对照组;2:DDC实验组;与对照组比较:*P<0.05,**P<0.01
实验结果表明,由于长期食用DDC,导致小鼠胆汁淤积性肝病的发生,胆汁淤积,在排泄过程中出现异常,致胆汁淤积性肝病小鼠血清中TBA等生化指标水平较对照组明显增加。另外,在此研究中首次证明,与对照组小鼠比较,Pes1在胆汁淤积性肝病小鼠即DDC实验组中mRNA和蛋白均下调。同时,在胆汁淤积性肝病小鼠中p-PI3K、p-Akt473、p-Akt308、p-GSK-3β蛋白较对照组表达水平降低,而总的PI3K、 AKT、GSK-3β无明显变化。结果表明在胆汁淤积性肝病中由于Pes1表达水平降低,其机制是降低的Pes1使 PI3K/AKT/GSK-3β信号通路失活,由此依次降低PI3K和 AKT的磷酸化水平,最终下调了磷酸化GSK-3β的表达,使磷酸化GSK-3β对肝细胞凋亡的抑制、减轻细胞损伤的作用减弱,从而进一步加重了胆汁淤积性肝病的发生发展,提示Pes1可能是对胆汁淤积性肝病起到保护的作用,这一发现为进一步了解和治疗胆汁淤积性肝病提供了新的见解。但是在细胞中和组织中增强Pes1的表达,并通过经典的PI3K/AKT/GSK-3β信号通路,使之起到对胆汁淤积性肝病的保护作用并改善治疗胆汁淤积性肝病有待进一步的研究。
——以咸阳市屯庄水库为例

