磷酸壳寡糖修饰阿霉素脂质体的制备及体内外评价
刘金虎,冯帅帅,杜 源,慕宏杰,吴子梅
(烟台大学药学院,新型制剂与生物技术药物研究山东省高校协同创新中心(烟台大学),山东 烟台 264005)
骨肉瘤(osteosarcoma,OS)是青少年中常见的一种恶性骨肿瘤.目前主要的治疗方式为手术切除病灶加辅助化疗[1-2].然而,常规的化疗药物普遍缺乏选择性,经常给患者带来各种毒副作用;同时骨的一些生理特点,如骨周围的血流量少、结晶程度高、细胞受体特定等,使药物很难穿透进入发挥疗效[3].
磷酸壳聚糖(phosphorylated chitosan,PCTS)是一种含有磷酸基团的壳聚糖衍生物.具有生物相容性好、生物可降解、无毒等特点,且水溶性比壳聚糖(chitosan,CTS)好.研究表明,借助于磷酸基团与Ca2+的螯合作用,PCTS可与羟基磷灰石(HAp)结合;PCTS多孔支架能明显促进hFOB细胞的分化及新骨的形成;在骨组织工程中,PCTS可改善生物复合材料的压缩强度等[4-6].因此,PCTS与骨有良好的生物相容性.另外,针对原发性骨肉瘤骨中存在大量HAp的特点,人们已将HAp作为开发骨靶向制剂的重要靶点[7].然而,研究者目前主要关注PCTS在骨组织工程方面的应用,却忽视了它潜在的趋骨性;同时,由PCTS所修饰的药物载体在动物体内的骨靶向能力尚不得而知.
磷酸壳寡糖(phosphorylated chitooligosaccharide,PCS)是由壳寡糖(chitooligosaccharide,CS)磷酸化形成的.它分子质量小、结构简单、容易修饰,结构与PCTS相似,并且还能促进HAp的形成,在骨组织工程领域同样显示了良好的开发前景[8].截至目前,PCS在体内的趋骨性也未见报道.本研究以PCS为研究对象,首先通过化学反应引入疏水的胆固醇(Chol),然后修饰到脂质体制备得到PCS-DOX-L.随后,通过小动物活体成像考察PCS修饰脂质体在骨肉瘤荷瘤小鼠体内的骨靶向性.
1 实验仪器与材料
1.1 仪器
粒度分析仪(Delsa Nano C,Beckman Coulter);酶标仪(Spectra Max M2,Molecular Devices);旋转蒸发仪(RE-3000,上海亚荣生化仪器厂);紫外可见分光光度计(UV-9000,上海元析仪器有限公司);CO2培养箱(HERAcell 150i,Thermo Fisher Scientific);电子透射显微镜(TEM,JEM-1400 Plus,日本电子株式会社);小动物成像系统(In vivo FX Pro,Carestream Health).
1.2 材料
大豆卵磷脂(大连美伦生物技术有限公司,批号A0809A);胆固醇(国药集团化学试剂有限公司);盐酸阿霉素(DOX·HCl,Ark Pharm,批号161208001);壳寡糖(CS,分子质量≤3 kU,济南海得贝海洋生物工程有限公司);胆固醇琥珀酸单酯(CHEMS,梯希爱化成工业发展有限公司);1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl,萨恩化学技术(上海)有限公司);N-羟基琥珀酰亚胺(NHS,成都艾科达化学试剂有限公司);透析袋(分子截留量MwCO=1 kU,西安优博生物科技有限公司);五氧化二磷(P2O5,天津永大化学试剂公司);甲磺酸(天津光复精细化工研究所);2,4,6-三硝基苯磺酸(TNBS,Sigma);钼酸铵(国药集团化学试剂有限公司);KH2PO4基准品(上海山浦化工有限公司);乌氏粘度计(内径0.58 mm,上海申立玻璃仪器有限公司).
Balb/c裸鼠(18~25 g,常州卡文斯实验动物有限公司);骨肉瘤MG63细胞(中国科学院上海细胞库);胎牛血清(FBS,Gibco,Life Technologies Corporation);MEM培养基(Gibco,Life Technologies Corporation);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,Sigma);青霉素-链霉素双抗试剂(HyClone,GE Healthcare Life Corporation);0.25%胰蛋白酶(HyClone,GE Healthcare Life Sciences);DiR染料(北京富百科生物技术有限公司);其余化学试剂均为分析纯.
2 方 法
2.1 壳寡糖-胆固醇接枝聚合物(CS-Chol)的合成
采用羧酸与氨基的缩合反应合成CS-Chol.方法如下:称取CHEMS 24.3 mg、EDC·HCl 38.3 mg和 NHS 23.0 mg溶于DMSO中,然后于55 ℃加热活化CHEMS的羧基.另取CS 300 mg,同样溶于DMSO中.然后,将活化好的CHEMS溶液向CS溶液中逐滴加入,反应于55 ℃下进行24 h.待反应结束后,将溶液转移到透析袋(MwCO=1 kU)中,共透析48 h,然后取袋中的上清液冻干,得到CS-Chol.
2.2 磷酸壳寡糖-胆固醇接枝聚合物(PCS-Chol)的合成
本反应为壳寡糖的磷酸化反应,参照WANG K P等[9]的方法,反应步骤如下:称取第一步产物100 mg并溶于甲磺酸中.在冰浴条件下将P2O550 mg缓慢加入到上述甲磺酸溶液中,反应进行3 h.反应结束后向溶液中加入过量的冷乙醚,同时不断快速搅拌使沉淀析出.离心后,收集沉淀.然后用丙酮和乙醇重复上述步骤各一次.待离心结束后,收集离心管中的沉淀.然后,用适量的去离子水复溶并转移至透析袋(MwCO=1 kU)中.透析48 h后,冻干.即得PCS-Chol.
2.3 聚合物的结构表征
分别将CS-Chol、PCS-Chol粉末与适量的KBr混合、压片,然后用红外光谱仪进行红外扫描(扫描范围为4 000~400 cm-1).另称取适量的 PCS-Chol粉末,用D2O溶解后由核磁共振仪(400 MHz)进行31P-NMR的测定.
参照MA Y K等[10]的方法,用TNBS法分别测定2种聚合物上Chol的取代度,记为DSChol.用强酸将PCS-Chol降解后,采用钼酸铵比色法测定PCS-Chol中磷的取代度[11],记为DSP.
2.4 聚合物的特性黏度
运用乌氏黏度计测定两种聚合物的特性黏度.参照文献[12]的方法,用黏度计分别依次测定PCS-Chol溶液在一系列不同浓度下(C)的增比黏度(ηsp),然后以ηsp/C对C进行线性回归,所得直线与纵轴的截距即为该聚合物的特性黏度.CS-Chol同样按照上述方法进行测定.
2.5 脂质体的制备
PCS修饰阿霉素脂质体(PCS-DOX-L)的制备过程共分2步进行:首先采用逆相蒸发结合(NH4)2SO4梯度法制备DOX脂质体(DOX-L),然后用后插入法将PCS-Chol插入到DOX-L的表面,即得PCS-DOX-L.具体操作过程如下:准确称取大豆卵磷脂36 mg和胆固醇9 mg于圆底烧瓶中,然后加入适量甲醇与氯仿组成的混合溶剂(2∶1,V/V)使它们溶解.接着,向其中再加入适量250 mmol/L (NH4)2SO4溶液并探头超声,最终形成稳定的W/O型乳剂.待旋转蒸发除掉有机溶剂后,继续加入(NH4)2SO4溶液并水化膜材.待形成脂质体混悬液后,将溶液分别依次挤压通过0.45 μm和0.22 μm孔径的微孔滤器,最终得到空白脂质体.
采用主动载药法包载DOX.其步骤为:首先,利用透析法除掉脂质体外水相中游离的(NH4)2SO4;然后,将DOX·HCl溶液(浓度为3 mg/mL,药脂比=24∶1)逐滴加入到上述脂质体溶液中,45 ℃孵育1 h,此时得到DOX-L.
配制0.2%(W/V)PCS-Chol溶液的方法如下:准确称取适量的PCS-Chol冻干粉,然后用pH值为4.5的醋酸盐溶液溶解并调整至最终浓度即得.向DOX脂质体溶液中逐滴加入上述聚合物溶液(大豆卵磷脂:PCS=6∶1,W/W)后,在室温下缓慢搅拌1 h,并于4 ℃保存过夜,即得PCS-DOX-L.
CS-DOX-L作为对照组,制备过程与上述步骤基本相同.
CS-L和PCS-L为不含DOX的空白脂质体,制备过程除载药外,其他操作同上.
2.6 脂质体的表征
2.6.1 粒径分布和zeta电位 利用粒度分析仪分别测定普通脂质体、CS-L和PCS-L的粒径分布和zeta电位.
2.6.2 包封率和载药量 采用超滤离心法测定脂质体的包封率,参照XU H等[13]并略有改进:精密量取一定量的DOX-L、CS-DOX-L及PCS-DOX-L溶液,置于离心管中(MwCO=100 U).然后,超速离心30 min,转速为3 000 r/min.待离心结束后,取出超滤液,进入HPLC系统,计算游离药物的含量.另精密量取上述脂质体溶液适量,加入甲醇超声破乳并用0.2 μm微孔滤膜滤过后,取续滤液,进入HPLC系统,计算脂质体的总药量.按式(1)、(2)分别计算脂质体的包封率和载药量:
包封率=(向脂质体投入的总药量-游离的药量)/向脂质体投入的总药量)×100%,
(1)
载药量=(脂质体的总药量-游离的药量)/脂质体的总质量×100%.
(2)
2.7 形态
利用透射电子显微镜(TEM)观察普通脂质体和PCS-L的外部形态.方法如下:吸取经过稀释的脂质体溶液1滴,滴加到铜网上.待风干后,再加入1滴2%磷钨酸染液进行染色.用滤纸吸走多余的染液后,在TEM下进行观察.
2.8 体外释放
分别精密量取DOX溶液、CS-DOX-L和PCS-DOX-L 1 mL,放置于透析袋中(MwCO=1 kU).随后浸入到30 mL pH值为7.4或5的PBS溶液(含0.5%吐温80)中.采用恒温振荡法,37 ℃,100 r/min进行体外释放.每隔一段时间从溶液中吸取2 mL释放介质,同时补加等体积新鲜的介质.由HPLC测定释放介质中DOX的含量,然后计算累计释放度并绘制释放曲线.
2.9 体外细胞毒性
取对数生长的MG63细胞,用含有FBS的MEM培养基稀释后接种于96孔板上,接种数量为1×104个细胞/孔.培养过夜后,向孔内依次加入不同浓度的DOX溶液、CS-DOX-L及PCS-DOX-L.每个浓度设4个复孔.继续培养24 h或48 h后,向每孔加入20 μL 浓度为5 mg/mL的MTT,继续培养4 h.随后,吸掉培养基并分别向孔内加入150 μL DMSO.待37 ℃水浴震荡10 min后,用酶标仪在570 nm处测定各孔的吸光度(A570),然后分别计算各制剂不同浓度下的细胞生存率:
细胞生存率=给药组A570/阴性对照组A570×100%.
2.10 荷瘤裸鼠的组织分布研究
2.10.1 动物模型的建立 取Balb/c裸鼠,用4%水合氯醛麻醉后,在其右肢胫骨的骨髓腔内注射骨肉瘤MG63细胞悬液0.1 mL(接种数量为5×106/只);在左肢的相应位置不作处理,设为对照组.每天观察裸鼠的生长状况,每隔一天测量肿瘤的长(a)和宽(b),按式(3)计算肿瘤的体积:
V(mm3)=a×b2/2.
(3)
2.10.2 DiR脂质体的制备 采用逆相蒸发结合被动载药法制备包载DiR的各种脂质体.方法如下:准确称取卵磷脂36 mg、胆固醇9 mg及DiR 0.2 mg,用适量的氯仿与甲醇的混合溶剂溶解后,短时超声使形成稳定的初乳.待旋转蒸发除去有机溶剂后,向溶液中加入适量的PBS(pH值为7.4)水化膜材.形成脂质体混悬液后再依次经过0.45 μm、0.22 μm孔径的滤膜,便得到分布均一、粒径为200 nm左右的DiR-L.由DiR-L制备形成CS-DiR-L和PCS-DiR-L的步骤同2.5.另称取磷脂(33 mg)、胆固醇(9 mg)、DSPE-PEG2000(7 mg)和DiR(0.2 mg),同样按照上述步骤操作,最终得到PEG-DiR-L.FreeDiR是由DiR乙醇溶液(1 mg/mL)与适量聚氧乙烯、蓖麻油、生理盐水混合而成,作为对照。
2.10.3 组织分布研究 以DiR为示踪物质,将其包载于脂质体后,定性考察各种脂质体在小鼠体内的分布情况.实验过程如下:当裸鼠的肿瘤体积长至约100 mm3时,将裸鼠随机分为4组,每组3只.对上述4种制剂(Free DiR、PEG-DiR-L、CS-DiR-L和PCS-DiR-L)均按照20 μg DiR/只的剂量分别依次从裸鼠的尾静脉注射给药.从注射结束开始计时,分别于5 h、12 h和24 h,利用小动物活体成像系统拍摄各种制剂在裸鼠体内的分布情况(激发波长为720 nm,发射波长为790 nm).
待上述实验结束,立即处死动物.然后解剖、分离并收集心、肝、脾、肺、肾及带有肿瘤的右肢,同样置于小动物成像仪下进行观察.
2.11 分析方法
HPLC系统由Agilent 1260泵、1260 VWD检测器和Gensial C18柱(250 mm×4.6 mm,5 μm,广州研创生物技术发展有限公司)组成.流动相的组成为乙腈-醋酸盐缓冲液(pH值为4)(40∶60,V/V).流速为1 mL/min.温度为28 ℃.DOX的标准曲线为A=17.710C+3.765 3 (r=0.999 8),在0.5 ~ 25 μg/mL范围内线性关系良好.
3 结 果
3.1 聚合物的结构表征
在EDC和NHS的催化作用下,CHEMS上的羧基与CS的氨基之间发生酰化反应,生成CS-Chol.随后,在甲磺酸中P2O5与CS-Chol骨架上的羟基反应,生成磷酸化的聚合物,即PCS-Chol.CS-Chol与PCS-Chol的化学结构见图1,表征它们结构的FT-IR和PCS-Chol的31P-NMR图见图2.
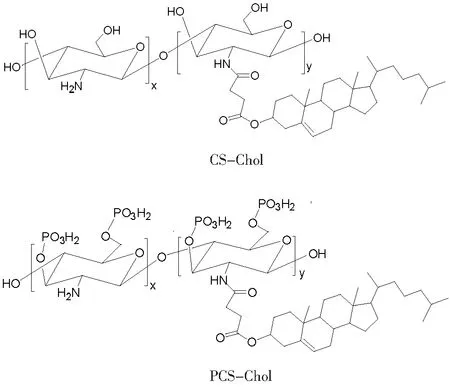
图1 CS-Chol和PCS-Chol的结构式
由图2(a)可知,在聚合物CS-Chol中,2 936和2 885 cm-1处的吸收峰来自于胆固醇vCH的吸收峰;1 644 cm-1处的吸收峰来自于酰胺键的vC=O,是由CHEMS与CS之间发生反应后生成的.1 077 cm-1处的强峰是由CS上vC-O-C产生的.此外,在1 385 cm-1处的吸收峰也是该聚合物的特征峰之一.
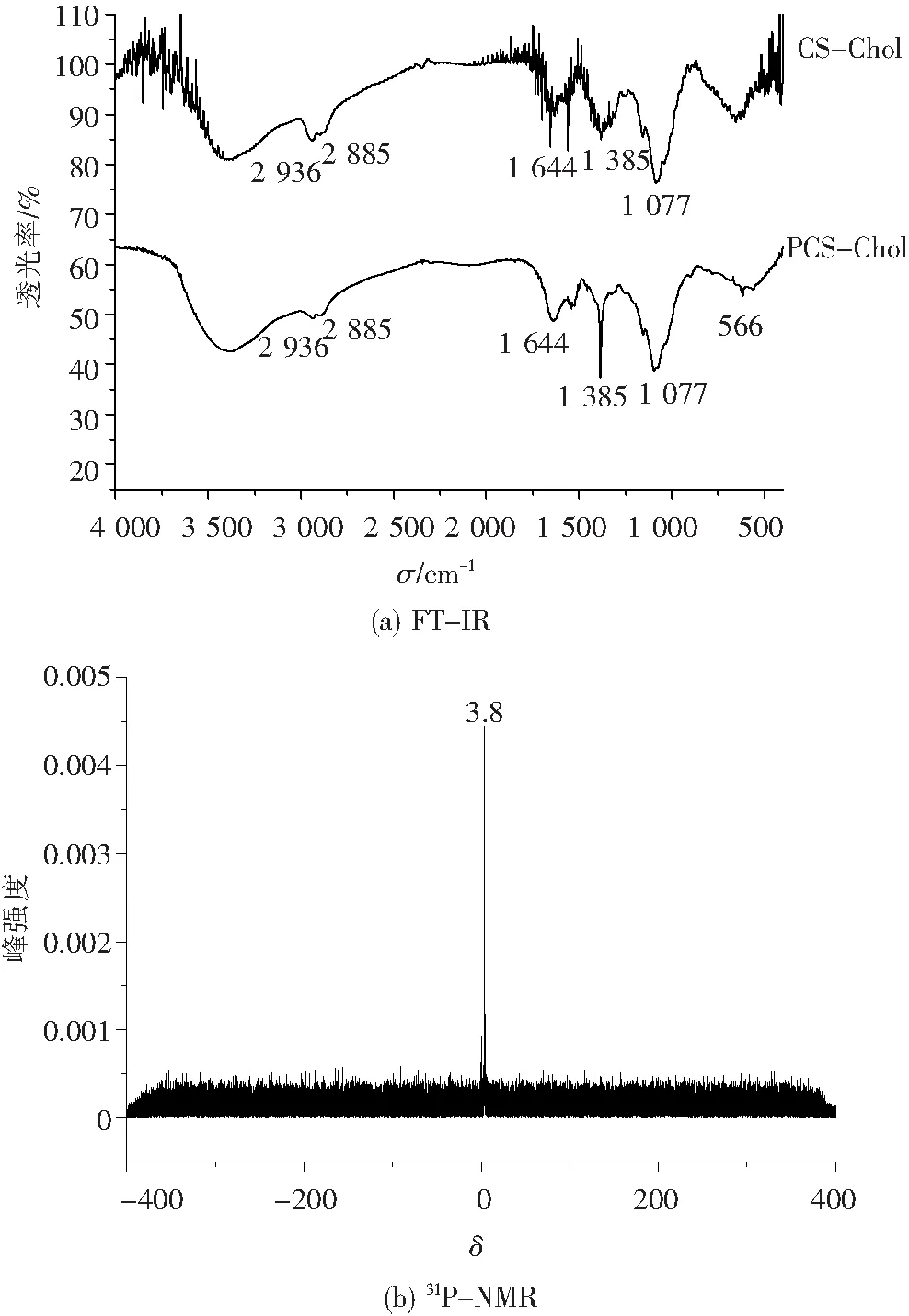
图2 两种聚合物的红外图谱和PCS-Chol的核磁磷谱
Fig.2 FT-IR spectra of two polymers and31P-NMR spectrum
of PCS-Chol
就PCS-Chol而言,在2 936、2 885、1 644、1 077 cm-1等吸收峰同样存在,表明该聚合物基本保留着前一步产物的结构.然而,它在1 385 cm-1处的吸收峰却显著增强了,这可能与引入的磷酸根离子vP=O的振动有关;并且在566 cm-1处也有吸收峰,可能是由P-OH所引起的[14].随后对该化合物进行了31P-NMR(D2O, 400 MHz)检测,结果如图2(b)所示,在δ=3.8处有一个核磁峰,这说明PCS-Chol中含有磷元素.综合上述分析,可判断成功合成出了CS-Chol和PCS-Chol.
经过测定,CS-Chol和PCS-Chol上Chol的取代度分别为(90.9 ± 1.2)%和(82.0 ± 1.1)%,二者相差不大;说明在进行磷酸化反应时,甲磺酸没有显著地改变聚合物中糖链与Chol的比例.经过计算,PCS-Chol上P的取代度为(3.9 ± 0.4)%.据报道,该磷酸化反应主要发生在CS的C-6羟基上[9],其次为C-3位.
3.2 聚合物的特性黏度
经过测定,CS-Chol和PCS-Chol的特性黏度分别为51.8和60.4 mL/g,二者相差不大.
3.3 脂质体的理化性质
3种DOX脂质体的理化性质,包括粒径、PDI、zeta电位、包封率和载药量等结果见表1.
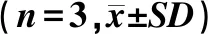
表1 普通阿霉素脂质体(DOX-L)、壳寡糖-阿霉素脂质体(CS-DOX-L)和磷酸壳寡糖-阿霉素脂质体(PCS-DOX-L)的表征
CS-DOX-L和PCS-DOX-L的粒径分别为245.3 ± 2.6 nm和209.5 ± 0.5 nm;而未经修饰的DOX-L的平均粒径为196.4 ± 2.9 nm.这表明采用后插入法修饰脂质体会使粒径增加.未经修饰的DOX-L,zeta电位为-5.59 ± 0.48 mV,而经过修饰之后的CS-DOX-L和PCS-DOX-L,电位则分别为13.67 ± 0.96 mV和6.28 ± 0.08 mV;说明经聚合物修饰后脂质体的电位会发生改变.另外还发现PCS-DOX-L的电位比CS-DOX-L略小.DOX-L、CS-DOX-L和PCS-DOX-L的包封率依次为(92.5 ± 0.9)%、(86.2 ± 5.9)%和(85.4 ± 2.2)%.这说明经过修饰后2种脂质体包封率虽略有下降,但降幅不大.
3.4 脂质体的形态
普通脂质体和PCS-L的外观形态见图3.从图3可以看到2种脂质体呈球形、大小分布比较均匀.普通脂质体(a)的粒径大约为100 nm,而经过聚合物修饰的PCS-L(b),其粒径则大于100 nm.这与DLS测定的结果相符,进一步证明加入聚合物后,脂质体的粒径增加了.
此外,TEM图中脂质体的粒径比DLS的结果偏小.这是由于在TEM的制样过程中,脂质体会失去部分水分,造成脂质体皱缩、粒径减小.
3.5 体外释放
不同DOX制剂在pH值为7.4和5条件下的体外释放结果见图4.
如图4所示,DOX溶液在pH值为7.4和5的2种介质中快速释放,在2 h时便全部释放到溶液中了,与所处溶液的pH无关.相比之下,CS-DOX-L的释放要明显慢于DOX溶液:在pH值为7.4和5的2种介质中48 h的累积释放度分别为(69.1±11.2)%、(89.9±3.0)%;且释放程度与pH值有关,即随着溶液酸性的增加,释放随之加快.PCS-DOX-L的释药过程与CS-DOX-L相似:在pH值为7.4时48 h的累积释放度为(44.8±0.9)%,而在pH值为5的释放度则达到了(80.1±4.5)%,且同样慢于DOX溶液,也体现了缓慢释药和pH敏感的特点.

图3 普通脂质体和PCS脂质体的透射电镜图

图4 不同DOX制剂在pH=7.4和5条件下的体外释放曲线
3.6 细胞毒活性
3种DOX制剂与MG63细胞分别作用24 h和48 h均引起细胞的生存率不断下降,表明它们对该细胞的毒性具有时间和浓度双依赖性的特点(表2).然而,2种脂质体之间并没有一致的趋向性;而且在很多浓度下PCS-DOX-L引起细胞的生存率比CS-DOX-L高(P<0.05),说明该脂质体的毒性稍微减弱了.
3.7 组织分布
在注射不同DiR制剂后,MG63荷瘤裸鼠的活体和离体组织分布结果如图5所示.
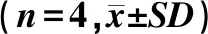
Tab.2 The effects of DOX solution, CS-DOX-L and PCS-DOX-L on the survival rate of MG63 cells at different time points

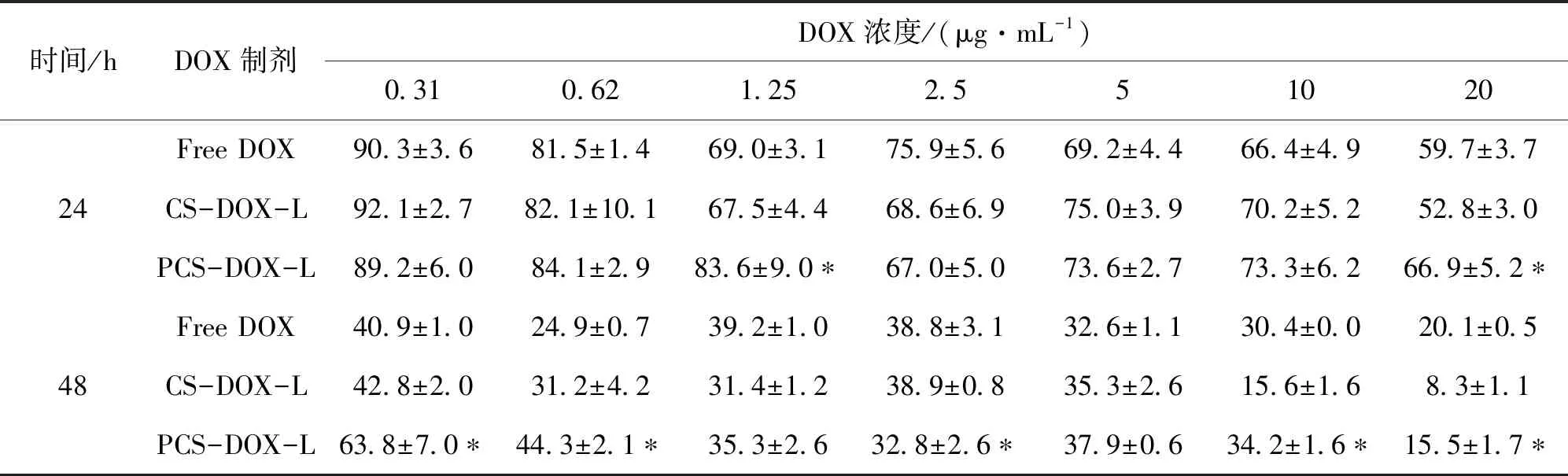
时间/hDOX制剂DOX浓度/(μg·mL-1)0.310.621.252.551020 Free DOX90.3±3.681.5±1.469.0±3.175.9±5.669.2±4.466.4±4.959.7±3.724CS-DOX-L92.1±2.782.1±10.167.5±4.468.6±6.975.0±3.970.2±5.252.8±3.0PCS-DOX-L89.2±6.084.1±2.983.6±9.0∗67.0±5.073.6±2.773.3±6.266.9±5.2∗ Free DOX40.9±1.024.9±0.739.2±1.038.8±3.132.6±1.130.4±0.020.1±0.548CS-DOX-L42.8±2.031.2±4.231.4±1.238.9±0.835.3±2.615.6±1.68.3±1.1PCS-DOX-L63.8±7.0∗44.3±2.1∗35.3±2.632.8±2.6∗37.9±0.634.2±1.6∗15.5±1.7∗
注:与CS-DOX-L比较,*P<0.05.
向小鼠尾静脉分别注射上述4种DiR制剂后的体内分布结果见图5(a).DiR溶液在注射给药5 h时的荧光信号主要分布于肝脏;随着时间推移,在第12 h和24 h时荧光仍然主要分布于该器官.PEG-DiR-L是由PEG修饰的长循环脂质体,其荧光信号也主要分布于肝脏,但在骨上却始终未出现过荧光信号.CS-DiR-L在注射12 h后于鼠右肢的关节处开始出现少量的荧光,但到24 h时信号消失不见了.相比之下,PCS-DiR-L从注射后第5 h至24 h在鼠的右肢上一直有荧光存在;表明PCS脂质体靶向于骨的能力超过了CS脂质体.相比之下,无论是CS-DiR-L还是PCS-DiR-L,在裸鼠左肢的关节处则始终未出现过荧光;这表明2种脂质体均有一定的骨肉瘤靶向性.
荧光信号在各离体组织的分布结果如图5(b)所示.上述4组制剂都在肝脏有最明显的荧光区域,其次在脾.肺部的荧光信号以游离的DiR组最明显.CS-DiR-L在脾脏的荧光信号则比其他制剂更加突出.PCS-DiR-L在鼠右肢处的荧光最明显,与图5(a)结果一致;表明PCS修饰的脂质体确实能进入到癌变的骨组织上,有最强的骨靶向能力.

图5 不同DiR制剂在荷瘤裸鼠(a)和离体组织(b)的分布
4 讨 论
骨肉瘤主要发生在人体的长骨上,恶性程度高、易发生肺转移,临床治疗难度大[15].为了提高治疗的效果,宜采用骨靶向制剂.PCS与HAp有良好的生物相容性,目前已在骨组织工程领域有广泛的应用.本研究首次将PCS应用到药物载体领域,尝试探讨了PCS脂质体在体内对OS的骨靶向能力.
以CS为原料,分2步合成出了PCS-Chol,通过FT-IR和核磁对它的结构进行了确认,对CS-Chol和PCS-Chol上的DSChol、DSP和特性黏度等依次进行了考察.结果表明,它们之间的DSChol相差不大,意味着这2种聚合物对脂质体的修饰效率基本相同.PCS-Chol上接枝了约4%的磷酸基团.CS-Chol和PCS-Chol的特性黏度分别为51.8、60.4 mL/g;二者相差不大,排除了粘性对产生骨靶向作用所带来的显著影响.
依次用逆相蒸发、主动载药和后插入法制备得到了PCS-DOX-L.就目前的工艺而言,制备脂质体的步骤相对简单,所形成脂质体的粒径合适(约200 nm),能保证脂质体通过EPR效应进入肿瘤部位,且包封率较高(85%左右),基本满足静脉注射治疗骨肉瘤的要求.本研究未对处方进行优化,下一步的研究中将进一步探索处方的优化筛选.Chol为脂质体的组成成分,以它为疏水部分有利于顺利完成PCS-Chol对脂质体的修饰.此外,用后插入法可以避免周围环境如电解质的影响,使PCS-DOX-L能更稳定地存在于各种外界环境中[16].
比较2种脂质体发现,PCS-L的电位值小于CS-L.这是由于磷酸根离子在生理条件下会抵消CS-L的一些正电荷,故PCS-L的电位小于CS-L.众所周知CTS会造成溶血,故它的安全性已经引起人们的广泛关注.据报道PCTS在血液中的相容性好,血小板活性弱于CTS[17].本研究在之前的溶血实验也证实PCS-L的血液安全性要好于CS-L.后插入法对PCS-DOX-L修饰前后包封率的影响不大,表明聚合物的Chol部分插入到脂质体后不会显著影响脂质体膜的组成.
纳米制剂的稳定性与电位有关.一般认为纳米粒子zeta电位的绝对值在30 mV以上才能保证粒子的稳定.所制备的PCS-DOX-L的电位偏小,在4 ℃保存时易发生聚集,故稳定性较差.后来将其做成冻干品,很好地解决了稳定性差这一问题.
PCS-DOX-L的释药具有缓释和pH敏感的特点.可能与PCS-Chol能降低脂质体膜的流动性以及在酸性条件下加速从脂质体上游离下来有关[18].脂质体的pH敏感性将有助于药物在体内更好地发挥作用:当脂质体随血液运输时,中性环境会降低DOX从脂质体的释放,避免了药物的过早代谢以及所带来的不良反应;到达肿瘤组织或进入肿瘤细胞时,弱酸性环境则会加速DOX的释放,提高了药物的靶向性以及疗效.
与DOX溶液相似,2种DOX脂质体对MG63细胞的毒性也表现出时间依赖和浓度依赖的特点.本课题组之前证实带有正电荷的CS-DOX-L能依靠静电吸附作用被MG63细胞摄取而发挥抗肿瘤作用[19].相应地,PCS-DOX-L也带有正电荷,同样可以被该细胞摄取而杀伤细胞.然而,某些浓度下PCS-DOX-L的毒性要弱于CS-DOX-L,并且2种脂质体之间的毒性没有体现出一致的趋向性.这可能与PCS-DOX-L所带电荷的数量偏少,与细胞产生静电吸附的能力较差,以及这些脂质体缺乏针对该细胞的靶点有关.本研究主要解决了PCS-DOX-L在体内的骨靶向问题,后续实验可以考虑针对该细胞的靶点进行修饰.尽管如此,动物体内的环境要比体外复杂得多,体内的某些酶,如碱性磷酸酯酶会促进磷酸根离子的水解而可能提高疗效[20].相关的药效学实验还需今后在动物模型上进行评价.
通过小动物活体成像技术定性考察了各种制剂的组织分布情况,结果表明PCS-DiR-L具有较强靶向于骨肉瘤的能力.双磷酸盐是目前常用的骨靶向分子,它通过P-C-P骨架上的磷酸根离子与骨中的HAp发生螯合而产生骨靶向[3].CHANG Q[21]等证明膜材中含有大量磷酸离子的脂质体比相应不含磷酸的脂质体有明显的骨靶向性.因此,推断PCS脂质体上的磷酸基团是发挥骨靶向的关键.当脂质体经过血管的EPR效应到达癌变的骨组织时,磷酸根离子会与HAp的Ca2+发生螯合,从而使脂质体滞留于骨骼上;接着,骨周围的肿瘤细胞依靠静电作用将脂质体摄取;进入细胞后的脂质体不断释放药物发挥药效.正常骨周围的血管无EPR效应,故PCS-DiR-L无法到达并产生荧光.CS-DiR-L同样也能通过EPR效应到达癌变的骨组织,然后借助CS较弱的螯合或粘附作用使脂质体滞留于此并产生信号;然而由于缺乏像磷酸根那样能与HAp产生强螯合作用的基团,因此与骨骼的亲和性相对较弱,荧光持续的时间也不如PCS-DiR-L长[22].DiR溶液和PEG-DiR-L则无法与骨产生亲和作用,故无靶向性.
DiR和DOX之间的理化性质有差异,包载进入脂质体的方式也不尽相同,因此DOX脂质体在动物体内的行为不能完全用DiR脂质体来解释.本研究是用DiR脂质体定性考察了PCS的骨靶向性,下一步本课题组将对PCS-DOX-L在MG63荷瘤小鼠的组织分布情况作深入的研究.
5 结 论
本研究首次将PCS应用到纳米药物载体领域.首先制备出磷酸壳寡糖-胆固醇接枝物(PCS-Chol),修饰得到了磷酸壳寡糖-阿霉素脂质体(PCS-DOX-L).该脂质体的粒径较小,包封率较高,能满足静脉注射和被动靶向治疗骨肉瘤的要求;体外释放具有pH响应和缓释的特性.MTT实验表明该脂质体随时间和浓度的变化能不同程度地抑制MG63细胞的增殖.在荷瘤裸鼠的组织分布实验证实PCS是良好的骨靶向分子,用它修饰脂质体后可以实现对骨肉瘤的靶向递送.

