不同固化液对相分离微球体外性质的影响
赵明玉,王腾腾,薛 鹏,王 磊,梁荣财,
(1.烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心,长效和靶向制剂国家重点实验室,山东 烟台 264005;2.山东绿叶制药有限公司,山东 烟台 264003)
微球是药物与载体材料聚合而成的微粒分散体,缓释微球递送系统不仅能增加药物在生物体内的半衰期、提高生物利用度,而且还能减少患者的给药次数,提高患者的依从性[1].近年来,使用生物可降解材料作为缓释微球载体的数量越来越多[2-3],其中,聚乳酸羟基乙酸共聚物(PLGA)应用最为广泛[4].本研究使用的PLGA 55/45是由课题组人员根据丙交酯(LA)和乙交酯(GA)的开环聚合反应合成的[5].
制备缓释微球常用的方法包括乳化溶剂挥发法、喷雾干燥法以及相分离法[6].本研究中的模型药物醋酸奥曲肽是一种多肽,不仅水溶性较好,而且容易加热失活,所以本研究选用相分离法制备醋酸奥曲肽微球.THOMASIN C等学者对PLA/PLGA相分离的文献进行了总结[7-11],文献多集中于聚合物和硅油性质对相分离阶段凝聚液滴形成的影响[12-14].
本研究的创新点在于固定相分离阶段的条件,只改变固化液组成,对比不同固化液组成对相分离微球体外性质的影响.采用一系列表征方法对微球体外性质进行了研究,如扫描电子显微镜(SEM)观察微球表面和内部形貌,激光粒度仪测定微球粒径,气相色谱法(GC)测定微球内溶剂残留,高效液相色谱法(HPLC)测定微球载药量和体外释放.
1 实验部分
1.1 试剂与仪器
1000 CST硅油(陶氏(张家港)投资有限公司);醋酸奥曲肽(上海苏豪逸明制药公司);二氯甲烷(中国化工试剂公司)和甲醇(中国化工试剂公司);正庚烷(国药集团化学试剂有限公司);油酸乙酯(江西益普生药业有限公司);PLGA 55/45(实验室自制);乙酸乙酯(国药集团化学试剂有限公司);N, N-二甲基甲酰胺(国药集团化学试剂有限公司).
EM-30型扫描电子显微镜(韩国COXEM公司);3000型激光粒度仪(英国Mastersizer公司);1200型高效液相色谱仪(美国Agilent公司);7890B型气相色谱仪(美国Agilent公司).
1.2 微球的制备
称量PLGA 55/45 2 g溶于20 mL二氯甲烷作为有机相,醋酸奥曲肽0.152 g溶于2 mL甲醇作为水相.磁力搅拌下,将水相缓慢注入到有机相中,300 r·min-1搅拌5 min即得均一混合溶液.然后将硅油倒入混合溶液中,调大转速至700 r·min-1并搅拌10 min,将相分离的混合物迅速转移到1 000 mL由不同成分组成的6种固化液(分别编号为Ⅰ—Ⅵ)中,见表1.待微球固化后,经1 000目筛过滤,收集微球.用正庚烷洗去微球表面的硅油,加入20 mL 2%甘露醇水溶液冻干3 d即得.6种固化液形成6批微球(分别编号为A—F).
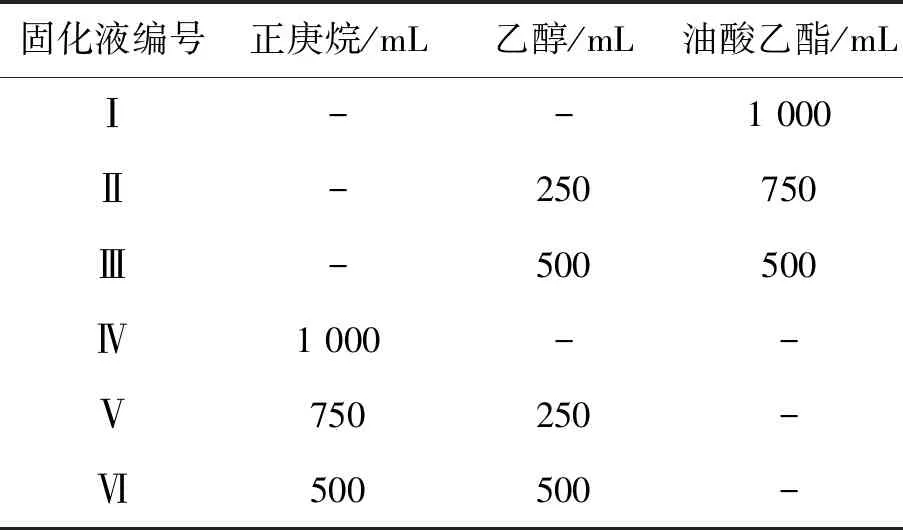
表1 固化液的组成
1.3 扫描电子显微镜(SEM)观察形貌
取适量微球置于培养皿中,加去离子水洗涤微球表面的甘露醇,用滤纸过滤微球并晾干.晾干后在培养皿中加入液氮没过微球,在液氮完全挥发之前,用刀片迅速切割微球.将双面导电胶带粘附于铝板上,取适量干燥的微球均匀涂布在导电胶带上,喷金后进行扫描电子显微镜观察.
1.4 粒径的测定
采用激光粒度仪测定微粒的粒径.为使微球分散更加均匀,使用0.1%吐温20溶液作为分散介质.
1.5 载药量的测定
称取醋酸奥曲肽微球约25 mg,加入冰醋酸2 mL,超声处理10 min,使PLGA充分溶解,1.3×104r·min-1离心10 min,取上清液作为样品溶液,采用HPLC法测定醋酸奥曲肽的药物浓度,实际载药量计算如下:
实际载药量=(微球中实际药物含量/微球总质量)×100%.
1.6 残留溶剂的测定
称取醋酸奥曲肽微球约20 mg,加入0.05% N, N-二甲基甲酰胺-乙酸乙酯溶液1 mL,静置1 h,使PLGA充分溶解后,采用气相色谱法(GC)直接进样测定醋酸奥曲肽微球中的有机溶剂残留.
1.7 体外加速释放测定
由于缓释微球中药物释放的时间超过几个星期甚至几个月,所以37 ℃体外释放试验的质量控制条件变得不适用.本研究采用加速释放法,即温度较高(45 ℃)的5%甲醇溶液作为释放介质.称取醋酸奥曲肽微球约30 mg置于样品管中,加入5%甲醇溶液5 mL,样品管置于45 ℃水域恒温摇床中,50 r·min-1振摇,分别在1 h, 4 h, 1 d, 3 d, 5 d, 7 d, 8 d, 9 d, 10 d, 12 d, 14 d取出样品管, 3.6×103r·min-1离心10 min,取出4 mL上清液加入到液相小瓶中,再往样品管中加入新鲜释放介质4 mL,采用HPLC法测定上清液中的药物含量.
2 结果和讨论
2.1 表面及内部形貌
扫描电子显微镜观察微球表面形貌及内部形貌分别见图1、图2.
由图1可见,所有处方的微球均为圆形且表面不光滑.由图2可见,微球内部空隙分布不均匀,尤其是可以观察到各处方的微球边缘都有不同厚度的壳层,而且随着乙醇含量的增加,内部空隙明显增多,这可能与乙醇能增加二氯甲烷萃取速度有关.另外,当乙醇含量相同时,油酸乙酯体系形成的微球内部空隙少于正庚烷体系形成的微球内部空隙.
2.2 粒径
相之间的相互作用和粘度会对粒径产生影响[3].固定相分离条件,考察不同固化液对微球粒径的影响,结果见表2.

表2 粒径与载药量

图1 扫描电子显微镜观察微球表面形貌

图2 扫描电子显微镜观察微球内部形貌
结果表明,不同固化液条件下制备的微球粒径D(0.5)在35~55 μm.一方面,随着乙醇含量的增加,2种体系形成微球粒径均增加;另一方面,乙醇含量相同的条件下,正庚烷体系形成的微球粒径小于油酸乙酯体系形成的微球粒径.推测其原因为乙醇的加入会促进软球的融合速度,从而导致粒径变大.
2.3 载药量
通过HPLC法测定醋酸奥曲肽微球的载药量(表2),发现2个不同的体系均随着乙醇含量的增加,微球的载药量降低;油酸乙酯体系中形成的微球载药量高于正庚烷体系形成的微球载药量.分析主要原因为醋酸奥曲肽能溶解在乙醇中,所以当有乙醇存在时,能使吸附于微球表面的醋酸奥曲肽部分溶解,导致载药量降低;油酸乙酯的粘度高于正庚烷,影响了乙醇的洗涤效果.
2.4 溶剂残留
选取甲醇、二氯甲烷、乙醇和正庚烷为考察因素,测定各因素在微球中的残留量,结果见表3.
表3缓释微球的残留溶剂量
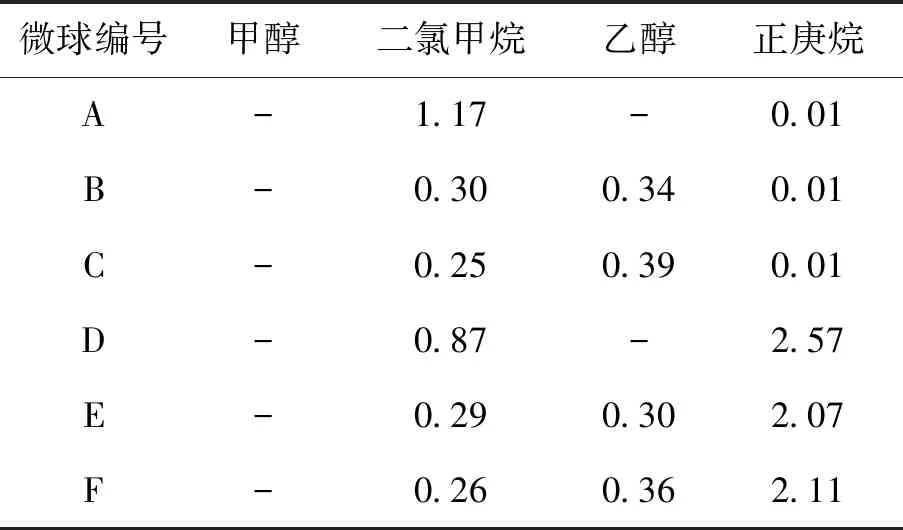
Tab.3 Residual solvent content of sustained-release micro-spheres %
甲醇在微球形成过程中能很好地扩散,所以均没有残留;随着乙醇比例的增加,二氯甲烷的含量明显降低,表明乙醇对二氯甲烷的萃取来说具有促进作用;微球中乙醇的残留可能与体系的粘度有关,粘度增大不利于乙醇的扩散;正庚烷的残留主要是在微球固化时渗入到微球内部造成,且乙醇对正庚烷的萃取作用不大.
2.5 体外加速释放
一般来说,PLGA微球中药物的释放大体可分为三相:“突释”,平台期以及快速释放.由图3可见,与正庚烷体系相比,油酸乙酯体系形成的微球前期释放较快.这是由于油酸乙酯粘度大导致二氯甲烷迁移慢,微球固化偏慢造成的.此外,乙醇的加入可以明显降低药物的突释.
3 结 论
本研究对比了油酸乙酯和正庚烷2种体系的固化液对相分离微球体外性质的影响,结论如下:
(1)2种体系的固化液均能形成形状良好的微球,微球表面不光滑且内部空隙分布不均匀.
(2)微球粒径在35~55 μm之间,是由多种因素的相互作用导致的,固化液组成不占主导作用.
(3)固化液中的乙醇能溶解部分醋酸奥曲肽,当乙醇含量增加时,微球载药量降低.
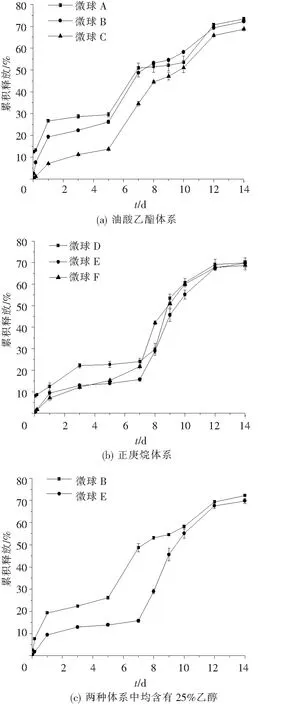
图3 体外加速释放曲线(n=3)
(4)甲醇作为醋酸奥曲肽的溶剂,在微球中没有残留;乙醇作为二氯甲烷的良溶剂,能有效地降低二氯甲烷的含量,但乙醇的残留会增加;正庚烷在微球固化瞬间深入到微球内部,很难除去.
(5)2种体系形成的微球体外释放均遵循“三相释放”理论.油酸乙酯体系形成的微球较正庚烷体系形成的微球前期释放较快且乙醇能有效降低药物的突释.

