苦荞麦总黄酮对2型糖尿病大鼠胰岛素信号转导通路中GSK-3β、AKt相关基因与蛋白表达的影响
辽宁中医药大学,辽宁 沈阳 110032
糖尿病(Diabetes Mellitus,DM)是一种发病率极高的代谢性疾病,已严重影响人类生活。据国际糖尿病联盟(the International Diabetes Federation,IDF)发布的第八版全球糖尿病地图数据显示,2017年全球共有4.25亿糖尿病患者,其中中国患病人数最多[1],90%~95%为2型糖尿病(Type 2 diabetes mellitus,T2DM)[2]。T2DM的病理机制与胰岛β细胞功能失常和胰岛素抵抗关系十分密切,其在环境、遗传等因素的影响下通常表现为胰岛素抵抗(Insulin Resistance,IR)[3]。糖原合成激酶-3β(Glycogen synthase kinase 3β,GSK-3β)是胰岛素受体信号转导通路中一个关键节点,它在细胞中过度表达会引起胰岛素信号转导受阻,引起IR[4-7],有实验表明抑制GSK-3β活性可改善小鼠的糖耐量水平,使肝糖原代谢增加进而增加肝糖原含量[8]。在胰岛素信号转导通路中,激活的蛋白激酶B(Protein kinase B,AKT)可使GSK-3β磷酸化从而失活达到降血糖的目的。因此,促进Akt表达从而抑制GSK-3β可以减轻胰岛素抵抗,改善糖耐量水平,产生潜在的抗糖尿病效果[9]。
苦荞麦作为一种药食两用的植物,在国内外被广泛种植[10]。其黄酮类化合物在医药保健方面具有降血糖、降血脂、降血压、抗氧化、抗肿瘤、增强免疫力及保护心脑血管等多种功效[11-12]。研究通过观察苦荞麦总黄酮对Ⅱ型糖尿病胰岛素信号转导通路中GSK-3β和Akt基因与蛋白的表达情况的影响,测定各组大鼠肝组织中mRNA与蛋白含量,探讨苦荞麦总黄酮对Ⅱ型糖尿病影响的作用与机制。
1 实验材料
1.1 动物与饲料 SPF级wistar大鼠78只,雄性,许可证号SCXK(辽)2015-0001 辽宁长生生物技术有限公司。高脂饲料和普通饲料(沈阳市于洪区前民动物实验饲料厂);猪油和蔗糖(沈阳市和平区金味源食品批发部)。
1.2 药品与试剂 苦荞麦总黄酮(日本三益制药株式会社,含量为991.65 mg/g);二甲双胍(批号:20150617,沈阳维康医药连锁有限公司);链脲佐菌素(批号:1122F032,solarbio);胰岛素ELISA试剂盒;氯仿、异丙醇、无水乙醇(20150607)国药集团化学试剂有限公司;RT-PCR试剂盒(AK5701),核酸Marker(A801A),上、下游引物(CHPA194);SDS-PAGE凝胶制备试剂盒(批号:20151222,Solarbio);NC膜(批号:T426062,Pall);TBS缓冲剂(批号:60900120)、蛋白ladder(批号:69J00157)购自北京鼎国公司;SDS-PAGE电泳粉(批号:20161111)、BCA蛋白含量检测试剂盒(批号:20160629)购自凯基生物;蛋白提取试剂盒(批号:20160622),GSK-3β(批号:0003)、Akt(批号:0020)、GAPDH(批号:0010)均为CST公司;HRP标记抗兔二抗(批号:0026,CST公司)。
1.3 仪器 ACCU-CHEK血糖仪(罗氏诊断产品有限公司);ACCU-CHEK血糖试纸(罗氏诊断产品有限公司);iMark酶标仪(美国BD);JD500-3电子天平(沈阳龙腾电子有限公司);DW-HL388超低温冰箱(中科美菱低温科技有限责任公司);HR/T20M台式高速冷冻离心机(湖南赫西仪器装备有限公司);HE-90水平电泳槽、VE-180垂直电泳槽均为上海天能科技有限公司;S1000 Thermal Cycler梯度PCR仪(BIO-RAD);Chemi XR5凝胶成像分析仪;化学发光仪。
2 方法
2.1 试剂配制
2.1.1 链脲佐菌素(STZ)注射液 将柠檬酸(2.585 g)、柠檬酸三钠(2.265 g)用150 mL三蒸水溶解,用HCL调pH至4.2后用三蒸水定容至200 mL,4℃储存。使用时加STZ配成浓度为2%STZ溶液,注意用滤膜除菌。
2.1.2 Western blot缓冲液的配制
2.1.2.1 TBS存储液 粉剂常温存放,使用时直接用纯水稀释成1 L的存储液。
2.1.2.2 TBST洗液 由1L TBS存储液加入0.5 mL吐温混匀制成。
2.1.2.3 转膜液 配转膜液由粉剂在配液时加热,并用纯水定容至800 mL,再加200 mL甲醇混匀而成。
2.1.2.4 封闭液 封闭液浓度为5%,即用5 g奶粉加100 mL纯水制成。
2.2 动物模型建立 雄性wistar大鼠于动物实验中心适应性喂养(猪油及蔗糖)3 d后,随机分为两组:对照组(普通饲料)7只,高脂饲料组(高脂饲料)71只(分笼饲养,每笼7只),喂养8周。喂养8周后,高脂饲料组按体质量筛选出成为食源性肥胖的大鼠(标准:高脂饲料组个体质量≥对照组个体质量均值+2倍标准差)后,继续喂养4周。空腹状态下用氧化酶法测定各组大鼠血糖;同时眶静脉取血,用ELISA法检测胰岛素水平。计算胰岛素敏感指数(ISI)=1/(FINSxFBG)(FINS为空腹胰岛素,FPG为空腹血糖)。将对照组与高脂饲料组进行对照,筛选建立高脂饲料组大鼠胰岛素抵抗模型。建模后对高脂饲料组大鼠进行连续2周腹腔注射链脲佐菌素,剂量为25 mg/kg·周。再次测量空腹血糖,以空腹血糖>11.1 mmol/L视为造糖尿病模型造模成功[13-14]。
2.3 动物分组 除对照组外,将糖尿病造模成功大鼠随机分5组,分别为模型组7只;4个用药组分别为苦荞麦总黄酮低剂量组7只(用药量50 mg/kg);苦荞麦总黄酮中剂量组7只(用药量100 mg/kg);苦荞麦总黄酮高剂量组7只(用药量200 mg/kg);西药组7只(二甲双胍100 mg/kg)。灌胃给药4周后,再次眶静脉取血后处死各组大鼠,提取肝组织。
2.4 指标测定及方法 给予高脂饲料8周后测量大鼠体重;给予大鼠注射STZ前,用ELISA法和氧化酶法分别测量大鼠的胰岛素和血糖水平,并计算胰岛素抵抗指数。具体方法:准备96孔加样板,试剂盒室温平衡30 min后,将样品和标准品、生物素标记二抗和酶标试剂,置于37℃水浴中反应60 min;洗板5次,加入试剂盒中显色液A 50 μL和B 50 μL,37℃水浴中反应10 min;加入终止液50 μL后于10 min内放入酶标仪450 nm波长下读取OD值并计算;给予注射STZ 2周后用ELISA法测胰岛素水平和血糖水平,并计算胰岛素抵抗指数。方法同前。
2.4.1 RT-PCR法检测大鼠肝组织中GSK-3β、Akt的mRNA表达情况
2.4.1.1 分离RNA 于冰盘上取100 mg大鼠肝组织,用预冷生理盐水冲洗后剪碎,放入匀浆器内,加入1 mL Trizol试剂匀浆裂解细胞。静止5 min后,转移裂解液到EP管中,加入0.2 mL氯仿,剧烈摇动混匀。4℃静置5 min后、12 000 rpm离心15 min。用移液器将水相转移到新管中,加入等体积异丙醇混匀,静置10 min。再次4℃、12 000 rpm离心10 min。去上清,加入1 mL 75%乙醇混匀,静置5 min。第3次4℃、1 2000 rpm离心5 min。分离出RNA,倒掉乙醇,静置5 min后加入30 μL DEPC水溶解,得到RNA溶液。取12 μL RNA溶液,加入 DEPC 水稀释,用酶标仪测定260 nm 和280 nm的吸光度,并计算RNA的浓度和纯度。
2.4.1.2 反转录出mRNA 按TAKARA试剂盒说明书要求配制10 μL反转录体系,于PCR仪中42~60℃条件下放置15~30 min,95℃条件下5 min,5℃条件下5 min;再配制PCR反应液40 μL,把此反应液加入到反转录反应结束的PCR反应管中,轻轻混匀,离心约10 s,进行PCR反应:94℃进行30sec,55~65℃进行30sec,上述两步骤重复30Cycles,然后72℃进行50sec。准备上样。在上述RT-PCR过程中用到的上、下游引物及合成序列长度如下:GSK-3β的上游引物序列为5′-TCGTCCATCGATGTGTGGTC-3′,下游引物序列为5′-TTGTCCAGGGGTGAGCTTTG-3′,合成长度为202bp,退火温度为60℃;Akt的上游引物序列为5′- AGAGAGCCGAGTCCTACAGAATA-3′,下游引物序列为5′-CCGAGAGAGGTGGAAAAACA-3′,合成长度为133bp,退火温度为61℃;GAPDH的上游引物序列为5′-ACCACAGTCCATGCCATCAC-3′,下游引物序列为5′-TCCACCACCCTGTTGCTGTA-3′,合成长度为500bp,退火温度为60℃。
2.4.1.3 凝胶成像 制备1.5%琼脂糖凝胶,放入电泳槽中。取5 μL样本和1 μL上样缓冲液,混合成6 μL上样液。琼脂糖凝胶上样后接通电源,110 V,约1 h。放入凝胶成像系统拍照并分析条带。
2.4.2 Western-blot法测定大鼠肝组织中GSK-3β、AKT的蛋白表达情况
2.4.2.1 蛋白样品制备 取100 mg肝组织,于冰上在EP管内剪碎,加入裂解液,用超声破碎仪充分匀浆裂解。将匀浆裂解液在离心机中4℃、14 000 rpm离心10 min;将上清液转移至新的冰上预冷的1.5 mL EP管中,得到全蛋白提取物,可以进行蛋白定量。
2.4.2.2 BCA法测定蛋白含量 按说明书将蛋白样本稀释。试剂A:试剂B(50∶1)配制,计算样本浓度。使每孔上样蛋白量达40 μg,混匀后置沸水浴5 min。10 000 rpm转1 min后直接取上清液上蛋白样本。
2.4.2.3 电泳 配10%分离胶。配5%浓缩胶,胶液加入TEMED后立即摇匀即可灌胶,然后将梳子水平插入,4℃静置2h。将其放入电泳槽中,分别加入样本和ladder。电泳时样本在浓缩胶时恒压80V,在分离胶时恒压120V。取胶,将胶放置在含有转膜液的托盘内。
2.4.2.4 转膜 在冰盆中湿转,1L湿转液。将夹子放入转膜槽中。恒压100V,78 min定时。
2.4.2.5 封闭 根据目的蛋白分子量将膜剪成细条放入封闭盒内,加5%的封闭液,放入水浴箱内,37℃,缓慢振荡1.5h。倒掉封闭液,TBST于摇床上洗3次,每次3 min。
2.4.2.6 抗体孵育与免疫反应 一抗滴加于膜上,室温下轻摇孵育1h后4℃静置过夜;膜用TBST洗3次,每次10 min于摇床上;加入稀释二抗后放于37℃水浴中1 h;TBST洗3次,每次10 min。
2.4.2.7 化学发光 将发光液试剂盒按比例于EP管中混匀,滴加于膜上,放入发光仪进行曝光并拍照。

3 结果
3.1 饲养8周后各组大鼠体重的变化 各高脂饲料组与对照组相比较,大鼠体重明显增加(P<0.05),成功筛选出食源性肥胖大鼠。见表1。

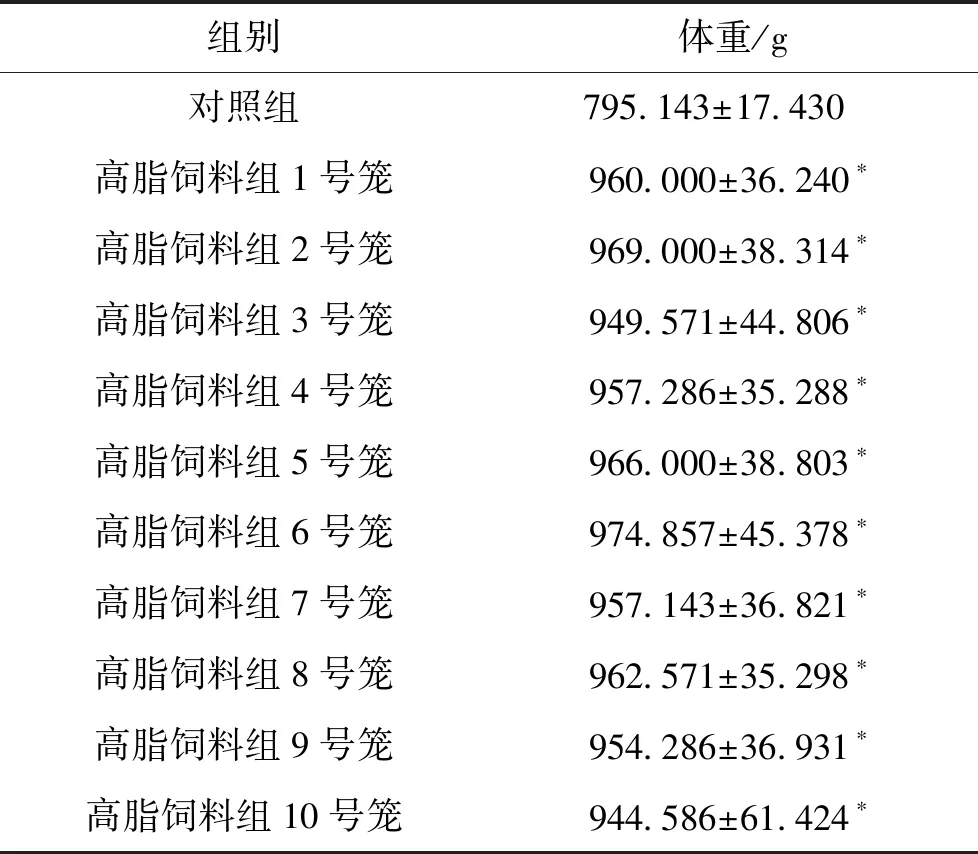
组别体重/g对照组795.143±17.430 高脂饲料组1号笼960.000±36.240∗高脂饲料组2号笼969.000±38.314∗高脂饲料组3号笼949.571±44.806∗高脂饲料组4号笼957.286±35.288∗高脂饲料组5号笼966.000±38.803∗高脂饲料组6号笼974.857±45.378∗高脂饲料组7号笼957.143±36.821∗高脂饲料组8号笼962.571±35.298∗高脂饲料组9号笼954.286±36.931∗高脂饲料组10号笼944.586±61.424∗
注:与对照组比较,*P<0.05。
3.2 饲养12周后各组大鼠胰岛素敏感指数的变化 各高脂饲料组与对照组相比较,大鼠胰岛素敏感指数明显下降(P<0.05)。见表2。
3.3 饲养12周后各组大鼠血液中胰岛素水平的变化 各组间经两两比较,血液中胰岛素水平差异无统计学意义(P<0.05)。见表3。


组别胰岛素敏感指数对照组0.0185±0.00614 高脂饲料组1号笼0.0101±0.00412∗高脂饲料组2号笼0.0097±0.00407∗高脂饲料组3号笼0.0125±0.00557∗高脂饲料组4号笼0.0121±0.00498∗高脂饲料组5号笼0.0117±0.00450∗高脂饲料组6号笼0.0112±0.00369∗高脂饲料组7号笼0.0109±0.00352∗高脂饲料组8号笼0.0105±0.00380∗高脂饲料组9号笼0.0103±0.00403∗高脂饲料组10号笼0.0101±0.00407∗
注:与对照组比较,*P<0.05。

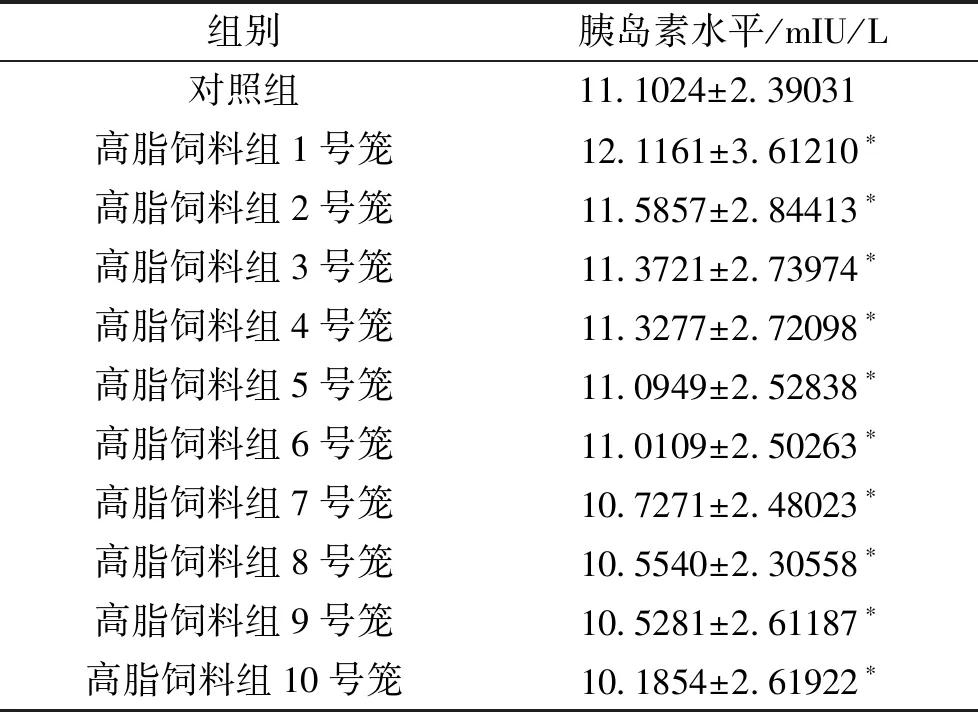
组别胰岛素水平/mIU/L对照组11.1024±2.39031 高脂饲料组1号笼12.1161±3.61210∗高脂饲料组2号笼11.5857±2.84413∗高脂饲料组3号笼11.3721±2.73974∗高脂饲料组4号笼11.3277±2.72098∗高脂饲料组5号笼11.0949±2.52838∗高脂饲料组6号笼11.0109±2.50263∗高脂饲料组7号笼10.7271±2.48023∗高脂饲料组8号笼10.5540±2.30558∗高脂饲料组9号笼10.5281±2.61187∗高脂饲料组10号笼10.1854±2.61922∗
注:与对照组比较,*P<0.05。
3.4 给予药物干预后各组大鼠血糖水平的变化 模型组与对照组相比较,大鼠血糖水平明显提高(P<0.05);苦荞麦总黄酮低、中、高剂量组、西药组与模型组相比较,大鼠血糖水平明显下降(P<0.05),其中苦荞麦中剂量组与西药组降血糖效果较好。见表4。


组别血糖水平/mmol/L对照组4.286±0.302模型组28.957±0.439∗苦荞麦总黄酮低剂量组19.343±0.458#苦荞麦总黄酮中剂量组5.929±0.431#苦荞麦总黄酮高剂量组8.857±0.355#西药组4.871±0.263#
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
3.5 给予药物干预后各组大鼠血液中胰岛素水平的变化 模型组与对照组相比较,大鼠胰岛素水平明显下降(P<0.05);苦荞麦总黄酮低、中剂量组、西药组与模型组相比较,大鼠胰岛素水平明显提高(P<0.05),其中苦荞麦中剂量组、西药组与对照组胰岛素水平相近。见表5。


组别胰岛素水平/mIU/L对照组11.809±1.300模型组9.108±0.775∗苦荞麦总黄酮低剂量组12.555±1.051#苦荞麦总黄酮中剂量组11.117±1.360#苦荞麦总黄酮高剂量组10.117±0.856西药组11.071±0.6712#
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
3.6 给予药物干预后各组大鼠胰岛素敏感指数的变化 模型组与对照组相比较,大鼠胰岛素敏感指数明显下降(P<0.05);苦荞麦总黄酮中、高剂量组、西药组与模型组相比较,大鼠胰岛素敏感指数明显提高(P<0.05),其中苦荞麦中剂量组与西药组大鼠胰岛素敏感指数与对照组相近。见表6。

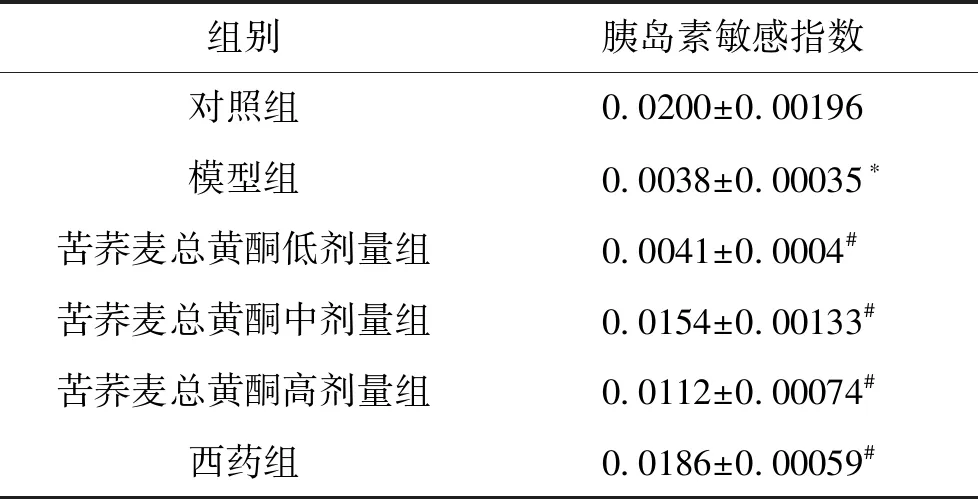
组别胰岛素敏感指数对照组0.0200±0.00196模型组0.0038±0.00035∗苦荞麦总黄酮低剂量组0.0041±0.0004#苦荞麦总黄酮中剂量组0.0154±0.00133#苦荞麦总黄酮高剂量组0.0112±0.00074#西药组0.0186±0.00059#
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
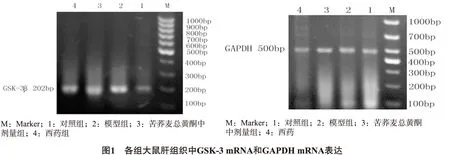
3.7 各组大鼠肝组织中GSK-3β mRNA的相对表达情况 与对照组相比较,模型组组织中GSK-3β mRNA的表达明显提高(P<0.05);苦荞麦总黄酮中剂量组、西药组和模型组相比较,GSK-3βmRNA的表达明显下降(P<0.05)。如图1所示,见表7。
3.8 各组大鼠肝组织中Akt mRNA的相对表达情况 与对照组相比较,模型组组织中Akt mRNA 的表达明显减少(P<0.05);苦荞麦总黄酮中剂量组、西药组和模型组相比较,Akt mRNA 的表达明显增加(P<0.05)。如图2所示,见表8。



组别GSK-3β与GAPDH mRNA表达光密度比值对照组0.1727±0.01469模型组0.9228±0.05824∗苦荞麦总黄酮中剂量组0.8230±0.05311#西药组0.5227±0.04111#
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。


组别Akt与GAPDH mRNA表达光密度比值对照组0.1567±0.01250模型组0.0631±0.00783∗苦荞麦总黄酮中剂量组0.1426±0.00948#西药组0.0858±0.00781#
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
3.9 各组大鼠肝组织中GSK-3β蛋白的相对表达情况 模型组与对照组相比较,组织中GSK-3β蛋白的表达明显增加(P<0.05);苦荞麦总黄酮中剂量组、西药组与模型组相比较,GSK-3β蛋白的表达明显减少(P<0.05)。如图3所示,见表9。
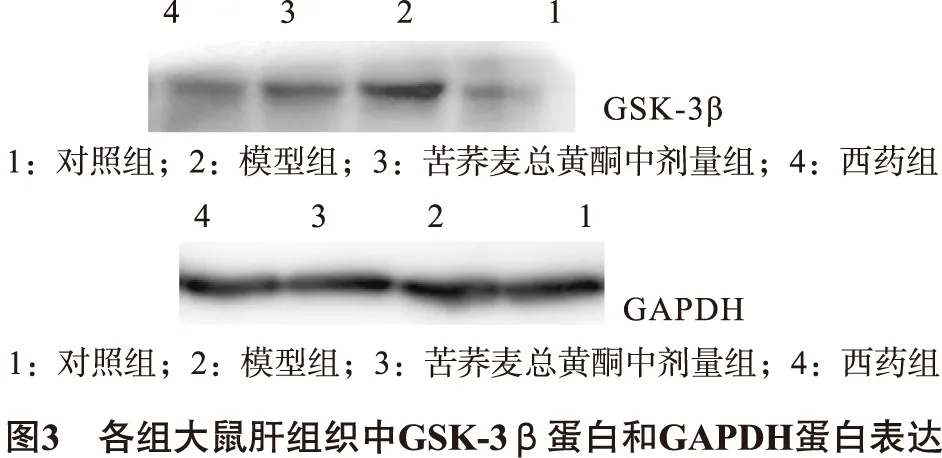


组别GSK-3β与GAPDH 蛋白表达光密度比值对照组0.8125±0.03744模型组1.6740±0.09700∗苦荞麦总黄酮中剂量组1.2623±0.44680#西药组1.0719±0.45873#
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
3.10 各组大鼠肝组织中AKT蛋白的相对表达情况 模型组与对照组相比较,组织中AKT蛋白的表达减少有统计学差异(P<0.05);苦荞麦总黄酮中剂量组、西药组与模型组相比较,AKT蛋白的表达增加有统计学差异(P<0.05)。如图4所示,见表10。



组别AKT与GAPDH 蛋白表达光密度比值对照组0.8982±0.02700模型组0.1420±0.00350∗苦荞麦总黄酮中剂量组0.7582±0.02462#西药组0.4475±0.01009#
注:与对照组比较,#P<0.05;与模型组比较,*P<0.05。
4 讨论
本实验结果表明,苦荞麦总黄酮低、中、高3个剂量组中,中剂量组效果最好。和模型组相比较,苦荞麦总黄酮中剂量组与西药组在控制T2DM大鼠血糖方面效果显著,可明显提高T2DM大鼠胰岛素水平,提高其胰岛素敏感指数。证明苦荞麦总黄酮对T2DM大鼠的病情有积极影响,其机制与苦荞麦总黄酮能使胰岛素转导通路中GSK-3βmRNA和蛋白表达减少、Akt mRNA和蛋白表达增加有关。
研究表明,多数T2DM患者存在IR[15],降低IR是治疗T2DM的关键[16],IR与胰岛素作用调节通路有关[17]。胰岛素信号转导通路中激活的Akt使 GSK-3β磷酸化而失活[18],阻止GSK-3β对其底物糖原合成酶的磷酸化作用,糖原合成酶去磷酸化后恢复活性,发挥糖原合成作用,减少细胞中葡萄糖浓度。并且GSK-3β影响糖原合成酶活性不受胰岛素浓度影响[19]。同时有实验表明使用高选择性抑制剂抑制GSK-3β 活性可增加葡萄糖的转运从而提高胰岛素的活性[20],减少IR,进而达到降血糖作用。
因此,可以肯定激活Akt基因与蛋白表达、抑制GSK-3β基因与蛋白表达对降低T2DM大鼠血糖水平,升高胰岛素敏感指数及改善胰岛素抵抗有一定效果。苦荞麦总黄酮通过影响胰岛素信号转导通路中GSK-3β与Akt两个基因与蛋白的表达影响T2DM大鼠。
本实验通过选择使用链脲佐菌素(STZ)选择性破坏动物胰岛β细胞从而导致糖尿病[21-22],目前国内广泛采用高脂高糖饮食联合注射小剂量STZ建立T2DM模型,该模型具有高血糖、胰岛素抵抗等特点,与人类糖尿病发病过程和发病机理相似[23]。苦荞麦作为一种药食同源的植物,在改善T2DM的血糖水平,胰岛素抵抗方面,有一定的开发潜力。

