过量表达OsYUC2转基因水稻幼苗对干旱和H2O2胁迫的生长生理应答
(山东理工大学生命科学学院,山东 淄博 255049)
生长素信号是调节植物生长发育的重要途径之一,它是细胞分裂、生长、分化、向性应答和器官发育所必需的。生长素合成是调控植物生长不可缺少的过程,YUCCAs(YUCs)基因家族是依赖于色氨酸IAA合成途径中的限速酶。拟南芥YUC基因家族不同成员的时空表达方式存在差异[1],利用组合缺失突变体研究表明,YUCs不仅在幼苗生长、花发育及维管的形成等众多发育过程中发挥重要作用而且能增强植物的抗旱能力[2]。水稻基因组有14个成员(YUC1-14)[3-5],研究发现,OsYUC1基因在水稻根系和植株发育过程中有重要调节作用。COW1基因编码一个新的YUC蛋白成员,该基因调节根/冠比和叶发育并维持水分平衡,突变体cow1侧根数目减少[6]。NAL7编码OsYUC 8蛋白,过量表达NAL7cDNA导致生长素产生过量,引起根过度生长和形态异常[4]。这些研究结果表明,OsYOsUCs基因在调节水稻根系生长发育过程中起重要作用,但不同成员的作用存在差异。
环境信号与生长素信号通过交互作用控制植物的生长。如干旱、重金属和盐等逆境因子诱导活性氧(ROS)过量积累,引发拟南芥根系生长素的重新分布,进而影响其形成和发育[7-10]。研究表明,ROS和重金属等通过调节生长素信号途径上关键基因家族如OsYUCs的表达而影响水稻根系的生长[11-14]。
OsYUC2基因是水稻生长素合成基因家族OsYUCs的重要成员之一。前期研究显示,OsYUC2的表达有显著的发育时期和组织器官特异性,即在细胞分裂旺盛的幼嫩组织和器官中表达高。过量表达OsYUC2增加了生长素的含量,促进了水稻植株特别是根系的生长发育,但是该基因是否与水稻抗逆有关还不清楚。本实验旨在分析干旱和H2O2胁迫对OsYUC2过量表达转基因水稻幼苗生长生理的影响,为更好的了解OsYUC2基因与植物抗逆之间的关系提供参考。
1 材料与方法
1.1 实验材料与处理
挑选籽粒饱满的野生型水稻(日本晴,WT)和PUbi-OsYUC2-GUS转基因水稻(G 3株系)种子,去壳后消毒:75%乙醇(30 s)、0.1%氯化汞(15 min)、2%次氯酸钠(20 min),用无菌水冲洗干净,再将种子植入MS培养基上,放入培养箱(光周期为14 h光照,光照强度为200μmol·(m2·s)-1,温度26 ℃,夜间10 h,温度22 ℃;相对湿度为50%~60%)内培养8 d。然后转到Hoagland营养液使其适应24 h,再分别用10% PEG-6000、15% PEG-6000分别处理24 h,到终浓度20% PEG-6000处理72 h,或者分别用0.000 6% H2O2、0.006% H2O2各处理24 h,到终浓度0.06% H2O2处理72 h后进行生理和生化指标测定。每天更换1次培养液,每种处理重复3次,每次至少3个重复,每个重复约50株。
1.2 生长指标统计
株高、初生根和不定根长度用尺子测量,侧根数量和长度在解剖镜下统计,每个处理至少用60株幼苗,数据用每株的平均值表示。
1.3 H2O2的定性和定位测定
利用DAB染色法对根尖H2O2进行定性和定位分析[15],每种处理每次重复至少用20株染色。
1.4 MDA含量测定
用硫代巴比妥酸(TBA)法[16]测定丙二醛(Malon dialdehyde MDA)含量。
1.5 相对含水量测定
相对含水量(%)=[(鲜重-干重)/(吸胀重-干重)]×100%。
1.6 根系GUS活性分析
野生型水稻(日本晴,WT)、DR5-GUS和PUbi-OsYUC2-GUS转基因水稻(G 3株系)经上述(1.1)同样培养和处理,取根系进行GUS染色[17]。每个处理至少重复3次,每次重复至少用20株进行GUS染色。
1.7 数据处理
用SPSS软件对实验数据进行处理,实验结果用3次独立重复的平均值和标准误差来表示。利用单因子方差分析各种处理与对照之间以及WT与G 3转基因株系之间的差异,p<0.05代表差异显著。
2 结果与分析
2.1 过量表达OsYUC2转基因水稻幼苗对干旱和H2O2胁迫的生长应答
1)PEG和H2O2处理对过量表达OsYUC2转化苗株高的影响。
非胁迫条件下G 3的株高显著大于WT的(p<0.05)。与对照组比,PEG和H2O2处理都抑制了G 3和WT地上部分的生长(p<0.05),但是G 3的株高仍然显著大于WT的(p<0.05,图1 A)。
2)PEG和H2O2胁迫对OsYUC2转化苗初生根及其侧根生长的影响。
由图1 B可见,对照组和处理组G 3与WT的初生根长度差异不显著(p>0.05,)。与对照组比,PEG处理显著促进了WT初生根上侧根的形成(p<0.05),但G 3的变化不明显(图2 A);H2O2对G 3和WT初生根上的侧根形成都有显著的抑制作用(p<0.05)。图2 B显示,与对照组比,PEG和H2O2处理条件下G 3和WT初生根上侧根的伸长生长都受到抑制,但G 3的侧根长度仍然显著大于WT的(p<0.05)。
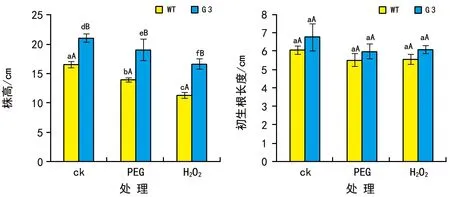
注:小写字母表示对照组与处理在p<0.05水平差异显著;大写字母表示相同条件下WT和G 3之间在p<0.05水平差异显著。下同。图1 PEG和H2O2处理对WT和G 3转基因水稻幼苗株高和初生根长度的影响

图2 PEG和H2O2处理对WT和G 3转基因水稻幼苗初生根上侧根数量和长度的影响

图3 PEG和H2O2处理对WT和G 3转基因水稻幼苗不定根数量和长度的影响
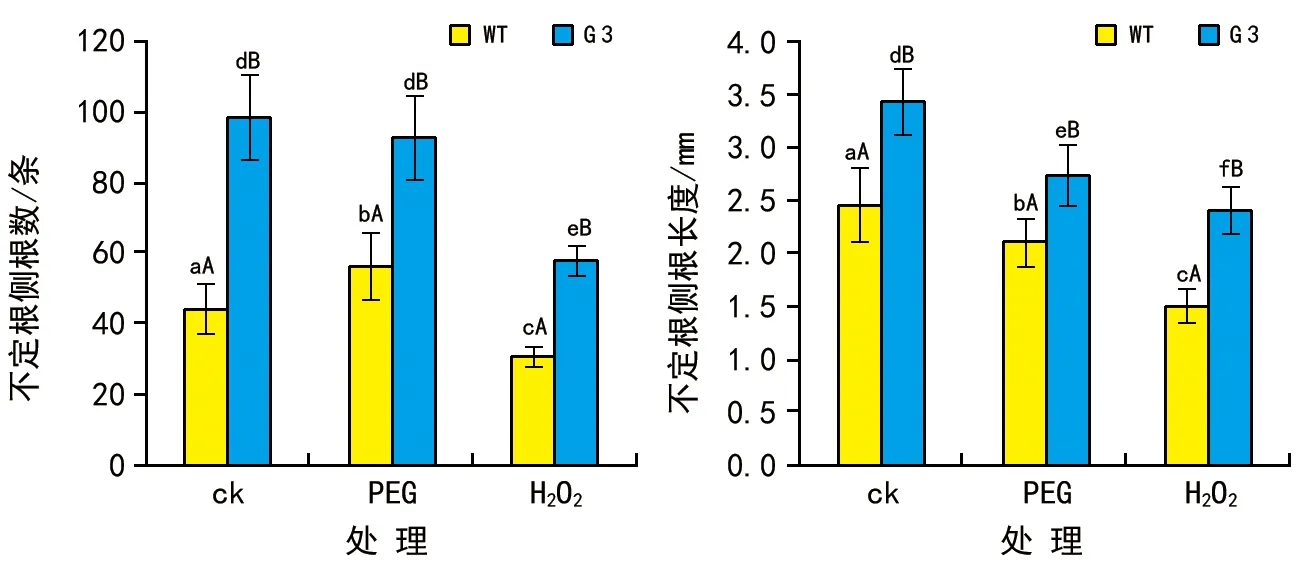
图4 PEG和H2O2处理对WT和G 3转基因水稻幼苗不定根侧根数量和长度的影响
3)PEG和H2O2胁迫对OsYUC2转化苗不定根及其侧根生长的影响。
PEG处理后G 3和WT的不定根数量和长度与对照组的无显著差异(p>0.05);而H2O2明显抑制二者不定根的形成和伸长生长(图3)。
与对照组比,PEG处理显著促进了WT不定根上侧根的形成(图4 A,p<0.05),但G 3的无显著变化;H2O2则明显抑制二者不定根上侧根的形成,不过G 3的数量仍然显著大于WT的(p<0.05)。尽管H2O2和PEG对G 3和WT不定根上侧根的伸长生长都有抑制作用,但是G 3不定根上侧根的长度显著大于WT的(图4 B,p<0.05)。
2.2 过量表达OsYUC2转基因水稻幼苗对干旱和H2O2胁迫的生理生化应答
1)PEG和H2O2对OsYUC2转基因水稻植株相对含水量和根系MDA含量的影响。
图5 A显示,PEG处理后WT和G 3的相对含水量都比对照组的下降,但是G 3的降低幅度小于WT的(p<0.05);H2O2处理后WT和G 3的相对含水量也都降低,不过二者之间差异不显著(p>0.05)。相反,PEG和H2O2处理组MDA含量都比对照组的增加(图5 B),但是G 3的增加量明显小于WT的(p<0.05)。H2O2处理后,WT的MDA比对照增加42.6%,G 3的MDA比对照增加25.9%,WT与G 3之间差异显著(p<0.05)。
2)PEG和H2O2对OsYUC2转基因水稻根尖H2O2积累和分布的影响。
从H2O2积累量看,PEG和H2O2处理后WT和G 3转基因株系初生根、不定根和侧根根尖的H2O2积累量都比在生长素研究中,常用DR5-GUS转基因水稻的GUS活性和分布来分析生长素的积累和分布。本实验中对照组与PEG对照组的增加,但是G 3的增加量小于WT的(图6,以不定根根尖为例)。从H2O2空间分布看,PEG处理条件下,WT的H2O2从分生区到成熟区都有分布,G 3的主要集中在分生区和伸长区;H2O2处理后WT和G 3根尖的H2O2积累从分生区到成熟区都有分布,但是G 3成熟区的H2O2分布明显少于WT的。

图7 PEG和H2O2处理对WT和G 3转基因水稻幼苗根系GUS活性和分布的影响
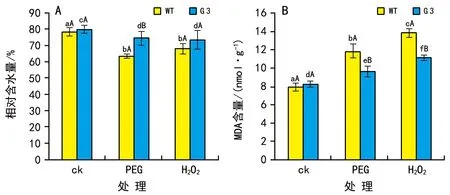
图5 PEG和H2O2处理对WT和G 3转基因水稻幼苗相对含水量和MDA含量的影响

注:箭头指示分生区。图6 PEG和H2O2处理对WT和G 3转基因水稻幼苗不定根根尖H2O2积累和分布的影响
3)PEG和H2O2对OsYUC2转基因水稻和DR5-GUS转基因水稻根系GUS活性和分布的影响。
对照组G 3的GUS活性高且在整个根系分布相对均匀。PEG处理后G 3转基因水稻根系的GUS活性显著降低且呈现梯度分布,染色部位主要集中在初生根、不定根和侧根的根尖及新生侧根(图7),而且根尖分生区和伸长区的GUS活性比对照组的显著降低(图8,以初生根根尖为例),说明PEG影响OsYUC2基因的表达部位和空间分布。H2O2处理后G 3转基因水稻根系的GUS活性也显著降低,特别是初生根、不定根及成熟侧根的分生区几乎没有GUS活性,染色部位主要集中在成熟区的维管组织和新生侧根,说明H2O2也影响OsYUC2基因的表达部位和空间分布(图7,图8)。或H2O2处理组G 3根系与DR5-GUS转基因水稻根系的GUS活性和分布样式的变化类似,说明PEG和H2O2减少生长素的积累并影响其分布(图7,图8)。PEG和H2O2胁迫影响根系特别是侧根的形成和生长与其减少生长素积累并改变生长素的空间分布有密切关系。OsYUC2过量表达使生长素含量增加,这在一定程度上缓解了由于PEG和H2O2胁迫导致生长素减少引起的伤害,故转基因水稻植株受抑制的程度低于WT的。

注:箭头指示分生区和维管组织。图8 PEG和H2O2处理对WT、G 3转基因水稻和DR5-GUS转基因水稻幼苗初生根根尖GUS活性和分布的影响
3 讨 论
生长素合成基因家族YUCs在幼苗生长、根系生长发育和植物抗逆中有重要作用[2,4,6]。本实验中,OsYUC2基因过量表达促进了水稻幼苗和根系的生长。研究发现,激活拟南芥YUC7基因的表达能促进侧根生长并增强植物的抗旱能力[2];在马铃薯中过量表达AtYUC6也提高了抗旱水平[18];本实验得到类似结果。在PEG和H2O2胁迫下OsYUC2过量表达转基因水稻G 3的生长尤其是侧根的生长好于WT的(图1~图4),而MDA和H2O2的积累量比WT的少(图5,图6)。说明OsYUC2基因过量表达在一定程度上提高了植株对干旱和H2O2胁迫的抗性。
在环境胁迫应答过程中细胞氧化状态是决定植物生长的关键因子,细胞氧化信号从合成、结合、氧化、运输到信号传导等多个水平调节生长素生物学[19]。胁迫因子诱导ROS积累,引起细胞氧化状态的变化,影响生长素的时空分布和植物生长,而生长素的分布与生长素合成和运输有关。重金属和盐等胁迫诱导拟南芥生长素的重新分布,进而影响根系的形成和发育[7-10]。本实验中,PEG和H2O2处理显著降低了G 3根系GUS的活性,还改变了其空间分布。更重要的是对照组与处理组G 3与DR5-GUS转基因水稻根系的GUS活性和分布样式的变化一致(图7,图8),说明PEG和H2O2减少了生长素的积累并影响其梯度分布。PEG和H2O2胁迫影响根系生长与其减少生长素积累并改变生长素的空间分布有密切关系。本研究中,G 3植株受抑程度低于WT的,可能是OsYUC2基因过量表达使生长素含量增加,一定程度缓解了PEG和H2O2胁迫引起的伤害。
4 结 论
生长素合成与植物生长发育及抗逆有密切关系。过量表达OsYUC2基因不仅促进了水稻幼苗的生长,而且还在一定程度上提高了转基因水稻幼苗对干旱和H2O2胁迫的抗性水平。

