抗金黄色葡萄球菌的新策略
武英,周洪彬,李文赟,吴虹丽,吴小林
(抗生素研究与再评价四川省重点实验室,四川抗菌素工业研究所,成都大学, 成都 614000)
金黄色葡萄球菌能引起人类广泛的疾病,如脓疱病,以及危及生命的疾病,包括菌血症和肺炎[1]。由耐甲氧西林金黄色葡萄球菌(MRSA)引起的严重感染在所有已鉴定的细菌和真菌病原体中具有最高的总病死率(14%)[2]。 金黄色葡萄球菌的致病机理主要是通过分泌多种免疫系统逃避因子实现的。这些因子包括多种细胞毒素(溶血素、溶细胞肽和杀白细胞素),免疫调节蛋白(超级抗原、超级抗原蛋白和补体抑制蛋白),蛋白酶和阻止免疫细胞识别和杀灭的因子(蛋白质A、荚膜和过氧化氢酶等)[3-7]。这些分子都以各自不同的方式,使得细菌逃避来自宿主免疫系统的攻击[3,6,8]。它们不仅能够协同抑制宿主免疫系统对金黄色葡萄球菌的清除,还阻止针对该病原体的免疫记忆的形成[9-11]。这也是目前金黄色葡萄球菌治疗和疫苗策略失败的主要原因。显然,我们目前对抗金黄色葡萄球菌等病原体的应对手段存在很大的局限性,因为它已经适应了几乎所有的免疫识别策略。其中,金黄色葡萄球菌成孔毒素对发病机制的重要贡献,这些毒力因子作为潜在的治疗靶点引起了越来越多的关注。本综述了金黄色葡萄球菌成孔毒素的致病机理及以其为靶点的治疗方法的最新研究进展。
1 金黄色葡萄球菌的致病机理
产生能够在细胞脂质双分子层内形成孔的水溶性蛋白质,是几乎所有生命体中都存在的现象,包括人体细胞,单细胞真核生物和许多细菌。在细菌中,最常见的成孔分子是蛋白质毒素分子,能够与哺乳动物细胞膜相互作用以促进其裂解,传送信号分子和调节细胞稳态。
金黄色葡萄球菌毒力的一个关键组成部分是一组成孔双组分毒素的分泌,这些毒素统称为杀白细胞素(Leucocidins)。这些杀白细胞素包括Panton-Valentine杀白细胞素(LukSF-PV或PVL),杀白细胞素ED(LukED),γ-溶血素(HlgAB和HlgCB)和白细胞素AB(LukAB,也称为LukGH)[12-13]。这些毒素由两个独立的水溶性单体亚单位组成,通过以受体依赖性方式靶向地与宿主白细胞膜结合并形成跨越磷脂双层的桶状孔(图1),来破坏和杀死白细胞。
双组分杀白细胞素是由两个亚单位,受体靶向S型亚基(在色谱柱中迁移慢:LukS-PV,LukE, HlgA, HlgC和LukA)和聚合F型亚基(在色谱柱中迁移快:LukF-PV,LukD,HlgB和LukB)[12]。在大多数宿主细胞上,S亚基识别蛋白质受体(趋化因子受体[LukED和PVL]或整联蛋白[LukAB / HG])以促进与细胞表面的高亲和力结合(1),然后S亚基识别并募集F亚基(2),导致宿主细胞表面的二聚化(3)。二聚化之后毒素寡聚体组装成含有交替排列的S和F亚基的八聚体结构(4)。寡聚化后,在S和F亚基的茎结构域中发生主要的结构变化,导致插入膜并形成跨越宿主细胞脂质双层的α-桶孔(5),引起渗透不平衡和细胞裂解[14]。
图2(A)小鼠吞噬细胞(巨噬细胞和嗜中性粒细胞)和人T细胞系HUT-R5(过表达CCR5的细胞系)暴露于90%致死剂量的LukED(5μg/mL)后,在光学显微镜(LM)和荧光显微镜下地图像。可以观察到特征性膜晕和细胞核的扩张,在以溴化乙锭(EtBr)处理下细胞的渗透性增加,这是孔形成和膜损伤的指标。白色箭头指向杀白细胞素中毒时特征性的细胞形态变化。(B)电子显微镜图像下,暴露于含有100%致死剂量的LukAB / HG(2.5μg/mL)的金黄色葡萄球菌上清液后,人多形核白细胞(hPMN)细胞系PMN HL60细胞开始裂解[15]。
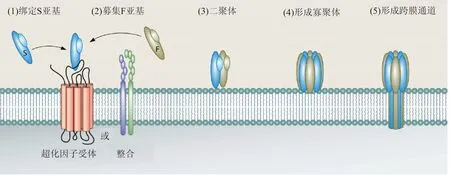
图1 杀白细胞素跨膜空通道形成过程

图2 杀白细胞素介导的免疫细胞裂解
2 杀白细胞素(Leucocidins)的种类
目前临床感染人类的大多数高毒性金黄色葡萄球菌菌株产生五种细胞毒素:HlgAB,HlgCB,LukAB / HG,Panton-Valentine leucocidin (PVL),LukED和 LukMF。其中LukMF存在于反刍动物和其他非人类哺乳动物体内分离出的金黄色葡萄球菌谱系中。这些毒性分子的别名、基因位点、靶向免疫细胞、菌种分布、识别受体、毒性机理、物种特异性、亚细胞活性和溶血活性归纳整理见表1[14]。
3 杀白细胞素的晶体结构
我们对这些杀白细胞素在其宿主细胞上形成孔的机制是基于对其晶体结构的测定。1999年,测定了γ-溶血素(HlgB)和PVL(LukF-PV)的F亚基结晶测定,2004年测定了PVL的S亚基和2008年的HlgAB工程化二聚体的晶体结构[16-17]。通过这些晶体学研究,描述了杀白细胞素的主要结构特征(图3)。发现其S和F亚基非常类似于先前鉴定的α-溶血素的核心结构[18],包含功能结构域、茎结构域、β-夹层结构域和氨基锁结构:(1)功能结构域包括边缘结构域,由识别并结合磷脂和其他分子的高度芳香族残基组成;(2)富含甘氨酸和疏水的茎结构域,其插入宿主细胞的膜的过程中会发生显著的结构转变,形成β-桶状孔结构;(3)β-夹层结构域,含有亚基间相互作用的关键残基;(4)氨基锁结构,在杀白细胞素的单体到寡聚体孔结构转变过程中参与茎结构域定位,该结构在杀白细胞素中可能是不保守的[19]。
图3(A)γ血溶素(HlgB)的晶体结构图[20],结构信息从蛋白质数据库(PDB,登录号1LKF)获得,并且主要结构域通过使用PyMOL软件着色,分别:蓝氨基锁结构区域、β-夹层结构域、茎结构域、边缘结构域。(B)HlgAB八聚体的晶体结构[21],结构信息从PDB(登录号3B07)获得,并使用PyMOL软件对主要结构域进行着色,分别:S亚基(HlgA)、F亚基(HlgB)。图中还标明了茎结构、边缘结构、帽结构以及β-桶状孔结构。
4 对抗金黄色葡萄球菌分泌杀白细胞素的新策略
最新研究发现,一种特异的小分子球状蛋白Centyrins(~10kDa),能够靶向金黄色葡萄球菌分泌的杀白细胞素(Leukocidins),从而消除细菌破坏宿主细胞的能力,保护人类免疫吞噬细胞免受毒素介导的杀伤,这种新方法可以帮助解决抗生素耐药性问题。这种蛋白质分子是研究人员从具有结合并中和杀白细胞素能力的中心蛋白质库中筛选而来[22]。
Centyrins,是一种支架类蛋白质分子[23],衍生自人肌腱蛋白-C蛋白结合结构域的15个纤连蛋白III型(FN3)的共有序列(图1A)[3,23]。基于人生腱蛋白-C的共有FN3结合序列的文库(本文称为TENCON)在BC环,C链,CD环,F链和/或FG环位置处呈现氨基酸多样化性。这种蛋白分子具有高特异性和亲和力,并且以非糖基化的单链蛋白存在,其缺乏二硫键,很容易在大肠埃希菌中大量生产。
为了鉴定能够特异性结合金黄色葡萄球菌双组分杀白细胞素的中心蛋白,Rita Chan等进行了一系列体外选择,涉及亲本TENCON蛋白文库变体[3,24],链和环位置的组合中具有多样化的残基。图4(A),TENCON(蛋白质数据库:3TES)的晶体结构。图中标明了文库的氨基酸多样化位点,用于鉴定对白细胞介素具有强亲和力的中心蛋白。(B)选择的杀白细胞素中心蛋白和亲本TENCON序列的氨基酸序列比对。环区域的位置加下划线并标记。所有序列保守的氨基酸残基以灰色突出显示。括号中的数字表示氨基酸在中心区中的位置。
最近研究人员使用分子生物学技术对文库中亲本中心进行了更改,创造了一万亿个分子结构略微不同Centyrins。在这个巨大的文库中,通过从蛋白质-DNA复合物文库中体外选择肽(CIS)的方法[4]仔细筛选,发现了209个Centyrins分子,它们恰好能够与金黄色葡萄球菌分泌的五种主要杀白细胞毒素之一结合。然后通过酶联免疫吸附测定(ELISA)和生物层干涉测定(BLI)确认其结合特异性。鉴定每种球状蛋白分子对金黄色葡萄球菌产生的多种杀白细胞素的靶向特异性(表2)[25]。
5 讨论
目前正在临床开发许多靶向α-毒素的单克隆抗体(mAb)用于预防金黄色葡萄球菌肺炎,包括mAb MEDI4893和KBSA301[26-27],也发现了许多抗LukAB单克隆抗体[28-29]。尽管目前许多有希望的分子可以治疗金黄色葡萄球菌感染,但是这种单靶点方法的失败有很大的先例[26]。因此,药物开发者在制定抗金黄色葡萄球菌疗法时需要考虑整合多学科联合策略。本文介绍的小分子球蛋白(Centyrins)通过靶向阻断金黄色葡萄球菌的裂解白细胞活性来抑制金黄色葡萄球菌的感染性,已经在许多临床实验中[3,8,23,30]中进行了探索。这些蛋白分子中某些表现出对杀白细胞素的交叉中和活性,通常,表现出交叉反应特性的蛋白靶向的杀白细胞素在其亚基(例如,HlgCB和LukSF-PV)之间具有明显的氨基酸序列保守性[14]。

图3 杀白细胞素晶体结构图
金黄色葡萄球菌表现出LukAB依赖性细胞外杀伤hPMN。虽然实验证明可以通过LukAB阻断性蛋白SM1S17以浓度依赖性方式特异性中和这种细胞毒性。但是如果金黄色葡萄球菌被细胞内化,则SM1S17的hPMN的保护作用大大降低,这些阻断蛋白分子进入细胞内环境的途径有限。尽管金黄色葡萄球菌传统上被认为是细胞外病原体,但越来越清楚的是金黄色葡萄球菌可以在吞噬细胞内存活以促进传播和发病[31-32]。因此,该方法的一个缺陷是无法从内部中和金黄色葡萄球菌的毒性。因此,临床应用Centyrins可能需要制定一种机制,使Centyrins能够进入宿主细胞中。最近证明该策略对于将抗生素与金黄色葡萄球菌抗体结合,从而将抗生素递送至宿主细胞内是可行的[32]。因此将Centyrins与能够靶向金黄色葡萄球菌表面的人源单克隆抗体融合,结合成一类新的蛋白质,称为MABtyrins,它可以更有效地中和金黄色葡萄球菌的毒性分子。这种融合蛋白的工程化为金黄色葡萄球菌感染的治疗方法提供了一条潜在的途径,并且在细胞外和细胞内区都具有活性[26]。
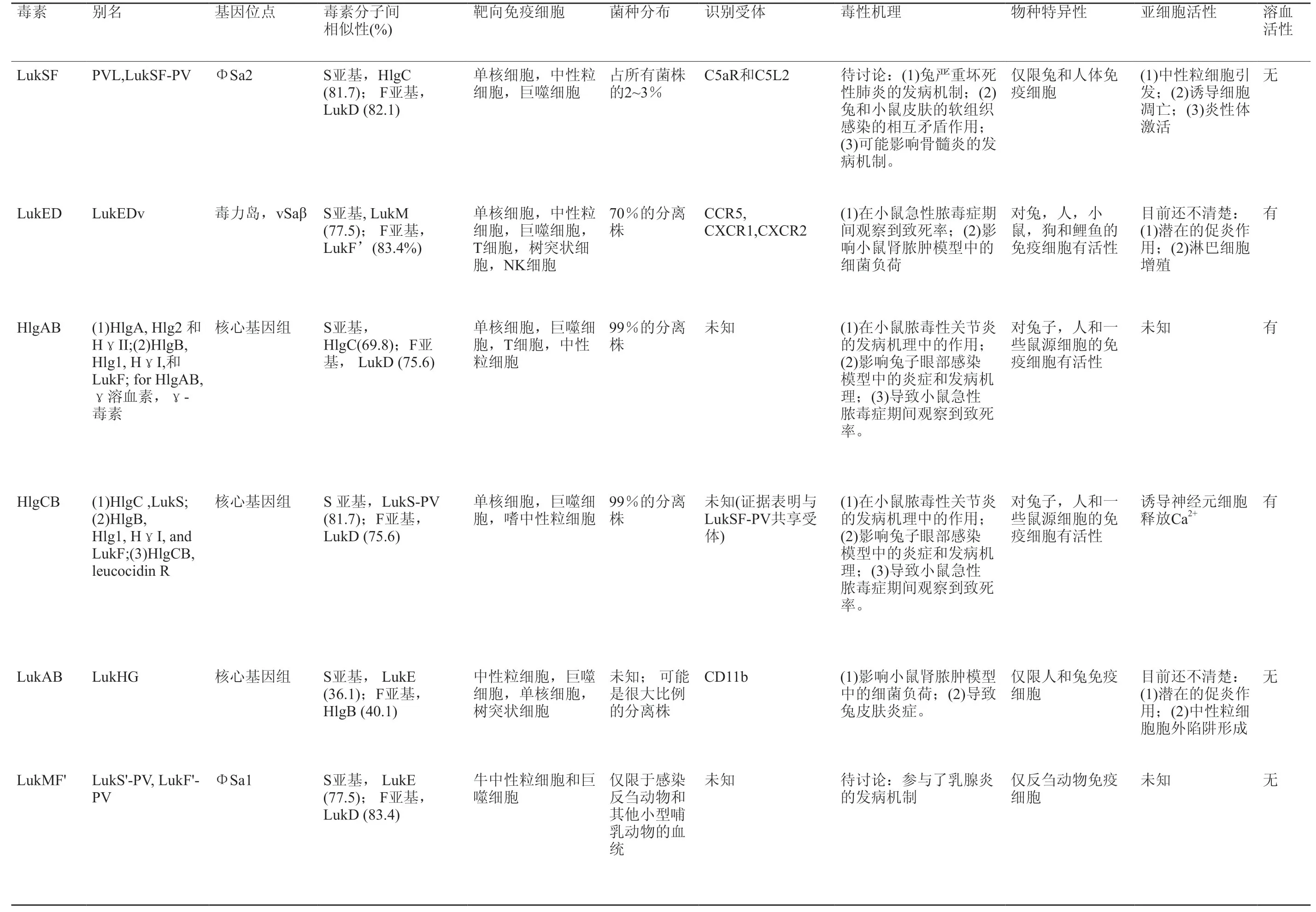
表1 金黄色葡萄球菌产生地杀白细胞素特点
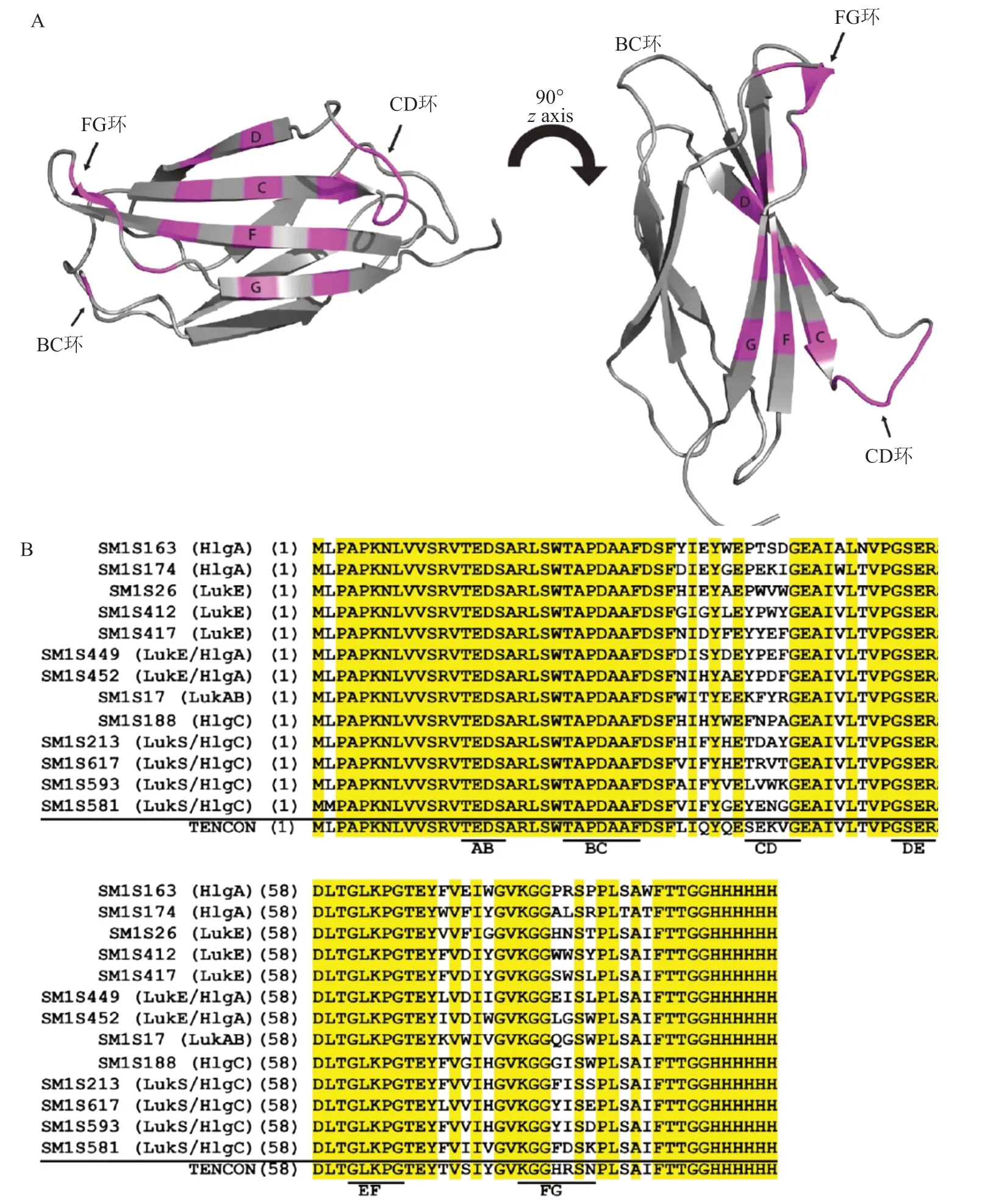
图4 选定的强效抗杀白细胞素蛋白的晶体结构和序列比对
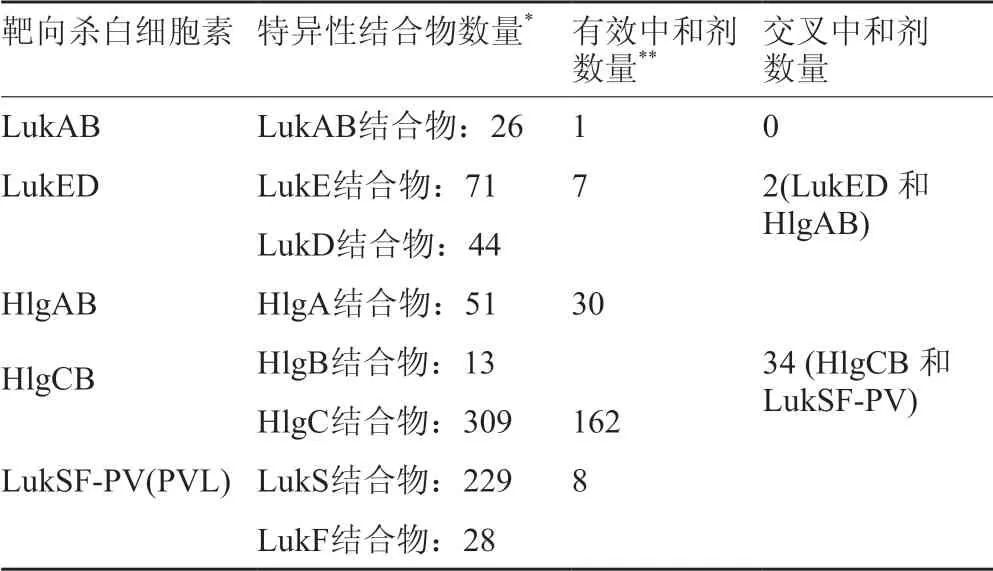
表2 从文库中筛选出的能够特异性结合杀白细胞素的蛋白分子centyrins种类

