喹诺酮类化合物的抗HIV活性
王菊仙,冯连顺,编写 刘明亮,郭慧元,审校
(中国医学科学院北京协和医学院 医药生物技术研究所,北京 100050)
1 前言
获得性免疫综合征(AIDS, 又称艾滋病)是由人类免疫缺陷病毒(HIV)引起的一种病死率极高的恶性传染性疾病。HIV病毒侵入人体后可破坏人体的免疫系统,令感染者逐渐丧失对各种疾病的抵抗能力,进而增加机会性感染的几率,导致死亡。HIV病毒有2个亚型即HIV-1和HIV-2,二者核苷酸序列有40~60%的同源性。通常认为,HIV-1的传染性和致病性更强,而HIV-2传染性和繁殖能力远弱于HIV-1。
据世界卫生组织(WHO)估计,2017年全球约有3690万(3510万成人和180万儿童)HIV携带者,且每年新增约150万感染病例,因此而丧命的患者高达百万。高效抗反转录病毒疗法(HAART)对治疗HIV患者不可或缺,极大地延长了患者的寿命。截止2017年底,约有2170万HIV患者接受了HARRT的治疗,但仅占所有患者的59%。耐多药HIV的出现和HAART不能从体内彻底清除HIV病毒等缺陷,使得研发新型抗HIV药物显得尤为重要。
喹诺酮可分为2-喹诺酮和4-喹诺酮,具有抗菌、抗疟疾、抗结核、抗肿瘤、抗老年痴呆、抗真菌、抗丙肝和抗HIV等多种生物活性,在药物化学领域举足轻重。其中,埃替格韦(图1)是首个被批准上市的喹诺酮类HIV整合酶抑制剂,已用于HIV患者的治疗,提示对喹诺酮进行合理的修饰可能会获得具有潜在抗HIV活性的候选物。
近30年来,科学家有针对性的设计合成了多个系列喹诺酮衍生物,并评价了它们的抗HIV活性,发现了若干具有进一步研究价值的候选物。本文将重点介绍近年来喹诺酮类化合物在抗HIV领域的研究进展,并归纳构-效关系(SAR),以启迪药物化学家进一步合理设计此类化合物。
2 2-喹诺酮类化合物
2-喹诺酮类化合物具有多种生物活性,其中纯绿青霉素、纯绿青霉素醇和替吡法尼等2-喹诺酮衍生物(图2)正处于临床评价阶段,有望于不久的将来为人类健康服务。显然,2-喹诺酮母核在新药研发领域占据重要位置。
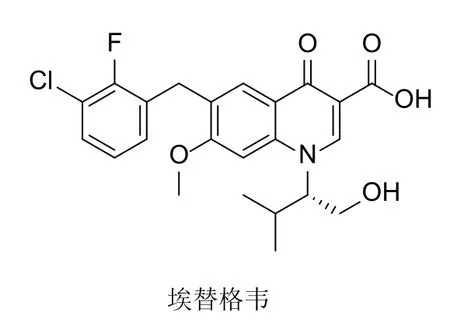
图1 埃替格韦的化学结构
HIV-1衣壳对病毒的组装与成熟具有重要作用,是潜在的HIV药物作用靶点。HIV-1衣壳蛋白主要由N端区域(NTD)和C端区域(CTD)组成,其中以NTD为靶点的HIV-1抑制剂是药物化学家研究的热点,而以CTD为靶点的抑制剂鲜有报道。为开发CTD抑制剂,Curreli等设计合成了一系列2-喹诺酮衍生物1(图3),发现此类化合物对HIV-1IIIB(MT-2细胞)具有潜在的活性,半抑制浓度(IC50)为1.06~>38.9 μmol/L。研究表明,此类化合物可通过与HIV衣壳CTD疏水腔键合达到抑制病毒成熟的功效。SAR研究显示,2-喹诺酮结构单元对抗HIV活性不可或缺,这可能是由于内酰胺可与位于HIV衣壳CTD疏水腔的Asn183形成氢键所致。R1和R2位点为疏水性基团时对活性有利,且呋喃由于噻吩。不仅如此,R1和R2位点也可为取代苯基:对R1位而言,向苯环上引入甲基时对活性不利;对R2位而言,向苯环的对位引入氯、溴和甲基可提高活性,但大体积取代基如异丙基和甲氧基则对活性不利。R3位为甲基时对活性有利,而甲氧基和乙基则会降低活性。代表物1a不仅对HIV-1IIIB(MT-2细胞)的活性最高,IC50为1.06 μmol/L,且对MT-2和PBMC细胞的毒性(CC50: >61.45 μmol/L)极低。进一步研究发现,化合物1a具有广谱抗病毒活性,其对多株实验室(MT-2胞内的IIIB, MN, SF2, RF, AZT-R和HIV-1RF/L-323-12-3和PBMC胞内的Bal和89.6)及临床分离HIV-1病毒株(9PBMC胞内的4UG103, 92UG037, 92US657,93IN101, 92UG024, 93BR020, RU570和BCF02)的IC50低至1.06~6.17 μmol/L。显然,优秀的广谱抗HIV-1活性和极低的毒性使得化合物1a极具进一步研究价值。

图2 纯绿青霉素、纯绿青霉素醇和替吡法尼的化学结构
Sekgota等评价了一系列3-[(N-环烷胺)甲基]-2-喹诺酮(2和3)的抗HIV-1整合酶(IN)活性,发现几乎所有的化合物在浓度为20 μmol/L时对HIV-1 IN均显示出潜在的抑制活性,但对HIV-1蛋白酶(PR)和逆转录酶(RT)未显示出明显的抑制活性,提示此类化合物可选择性的抑制HIV-1 IN。SAR显示,当甲氧基在2-喹诺酮母核的C-8位时对活性不利,但在C-6位时则可提高活性。其中,化合物2e在浓度为20 μmol/L时对HIV-1 IN的抑制率为60.1%,且对人胚肾细胞HEK 293无毒,值得深入研究。
2-喹诺酮衍生物4和2-萘啶酮5对野生型(wt, EC50:4~2 nmol/L)和突变IN (Y143R, N155H, G140S/Q148H,G118R and E138K/Q148K, EC50: 4.9~2,200 nmol/L)HIV-1病毒具有潜在的活性。SAR显示,2-萘啶酮5的活性优于2-喹诺酮4。对2-喹诺酮衍生物4而言,C-8位(R2)的羟基对高活性至关重要,且苯环(R1)含氯时活性优于相应的含氟衍生物。对2-萘啶酮5而言,N-1位(R1)的羟基为高活性所必需,但向C-4位(R3)引入羟基并不能提高抗HIV活性。其中,化合物5c(EC50: 4.9~438 nmol/L)和5f(EC50: 11~308 nmol/L)对单突变(Y143R, N155H andG118R)和双突变IN(G140S/Q148H and E138K/Q148K)的活性优于雷特格韦(EC50: 154-1,900 nmol/L),且二者(EC50: 5.1 and 6.2 nmol/L)对wt IN的抑制活性与雷特格韦(EC50: 4 nmol/L)相当。进一步研究发现,向2-萘啶酮的C-4位引入游离氨或烷基胺对活性有利,而芳胺则对活性不利,且贡献顺序为游离氨>烷基胺>芳胺。代表物6o(EC50: 1.1~35 nmol/L)对wt和突变IN(Y143R, N155H,R263K, G118R和G140S/Q148H)的活性极高,对所测所有HIV-1IN的活性是雷特格韦的1.4~64.8倍。不仅如此,化合物6o (CC50: >250 μmol/L)对人骨肉瘤细胞无毒,故其可作为先导物进一步优化。
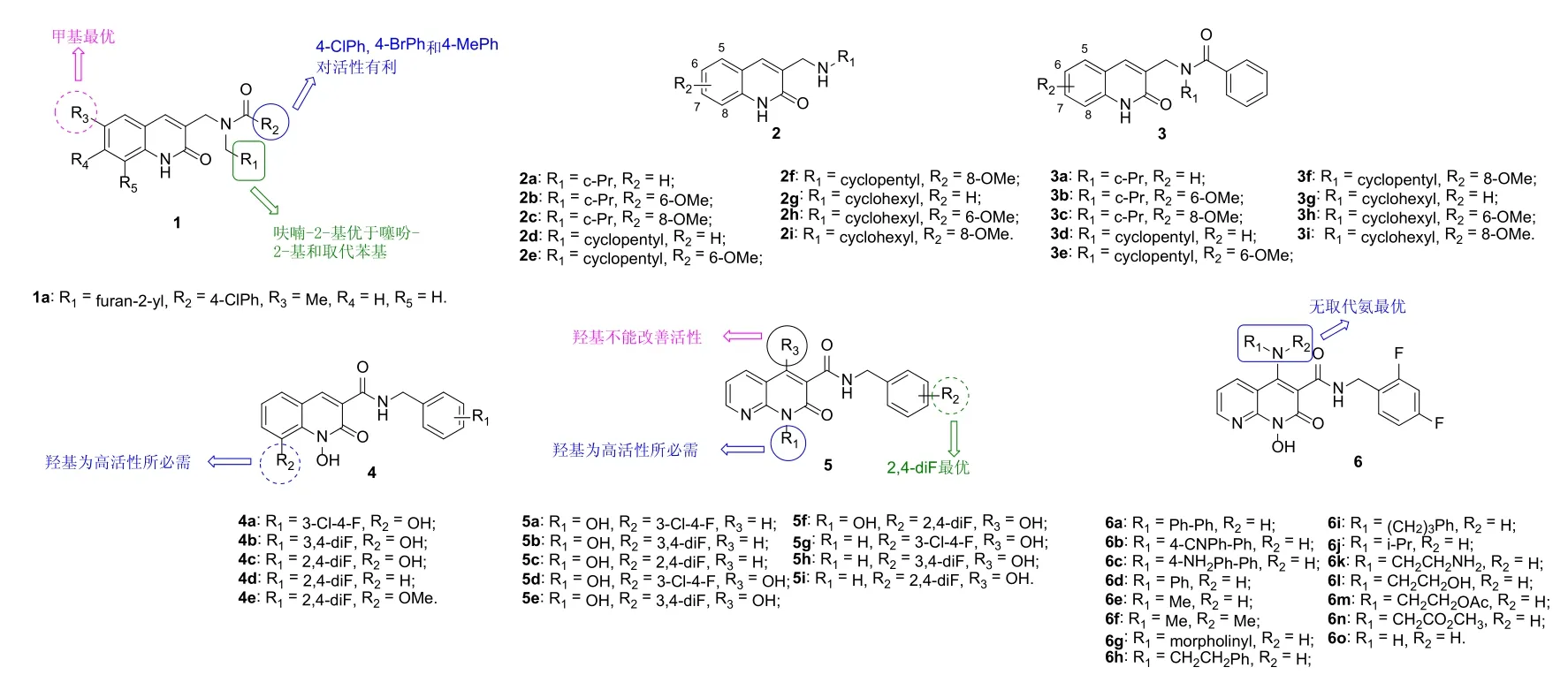
图3 2-喹诺酮衍生物1~6的化学结构
除IN外,RT和PR也是HIV复制所必须的酶,故RT和PR也是潜在的抗HIV药物作用靶点。2-喹诺酮衍生物7(图4)对wt (IC50: 0.24~0.71 μmol/L)和突变HIV-1 RT (Cys181和Il100, IC50: 0.86~2.50 μmol/L)也具有潜在的活性,抑wt RT活性与nevirapin (IC50: 0.30 μmol/L)相当,但抑HIV-1 Cys181和Il100 RT活性则是nevirapin (IC50: >100 μmol/L)的>40倍。所有化合物对HIV-1IIIB和耐nevirapin HIV-1病毒均显示出极高的活性,IC50分别为0.035~0.242 μmol/L和0.368~2.210 μmol/L。SAR研究结果表明,将硫醚(7c, 对HIV-1IIIB和耐nevirapin HIV-1的IC50分别为0.100和0.368 μmol/L)氧化为亚砜(7d,对HIV-1IIIB和耐nevirapin HIV-1的IC50分别为0.242和2.210 μmol/L)时将导致活性的降低。用氧原子(7a, IC50: 0.035和0.607 μmol/L)替换硫原子可提高抗HIV-1IIIB活性,但会降低抗耐nevirapin HIV-1活性。此外,C-3位为正丙基时活性优于相应的异丙基衍生物。
C-3和C-4位含有环丙基的2-喹诺酮衍生物8对wt HIV-1具有良好的活性,半数效应浓度(EC50)为1~221 nmol/L。SAR显示,R位为直链烷烃时对活性有利,其中,正丁基(8d, EC50: 3 nmol/L), 4-戊烯基(8e, EC50:1 nmol/L)和正戊基(8f, EC50: 1 nmol/L)最优。延长或缩短烷基链均对活性不利,而支链烷烃或芳基则会导致活性大幅降低。进一步研究显示,将环丙基换做环丁基(9a)或用氰基(9b)、酮(9c)或酰胺替换羧酸乙酯或去除环丙基(9d和9e)将导致活性降低。将酯基还原为醇(10a, EC50: 743 nmol/L)亦对活性不利,但相应的醚衍生物10b~d (EC50: 45, 65和37 nmol/L)则显示出良好的活性。将乙酯换做甲酯(11a, EC50: 1 nmol/L)或烯丙酯(11b, EC50: 1 nmol/L)对活性影响不大,但芳香酯则会导致活性大幅降低。对12个EC50<100 nmol/L的化合物抗耐非核苷类逆转录酶抑制剂(NNRTI)突变HIV-1 (E138K, F227L, I135V, K103N, L100I,L106A, Y181C, Y188L, V179E, Y181H 和Y181S)活性测试结果表明,所测化合物对E138K, F227L, I135V,L100I和Y181H的抑制浓度在纳摩尔级。值得一提的是,代表物8f (EC50: 1~238 nmol/L)对绝大多数wt和耐NNRTI突变HIV-1病毒株的活性是奈韦拉平的2~50倍,极具进一步开发前景。
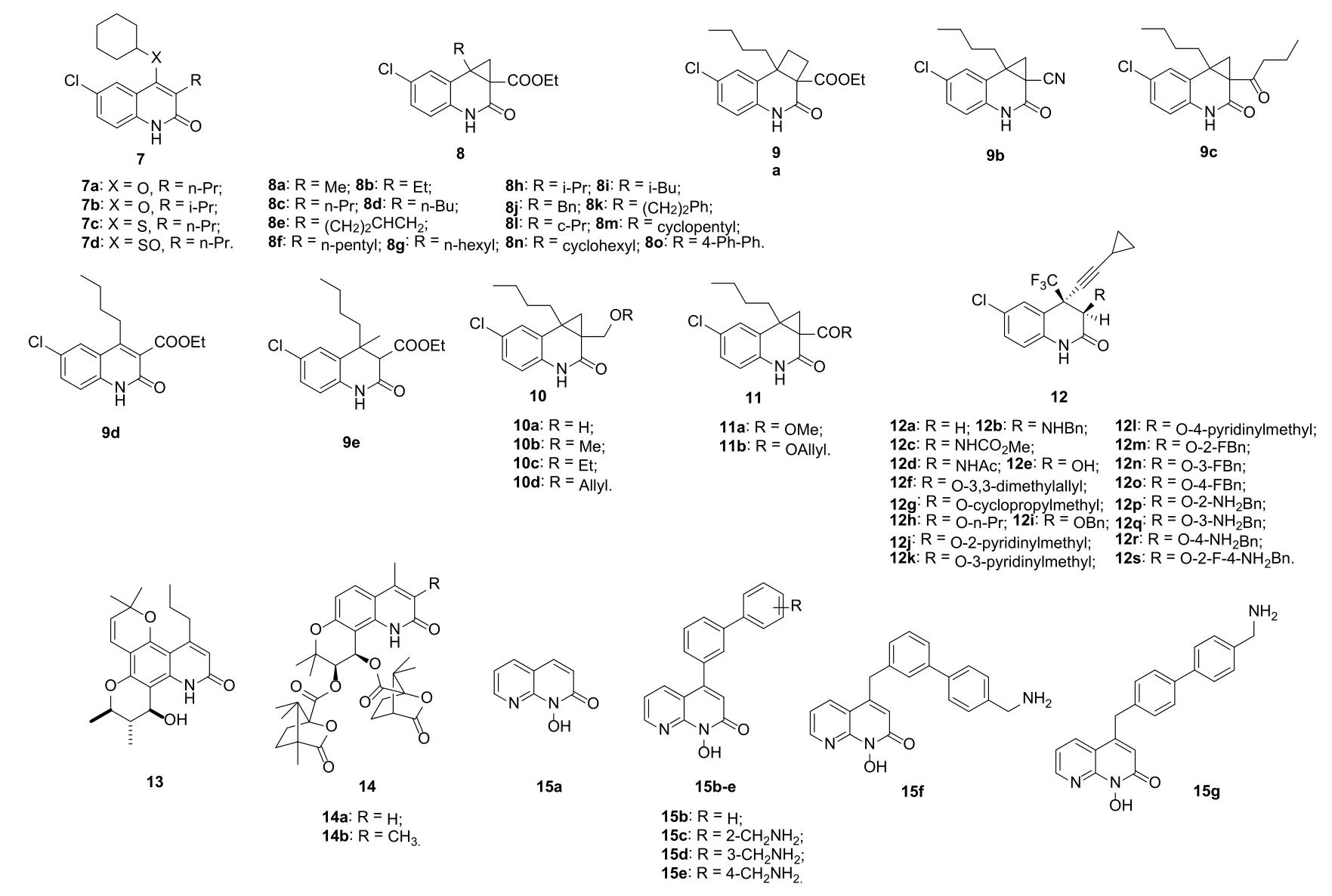
图4 2-喹诺酮衍生物7~15的化学结构
除12f之外的2-喹诺酮衍生物12也具有潜在的抗HIV-1活性,IC50为14~917 nmol/L,但弱于对照药依法韦仑(IC50: 2 nmol/L)。与无取代化合物12a (R = H,IC50: 14 nmol/L)相比,向R位引入胺基、酰胺或酯基对活性不利。总体而言,R位为醚键的衍生物活性高于相应的胺基和酰胺衍生物。芳基上取代基的位置对活性也有显著影响,且对位最优。化合物12a, 12o和12r对耐NNRTI 突变K103N, L100I和K103N/L100I的IC90为23~4,830 nmol/L,而活性最高的12o (IC90:50, 23和4,830 nmol/L) 对上述3株病毒的活性优于依法韦仑(IC90: 64, 77和7,300 nmol/L)。
抗HIV-1拟转录酶抑制剂天然产物Calanolide A正处于治疗AIDS的临床评价阶段,但其溶解度和生物利用度较差,限制了其应用。(±)-氮杂Calanolide A13 (EC50:0.12 μmol/L)抗HIV-1活性优于Calanolide A(EC50:0.27 μmol/L),值得进一步研究。化合物14a,b抗HIV的EC50分别为0.24和4.6 nmol/L,活性是叠氮胸苷(EC50: 45 nmol/L)的187.5和9.7倍,且化合物14a(IC50:28 μmol/L)对H9细胞的毒性较低,极具进一步开发价值。
对2-萘啶酮衍生物15的研究结果显示,与无取代物15a相比,C-4位苯环(15b~e)或苄基(15f,g)的引入可提高抗HIV-1核糖核酸酶H(RT-RNH)活性。代表物15g对RT-RNH (IC50: 45 nmol/L)的活性极高,且可在IC50为190 nmol/L时抑制 HIV-1 (HeLa P4-2细胞)复制,故其可作为先导物进一步优化。
2-喹诺酮化合物16(图5)对KB, A549, HCT-8,CAKI-1, MCF-7, HOS, IA9和U-87-MG肿瘤细胞系显示出良好的活性,但未显示出明显的抗HIV活性。2-喹诺酮-噻唑杂合体17可在浓度为12.5 μg/mL时抑制0~95% MTB H37Rv,但也未显示出任何抗HIV活性。2-喹诺酮衍生物18和19具有潜在的抗菌、抗真菌、抗结核和抗肿瘤活性,但对HIV-1IIIB和HIV-2ROD(MT-4细胞)无活性。
3 4-喹诺酮衍生物
目前,所有市售喹诺酮药物均属于4-喹诺酮类化合物,故4-喹诺酮一直是该领域的研究重点。4-喹诺酮可供修饰的位点较多,其中N-1, C-5, C-6, C-7和C-8位修饰最为常见。
3.1 N-1和C-8位结构修饰
4-喹诺酮N-1位取代基与总体活性、药代动力学和微生物学性质息息相关,而C-8位取代基对改善口服药代动力学性质、拓展生物活性谱和降低选择性突变具有重要意义。某些喹诺酮如氧氟沙星和左氧氟沙星含有一个连接N-1和C-8位的六元杂环,研究显示该结构片段是环丙基的一个成功替代基团。基于此,本部分将探讨N-1和C-8位取代基对抗HIV活性的影响。
对一系列N-1位为烷基、环烷基、烯基、醇、胺和芳环取代基4-喹诺酮衍生物的抗HIV研究结果显示,取代基的连接方式与活性息息相关。5-羟基喹诺酮-3-羧酸衍生物20和21对wt HIV-1和HIV-1突变株A17 (C8166细胞)具有潜在的活性,EC50为3.17~307.57 μmol/L。SAR显示,N-1位为取代苄基时活性优于相应的苯基衍生物。与无取代的化合物20a相比,向苯环上引入供电子基甲基或吸电子基溴20b~e均可提高抗HIV活性。对化合物21而言,向苯环(R1位)引入供电子甲基或吸电子氟将导致活性下降,但向R2引入氯则对活性有利。活性最高的21a对wt HIV-1和HIV-1突变株A17 (C8166细胞)的EC50分别为3.17和17.88 μmol/L,但远弱于埃替格韦 (EC50:0.00021和0.0010 μmol/L)。对4-喹诺酮-吡唑杂合体22而言,酯22a,b和酸22c,d (IC50: >100 μmol/L)对HIV-1 IN无活性,但含有酚羟基的杂合体22e,f (IC50: 21.16和2.60 μmol/L)则显示出潜在的活性。喹诺酮-甲硝唑杂合体23具有优秀的抗真菌活性,但对HIV-1IIIB和HIV-2ROD(EC50: >19.22 μmol/L)未显示出明显活性。与N-1位无取代苄基4-喹诺酮衍生物24a(浓度100 μmol/L时抑制率为70%)相比,向苯环上引入氟原子24b~d(浓度100 μmol/L时抑制率<10%)导致活性大幅降低。
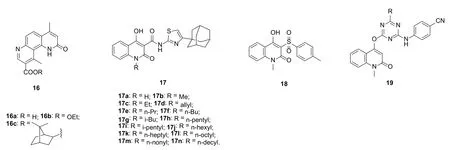
图5 2-喹诺酮衍生物16~19的化学结构
喹诺酮二酮酸是潜在的HIV-1 IN 3'-加工过程(3'-P)和链转移反应(ST)及RNase H抑制剂,基于此,Pescatori等评价了一系列N-苄基喹诺酮二酮酸25和26的抑制HIV IN3'-P、ST和RT RNase H活性。结果表明,化合物25和26抑RNase H和HIV IN 3'-P活性可忽略不计(仅少数化合物在浓度为>10 μmol/L时显示出一定的活性),但大多数化合物具有潜在的抑IN ST活性。化合物26对IN ST的IC50在纳摩尔级,活性优于相应的乙酯25,但后者的抗HIV-1IIIB活性优于前者。以吡啶、喹啉或者萘基(27)替代苯环时将导致抗HIV-1IIIB活性的降低。其中,代表物25j, 25l和26f对HIV-1IIIB的EC50分别为0.58, <0.2和0.87 μmol/L,且对HeLa-CD4-LTR-β-gal细胞无毒(CC50: >50 μmol/L),值得进一步研究。
无论喹诺酮N-1位连何种取代基,通过氮原子连接的二芳基嘧啶-喹诺酮杂合体29对耐NNRTI双突变K103N/Y181CHIV-1IIIB病毒株(MT-4细胞)均未显示出任何活性,但某些通过氧原子连接的二芳基嘧啶-喹诺酮杂合体28(图7)则对wt HIV-1显示出中等强度的抑制活性,EC50为0.28~1.16 μmol/L。活性最高的杂合体28a对HIV-1IIIB的EC50为0.28 μmol/L,作用机制研究显示,该杂合体可作用于RT。有趣的是,向喹诺酮母核C-6位引入溴(30)或碘(31)可极大的提高这类杂合体对耐NNRTI双突变K103N/Y181CHIV-1IIIB病毒株的活性,且碘代物31(抗耐NNRTI双突变K103N/Y181CHIV-1IIIB病毒株的EC50分别为9.6~570 nmol/L和0.77~4.73 μmol/L; 抑HIV RT的IC50为0.37~6.30 μmol/L)的活性优于相应的溴代物30(抗耐NNRTI双突变K103N/Y181CHIV-1IIIB病毒株的EC50分别为18~1,570 nmol/L和0.90~>32.58 μmol/L; 抑HIV RT的IC50为0.41~10.05μmol/L)。对杂合体31而言,N-1位为直链烷基如乙基、正丙基和正丁基优于支链烷基如仲丁基和叔丁基,且烷基链的长度与活性正相关。代表物31c(EC50: 9.6 nmol/L和0.98 μmol/L; IC50: 0.51 μmol/L)的抗HIV-1IIIB活性与叠氮胸苷、依法韦仑和恩替卡韦(EC50: 5.6, 5.4和1.9 nmol/L)相当,抗耐NNRTI双突变K103N/Y181CHIV-1IIIB病毒株活性是奈韦拉平(EC50: 244 nmol/L和≥11 μmol/L)的≥11.2倍。
4-喹诺酮衍生物32 (EC50: 1.83~23.54 μmol/L)具有中等强度的抗HIV-1活性,但远逊于对照药埃替格韦(EC50: 0.00021 μmol/L)。这可能是由于C-5位羟基的存在导致的理化性质改变所致。SAR显示,支链烷烃或环烷烃优于直链烷烃。对接试验表明,此类化合物可能通过双金属鳌合机制发挥抗HIV活性。

图6 N-1位含有芳香环的4-喹诺酮衍生物20~27的化学结构
与无取代或单取代(R2位)4-喹诺酮衍生物33a~h(IC50: 0.410~2.300 μmol/L)相比,双取代衍生物33i~q (IC50: 0.026~0.370 μmol/L)的抑HIVIN ST活性更高。总体而言,N-1位为烷基的化合物33l~q(EC50: 0.290~2.340 μmol/L和IC50: 0.026~0.083 μmol/L)的抗HIV和抑HIVIN ST活性高于无取代衍生物33k(EC50: 3.400 μmol/L和IC50: 0.070 μmol/L),提示N-1位取代基对活性有显著影响。进一步研究发现,酸(34a,b)、酰胺(34c,d)或氨乙基(34e)的引入并不能改善活性(图8),而羟基烷基(34f,g)的引入可提高活性,将羟基进一步酯化则对活性不利。对N-羟基次乙基喹诺酮衍生物35而言,向R1, R2或R3位引入氟原子则活性降低。向R2位引入供电子基团甲氧基可提高活性,吸电子基团三氟甲基、氯和氰基对活性不利。4-喹诺酮衍生物36具有良好的抗HIV-1和抑HIVIN ST活性,EC50和IC50分别为1~52 nmol/L和6~15 nmol/L。SAR研究结果表明,R1位为直链或支链烷烃时优于环烷烃,且异丁基最优。化合物36h~j(IC50: 1 nmol/L)的抗HIV-1活性最高,提示甲氧基对于高活性不可或缺。
N-氨基和N-乙酰胺基4-喹诺酮衍生物37的抗HIV-1IIIB和HIV-2ROD活性较弱,而其N-乙烯基衍生物38则显示出较强的抗HIV-1IIIB活性,EC50为5~190 nmol/L。其中,化合物38c (对HIV-1IIIB的EC50为5 nmol/L)和38b (对HIV-2ROD的EC50为550 nmol/L)的选择性指数(SI) ≥10,值得进一步研究。
氧氟沙星衍生物R-71762 (39)(图9)不仅对多种致病菌显示出良好的活性(MIC: 0.25~64 μg/mL),对HIV-1的IC50也低至1.7 μmol/L。进一步研究发现,R-71762可抑制急性和慢性HIV-1感染细胞内的病毒复制。SAR显示,移除连接N-1和C-8位六元环上的氟原子将导致活性降低。对4-喹诺酮40而言,抗HIV活性与C-8位的取代基息息相关,且取代基的贡献顺序位二氟甲氧基(40c, IC50: 0.25 μmol/L) >甲氧基(40b,IC50: 1.8 μmol/L) >>氟(40a, IC50: 50 μmol/L)。进一步修饰得到了8-二氟甲氧基喹诺酮41,SAR显示对此类化合物而言,哌嗪上的取代基对活性影响较大,且贡献顺序为苯基(41c, IC50: 0.063 μmol/L) >吡啶-2-基>嘧啶-2-基>>氢、甲基和苄基。向苯环上引入供电子的甲氧基或吸电子的氯均会导致活性的降低,但向对位引入氟原子(41c, IC50: 0.059 μmol/L)则会略微提高活性。
3.2 C-2位修饰
喹诺酮C-2位的取代基与DNA-促旋酶结合位点相近,故向此位点引入大取代基往往会导致活性的降低,故目前对此位点的修饰较少。从海绵Homophymia sp.中分离所得的天然产物2-十一烷基-4-喹诺酮42(图10)对HIV-1的IC50仅为3 nmol/L,可作为先导物进一步研究。
反式转录激活因子(Tat)是HIV-1在感染早期产生的一种重要调节蛋白,可与病毒新生RNA的反式激活应答区(TAR)相互作用,在病毒复制和感染致病中起重要作用。Tat-TAR相互作用对病毒基因的表达、复制和致病性必不可少,故抑制该相互作用可起到抗病毒效果。2-苯基喹诺酮43可在体外高效的抑制Tat/TAR复合体,故这类化合物可能是潜在的抗HIV候选物。化合物44a (IC50: 35 μg/mL)和44b(IC50: 35 μg/mL)对急性感染HIV的H9淋巴细胞具有中等强度的活性,治疗指数分别为2.9和5.4,可进一步研究。
3.3 C-3和C-4位修饰
4-喹诺酮的4-氧代-3-羧酸结构单元可与DNA促旋酶结合位点形成氢键,对此位点进行修饰往往会导致生物活性的降低,但向C-3位引入可在体内转化为羧酸的前体基团则可耐受。

图7 N-1位含有烷基或环烷基的4-喹诺酮衍生物28~33的化学结构
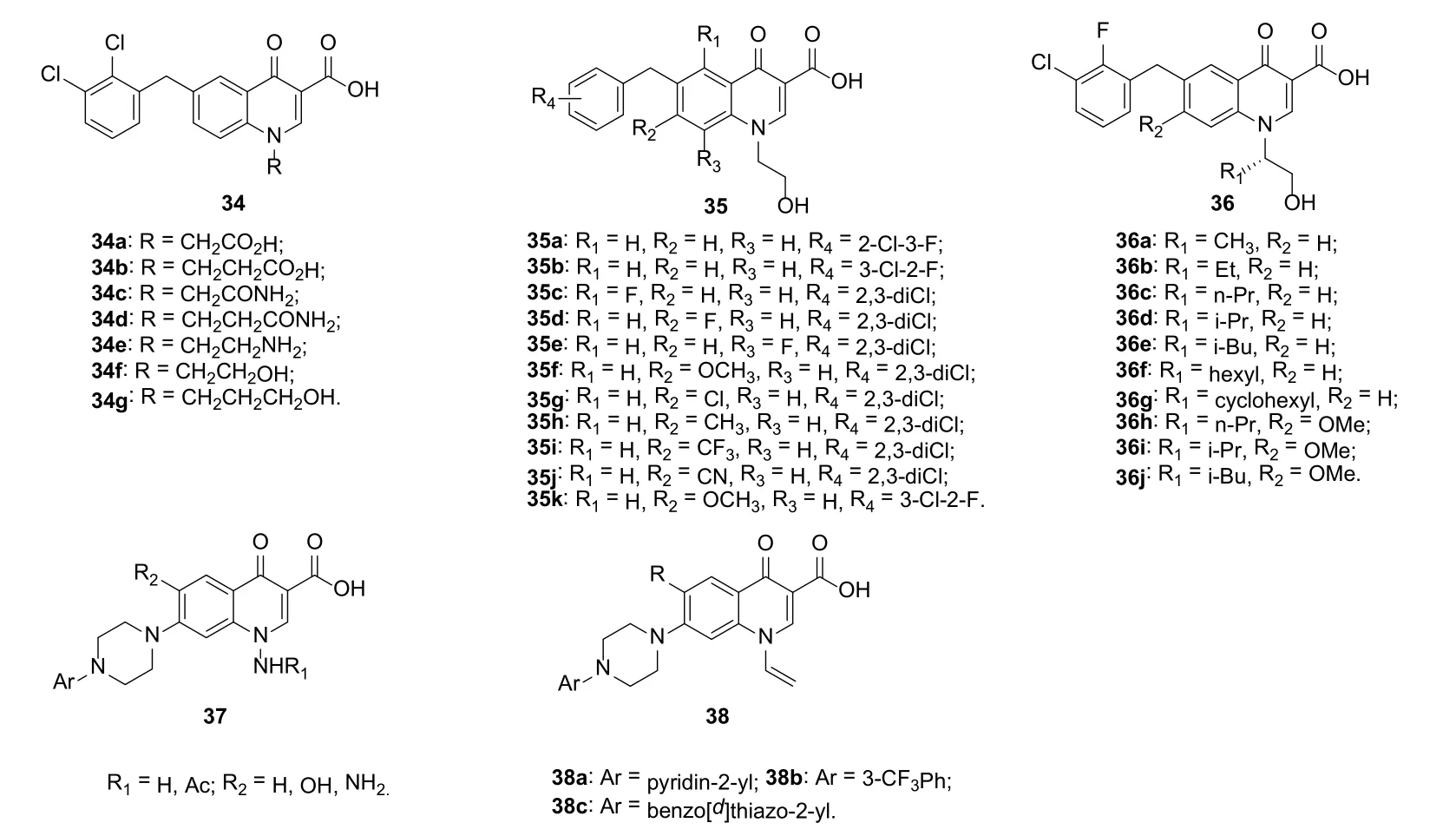
图8 N-1位含有烷基或环烷基的4-喹诺酮衍生物34~38的化学结构
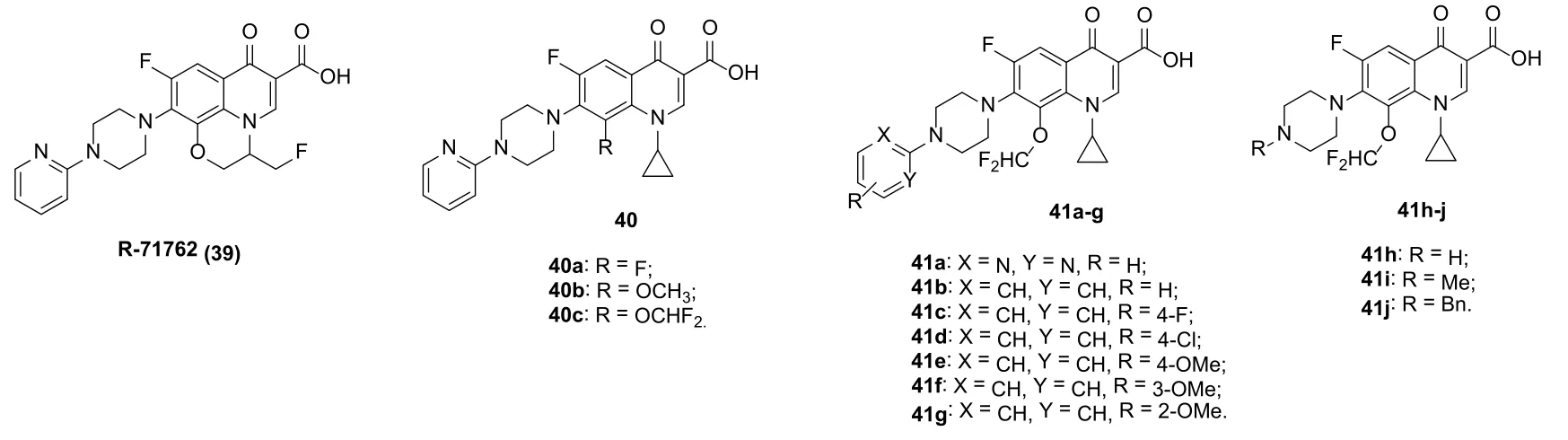
图9 C-8位修饰的4-喹诺酮衍生物39~41的化学结构
对喹诺酮-酰腙杂合体45(图11)的体外抗HIV-1 (PBMC细胞)和单纯疱疹病毒 (HSV)研究结果表明,三者具有潜在的抗HIV活性,EC50分别为3.4,100和56 μmol/L。4-喹诺酮-1,3,4-噁二唑杂合体46抗HIVSAR显示,R位为小体积取代基如甲基、乙基和丙基时,杂合体未显示出任何抗HIV-1活性,而R位为大体积苄基或取代苄基时显示出一定的活性(在浓度为100 μmol/L时的抑制率为20~57%)。苄基上的取代基对活性影响显著,且取代基对活性的贡献顺序为甲基>氟>氯。其中,活性最强的杂合体46e(EC50: 50 μmol/L)未显示出任何细胞毒性(CC50: >100 μmol/L),可作为先导物进一步优化。
洛美沙星-/氧氟沙星-叠氮胸苷杂合体47a和47b可抑制合胞体形成、阻止HIV-1诱导的MT24细胞裂解效应,对HIV-1IIIB(C1866细胞)和HIV-1KM018(PBMC细胞)临床分离株的EC50低至6.5, 3.1 nmol/L和1.9, 36 nmol/L,活性是母药叠氮胸苷(EC50: 25 nmol/L和299 nmol/L)的3.8~157.3倍。不仅如此,二者对金葡球菌的活性与洛美沙星和氧氟沙星相当。显然,二者具备进一步研究价值。
向药物分子中引入金属离子往往会对其生物活性有显著影响,且某些金属螯合物如二茂铁喹显示出成为新药的潜力,故药物金属螯合物引起了科学家的极大兴趣。研究显示,向喹诺酮4-氧代-3-羧酸结构单元嵌入金属离子是喹诺酮发挥抗生物活性的关键步骤,故喹诺酮金属螯合物可能是潜在的抗HIV候选物。钌(II)芳烃具有潜在的抗HIV活性,4-喹诺酮-钌(II)芳烃48及其配体可在纳摩尔水平有效抑制HIV-1 IN,且对ST催化步骤具有选择性。螯合物48对HIV IN ST的IC50为17 μmol/L,活性高于配体(IC50:3.1 μmol/L)。喹诺酮-镁(49a)和锰(49b)螯合物对HIV IN ST也具有良好的抑制活性,IC50分别为4和2 μmol/L,提示金属离子对活性影响巨大。
C-3位为无取代、乙酰基、羧酸及甲酯的4-喹诺酮衍生物50对IN-LEDGF/p75 蛋白质相互作用无明显活性,但含羟基的衍生物51a,b对HIV-1 RT, HIV-2 RT和MuLV RT具有潜在的活性,IC50为0.31~>225 μmol/L,这可能是由于羟基可与相应的酶形成氢键所致。大多数喹诺酮二酮酸衍生物52对HIV-1无活性,但个别化合物52a~c具有显著活性,EC50分别为4.1, 3.2和0.17 μmol/L。
3.4 C-5和C-6位修饰
据报道,4-喹诺酮C-5位取代基对抗菌活性有中等强度的影响,且该位点对氢、氨基、氟、羟基和甲基耐受,但氢最优。对喹诺酮的C-6位而言,可向该位点引入氟、氨基和取代苄基等,其中氟原子可提高该类化合物细胞膜渗透性,故C-6位氟原子为抗菌药物最常见基团。
对从Melochiaodorata分离获得的4-喹诺酮生物碱53a~c(图12)的抗HIV活性评价结果表明,化合物53a,b具有潜在的抗HIV活性,而53c则未显示出任何活性。其中,代表物53a在浓度为0.95 μmol/L时可抑制50%的HIVP24形成。
某些C-6位为氢、氟、三氟甲基、甲氧基、氨基和羟基的4-喹诺酮衍生物54和55对HIV-1IIIB和HIV-2ROD具有良好的抑制活性,EC50为<1 μg/mL。SAR表明,三氟甲基不适合C-6位,但当C-7位的4-芳基哌嗪基合适时,C-6位对甲氧基和羟基耐受,提示C-6位取代基需和C-7取代基合理搭配才能获得高抗HIV活性化合物。其中,化合物55k的活性最高,其对HIV-1IIIB和HIV-2ROD(MT-4细胞)的EC50分别为80和33 nmol/L,不亚于奈韦拉平(EC50: 23和>4,000 nmol/L)。而化合物55l (MW5)对从头感染人淋巴母细胞内的HIV也具有良好的活性,EC50为100 nmol/L。进一步研究显示,MW5对HIV-1慢性和急性感染细胞具有良好的活性,EC50分别为600和850 nmol/L。此外,MW5对可有效抑制TAR RNA,值得进一步研究。化合物55m (HM-12)和55n (HM-13)对HIV-1慢性和急性感染人M/M细胞的活性较高,EC50分别为50,25和50, 11 nmol/L。用环丙基代替N-1位甲基所得的化合物56也具有良好的活性,其中,代表物56b可在EC50为5.6 ng/mL时抑制OM-10.1胞内HIV复制。
6-氨基喹诺酮57显示出潜在的抗HIV活性,如化合物57a~d对HIV-1IIIB和HIV-2ROD(MT-4, PBMCs和CEM细胞)的EC50为0.0087~0.7μg/mL。SAR显示,这类化合物的活性与多个位点取代基相关:C-7位取代基对活性影响巨大,且4-(吡啶-2-基)-1-哌嗪基对活性最优;N-1位的甲基可被环丙基代替,但再大体积的基团如叔丁基对活性不利;C-3位的羧基是抗HIV活性所必需,将其替换为酰胺、酮或肟基均会导致活性的消失。其中,活性最高的化合物57d对HIV-1IIIB和HIV-2ROD(MT-4, PBMCs和CEM细胞)的EC50为8.7~43 nmol/L,具备治疗HIV-1和HIV-2感染的潜力。
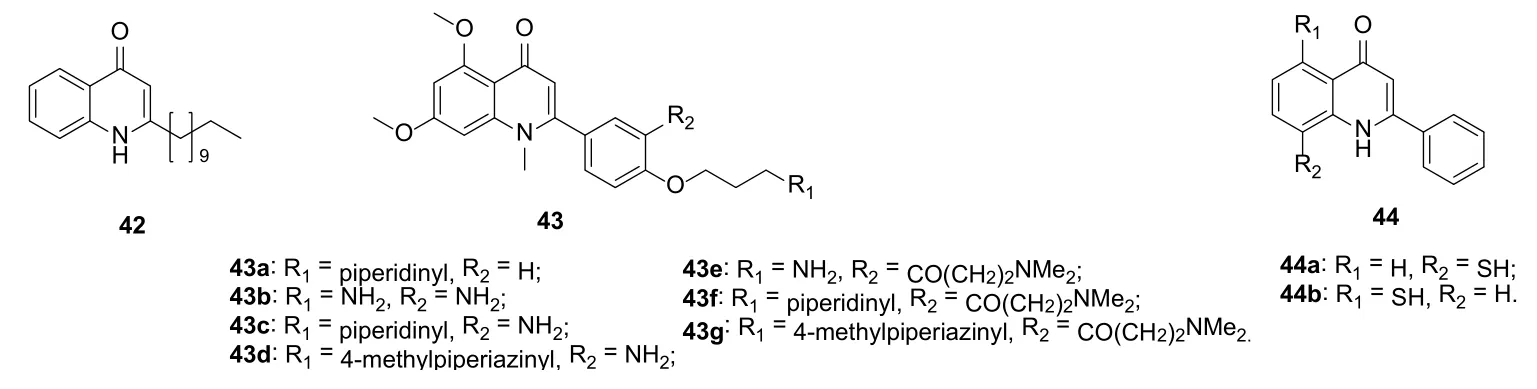
图10 C-2位修饰的4-喹诺酮衍生物42~44的化学结构
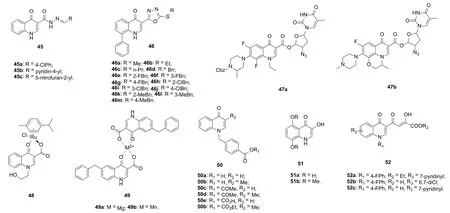
图11 C-3和C-4位修饰的4-喹诺酮衍生物45~52的化学结构
6-亚氨基喹诺酮58 (EC50: >100 μmol/L)对HIV-1未显示出明显活性,提示该位点不适宜引入亚氨基。然而,该位点对醚(59)和烯基(60)耐受,且羧酸衍生物59b和60b (EC50: 1和5 μmol/L)的活性优于相应的乙酯59a和60a (EC50: 13和>140 μmol/L)。
3.5 C-7位修饰
喹诺酮C-7位取代基与生物活性、生物利用度和安全性息息相关,且该位点被认为是最适合修饰的位点。研究显示,向C-7位引入大体积官能团并不会影响喹诺酮对细胞膜的渗透性,故可向此位点引入各种取代基或药效团。
靛红具有多种生物活性,而4-喹诺酮-靛红杂合体具有抗菌、抗结核、抗肿瘤和抗HIV等活性,值得进一步研究。Sriram等评价了一系列氟喹诺酮-靛红杂合体的抗菌、抗结核、抗HCV和抗HIV活性,发现大多数杂合体具有潜在的抗HIV活性。SAR显示,靛红C-3和C-5位取代基对抗HIV活性有显著影响。对氟喹诺酮-靛红-甲氧苄啶杂合体61(图13)而言,氟喹诺酮母核对活性的贡献顺序为诺氟沙星(61a和61k, EC50: 12.1和11.3μmol/L) >环丙沙星(61b, 61e和61g, EC50: 17.9, 9.4和11.6 μmol/L) >加替沙星(61c和61i, EC50: 25.2和21.2 μmol/L) >洛美沙星(61d, 61f和61h, EC50: 57.1, 17.2和28.4 μmol/L),而靛红C-5位取代基对活性的影响顺序为氯>溴>氟>甲基>氢。诺氟沙星-/环丙沙星-/加替沙星-/洛美沙星-靛红-磺胺嘧啶杂合体62 (EC50>48 μmol/L, CEM细胞)和诺氟沙星-靛红-磺胺多辛杂合体63 (EC50>34 μmol/L)未显示出明显的抗HIV-1活性,提示靛红C-3位取代基对活性影响显著。
向靛红的C-3位引入氨基脲或氨基硫脲(64, EC50:>12 μmol/L, CEM细胞)对抗HIV活性不利,但向氨基脲或氨基硫脲结构片段引入羟基(65, EC50: 4.18~33.38 μmol/L, MT-4细胞)和甲氧基(66, EC50: 1.86~19.15 μmol/L, MT-4细胞)则可增强活性。SAR研究结果表明,氟喹诺酮-靛红-氨基硫脲杂合体66的活性优于相应的氨基脲杂合体65,提示氨基硫脲结构片段中的甲基对高活性至关重要。氟喹诺酮母核和靛红C-5位取代基对活性的贡献顺序分别为加替沙星>洛美沙星>环丙沙星≈ 诺氟沙星和氟≈甲基>氯。代表物66k,l(EC50: 1.88和1.86 μmol/L) 还具有良好的抗结核活性(对MTB H37Rv的MIC分别为0.15和0.31 μmol/L)和较低的毒性(CC50: 170.51和154.06 μmol/L),值得进一步开发。诺氟沙星-靛红-氨基硫脲杂合体67也具有潜在的抗HIV活性,EC50为3.12 μmol/L,但弱于依法韦仑(EC50: 0.78 μmol/L)。
诺氟沙星-靛红-胺基嘧啶氨杂合体68(EC50: 11.2,9.4和14.9 μg/mL, MT-4细胞)显示出潜在的抗HIV活性,其中,化合物68b对HIV-1 (EC50: 9.4 μg/mL), MTBH37Rv(MIC: 3.13 μg/mL)和各种致病菌(MIC: 0.009~4.88 μg/mL)具有广谱活性,具有治疗HIV机会感染的潜力。氟喹诺酮-靛红-拉米夫定杂合体69a~c (EC50: 1.11,49.0和1.16 μmol/L, CEM细胞)显示出较高的抗HIV-1活性,但弱于母药拉米夫定(EC50: 0.1 μmol/L)。

图12 C-5和C-6位修饰的4-喹诺酮衍生物53~60的化学结构
诺氟沙星-/环丙沙星-/加替沙星-/洛美沙星-四环素杂合体70a~d(图14)(EC50: 7.58~20.2 μmol/L,CEM细胞)具有潜在的抗HIV-1IIIB活性,而绝大多数土霉素则为显示出明显活性。这类杂合体(IC50: 12-65 μmol/L)对HIV-1 IN3'-P和ST显示出中等前度的活性,且高于四环素(IC50: 204和188 μmol/L)。杂合体70i抑HIV-1复制的EC50为5.2 μmol/L,对CEM细胞无毒(CC50: 200 μmol/L),对MTB H37Rv的MIC为0.2 μg/mL,对HIV-1 IN3'-P和ST(IC50: 20和18 μmol/L)的活性也较高,值得进一步研究。诺氟沙星-/环丙沙星-司他夫定杂合体71a,b (EC50: 100.0和61.8 μmol/L,CEM细胞)显示出中等强度的抗HIV活性,但远逊于母药司他夫定(EC50: 0.09 μmol/L)。对氟喹诺酮-叠氮胸苷杂合体的抗HIVSAR研究结果表明,杂合体的连接方式对活性影响显著:通过C-3位羧酸连接的杂合体73 (EC50: 1.2~33 nmol/L, CEM细胞)的活性优于通过C-7位哌嗪基连接的72 (EC50: 3.87~9.31 μmol/L,CEM细胞)。值得一提的是,代表物73c,e (EC50: 1.8和1.2 nmol/L)对HIV-1IIIB的活性极高, 是对照药叠氮胸苷(EC50: 27 nmol/L)的15和22.5倍。不仅如此,二者对MT-4 (CC50: 45.04和34.05 μmol/L)和C8166 (CC50:>272.22和>219.81 μmol/L)的毒性较低,可作为先导物进一步研究。
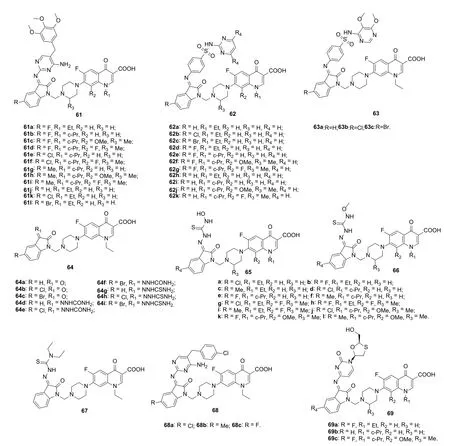
图13 氟喹诺酮-靛红杂合体61~69的化学结构
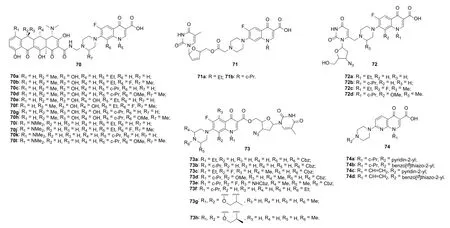
图14 4-喹诺酮-杂合体70~74的化学结构
萘啶酮-吡啶/苯并噻唑杂合体74对HIV-1IIIB的在微摩尔级,且苯并噻唑杂合体74b(EC50: 0.05 μmol/L, MT-4细胞)的活性优于相应的吡啶杂合体74a(EC50:>8.32 μmol/L)。进一步研究显示,N-1位取代基对抗病毒活性也有一定影响,且含有乙烯基的杂合体74c,d(EC50: 0.16和0.02 μmol/L)对HIV-1IIIB的活性优于环丙基衍生物74a,b。不仅如此,杂合体74c,d(EC50:0.21和0.025 μmol/L)对HIV-2ROD也具有高度的活性,值得深入开发。
喹诺酮衍生物75(图15)(IC50: 8 nmol/L)抑HIV-1 IN ST的活性极高,而萘啶酮衍生物76则对HIV-1 IN的抑制活性极强,EC50为0.9~16 nmol/L。SAR显示,氢键供体羟基的存在对活性有利。活性最高的化合物76e (EC50: 0.9 nmol/L)可作为先导物进一步优化。
化合物77 (K-12)对多种HIV-1 (耐叠氮胸苷株和耐利托那韦株), HIV-2和猿猴免疫缺损病毒(MT-4,CEM, C8166和外周血单核细胞)具有良好的活性,且活性相近,EC50为0.2~0.6 μmol/L,值得进一步开发。对喹诺酮二酮酸78的抗HIV-1 SAR研究结果显示,C-7位取代基对活性有明显影响,且顺序为吡咯烷基>吗啡啉基>哌嗪基。有趣的是,乙酯化合物优于相应的羧酸。所有衍生物(IC50: 0.028~28.7 μmol/L)对HIV-1 IN和RNase H均显示出良好的抑制活性,其中,化合物78j和78k可选择性的抑制HIV-1 IN ST,IC50<100 nmol/L。
4 结束语
AIDS/HIV严重威胁人类健康,每年上百万患者因此丧命。HARRT可极大地延长HIV患者的寿命,但耐多药HIV的出现和HAART存在不能从体内彻底清除HIV病毒等缺陷,使得研发新型抗HIV药物势在必行。
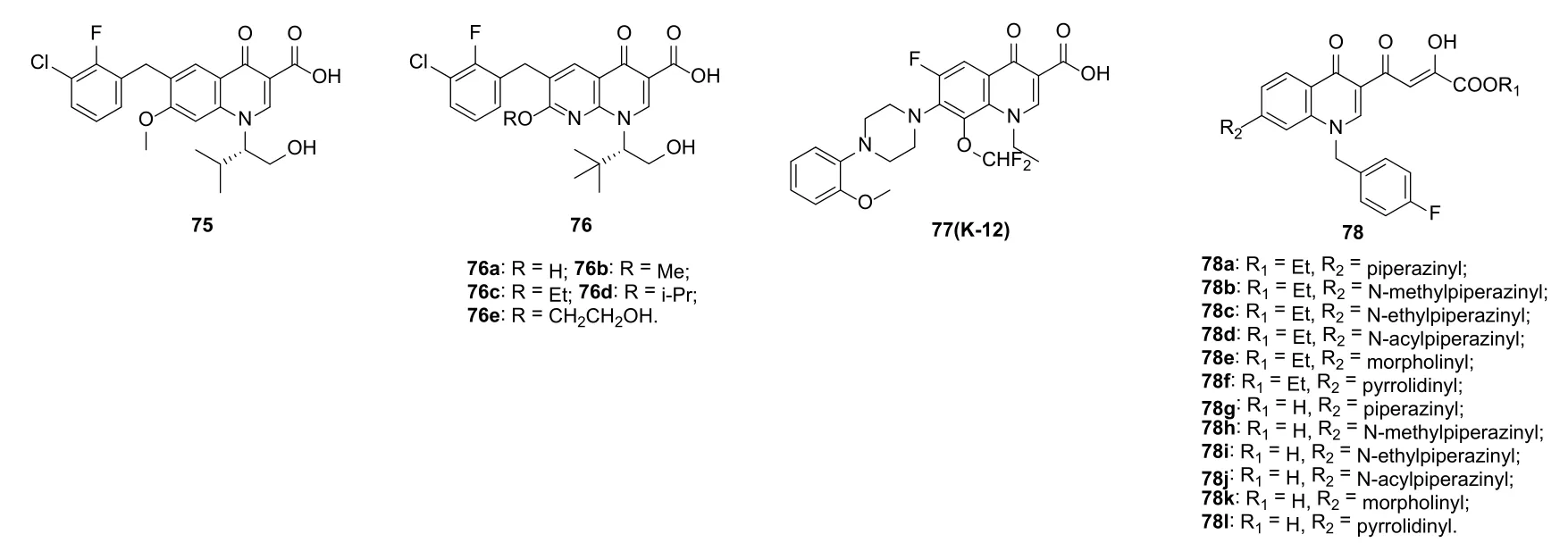
图15 4-喹诺酮-杂合体75~78的化学结构
喹诺酮具有包括抗HIV等在内的多种生物活性,且首个喹诺酮类HIV整合酶抑制剂埃替格韦已被批准用于HIV患者的治疗,提示对喹诺酮进行合理的修饰极有可能会获得潜在的抗HIV活性候选物。近30年来,科学家有针对性的设计合成了众多喹诺酮衍生物,并评价了它们的抗HIV活性,发现了若干具有进一步研究价值的候选物如2-喹诺酮6o, 7c和18f及4-喹诺酮31c, 55k, MW5, HM-12和HM-13对HIV-1, 突变HIV-1和HIV-2的EC50在纳摩尔级,而化合物66k, 66l和68b不仅对HIV具有良好的活性,对HIV机会感染也显示出优秀的活性,值得进一步开发。
本文综述了近年来喹诺酮类化合物在抗HIV领域的研究进展,并归纳构-效关系(图16),以启迪药物化学家进一步合理设计此类化合物。
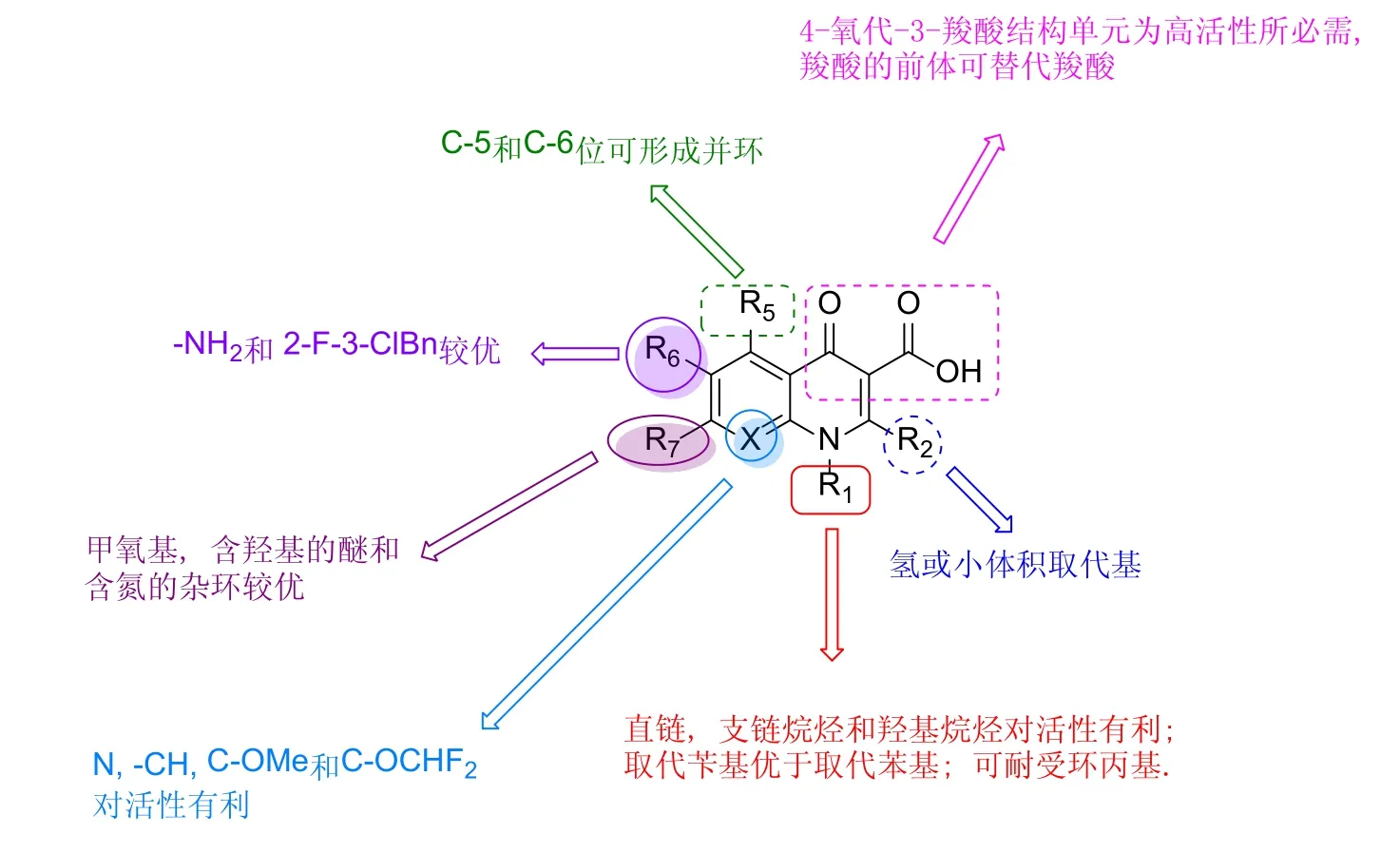
图16 4-喹诺酮衍生物抗HIV的SAR

