氟喹诺酮-靛红杂合体及其生物活性
吕凯,冯连顺 编写 刘明亮,郭慧元 审校
(中国医学科学院医药生物技术研究所,北京 100050)
1 前言
氟喹诺酮类抗生素是临床上使用最为广泛的一类抗感染化疗药物之一,对上呼吸道和下呼吸道感染、性传播疾病和社区获得性肺炎等有良好的疗效。氟喹诺酮的结构特征为C-3位含有一个羧基、C-4位为羰基、C-6位为氟原子和C-7位为碱性的氮杂环,典型的氟喹诺酮见图1所示。除经典的抗菌活性外,氟喹诺酮还具有抗肿瘤、抗结核、抗疟疾和抗人类免疫缺陷病毒等多种非经典生物活性,在药物研发领域占据重要位置。
靛红(见图2)又称吲哚满二酮广泛存在于自然界中,其中,某些靛红衍生物如司马沙尼、舒尼替尼和尼达尼布等目前已应用于临床或处于临床研究阶段。因此,靛红也是药物化学领域常见的药效团。
与母药相比,杂合体具有生物活性谱更广、活性更高和毒性更低等诸多优点。经过20余年的发展,多个杂合体如Ro 23-9424、oraquin(MCB3837)、CBR-2092和TD-1792已进入临床研究阶段,有望于不久的将来服务于人类。因此,杂合体策略引起了人们的极大关注。
近年来,药物化学家设计、合成和评价了多种氟喹诺酮-靛红杂合体的生物活性,发现了若干具有进一步研究潜力的苗头物。本文综述了氟喹诺酮-靛红杂合体在抗菌、抗结核、抗病毒和抗肿瘤领域的最新研究进展,并归纳了构-效关系(SAR),以启迪科学家更合理的设计此类杂合体。
2 抗菌活性
由革兰阳性菌和阴性菌引起的感染是院内和社区常见感染,严重威胁人类健康。更为严重的是,耐药菌的不断涌现和广泛传播,使得临床医生面临无药可选的窘境。据估计,每年约有70万人死于与耐药菌相关的疾病,且这一数字还在持续增长。氟喹诺酮和靛红均具有潜在的抗菌活性,故氟喹诺酮-靛红杂合体是研发对药敏型和耐药型致病菌均有效的新型候选物的良好选择。
环丙沙星-/洛美沙星-靛红杂合体1a-d(见图3)对所测的伤寒沙门菌、大肠埃希菌、 霍乱弧菌、金黄色葡萄球菌/金葡球菌、表皮葡萄球菌/表葡球菌、肺炎克雷伯菌、铜绿假单胞菌、福氏志贺菌和柠檬酸杆菌等具有良好的活性,最小抑制浓度(MIC)为0.10~2.50 μg/mL,活性与母药环丙沙星和洛美沙星(MIC: 0.10~2.50 μg/mL)相当。SAR表明,环丙沙星-靛红杂合体1a,b (MIC: 0.10~0.50 μg/mL)的活性优于相应的洛美沙星杂合体1c,d (MIC: 0.25~2.50 μg/mL),且向靛红的C-5位引入甲基对活性不利。
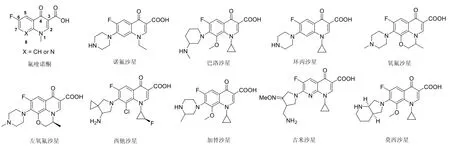
图1 典型的氟喹诺酮的化学结构
诺氟沙星-靛红杂合体2对迟缓爱德华菌、甲型副伤寒沙门菌、霍乱弧菌、表葡球菌、福氏志贺菌、类志贺毗邻单胞菌、雷特格变形杆菌、枯草芽胞杆菌和嗜水气单胞菌的活性优于母药诺氟沙星。SAR显示,靛红C-3和C-5位的取代基对抗菌活性有显著影响:与酮类杂合体相比,向C-3位引入硫脲、甲氧苄啶、磺胺嘧啶和磺胺多辛对活性有利,且甲氧苄啶>磺胺嘧啶>磺胺多辛;向C-5位引入卤原子氯和溴可提高这类杂合体的抗菌活性。对杂合体2l,m,r(大肠埃希菌NCTC 10418感染小鼠模型, 口服)的体内抗菌活性和急性毒性研究结果表明,杂合体2m和2r (ED50: 1.25和1.62 mg/kg)的体内活性分别是诺氟沙星(ED50: 6.0 mg/kg)的4.8和3.7倍,且杂合体2m(LD50:>4,000 mg/kg)的急性毒性低于诺氟沙星(LD50: 4,000 mg/kg),值得深入研究。
含有甲氧苄啶结构单元的诺氟沙星-/环丙沙星-/加替沙星-/洛美沙星-靛红杂合体3可同时作用于叶酸还原酶(甲氧苄啶的作用靶点)和DNA促旋酶(氟喹诺酮的作用靶点),对多种临床致病菌具有良好的活性。SAR研究发现,氟喹诺酮的种类与体外抗菌活性息息相关,且对革兰阳性菌而言,洛美沙星>环丙沙星>加替沙星>诺氟沙星,对革兰阴性菌而言,环丙沙星>加替沙星>诺氟沙星>洛美沙星。在感染大肠埃希菌NCTC 10418的小鼠模型中,杂合体3b-f (ED50: 0.62,1.25, 1.87, 0.62和1.25 mg/kg)和3h,i (ED50: 0.62 and 1.87 mg/kg)的体内活性优于母药诺氟沙星、环丙沙星和洛美沙星(ED50: 6.0, 1.25和1.87 mg/kg)。其中,杂合体3b和3h具有广谱抗菌活性,值得深入研究。
Prakash等测定了环丙沙星-靛红杂合体4的体外抗菌活性,发现这类杂合体的抗菌活性普遍低于母药环丙沙星。SAR研究表明,苯基上的取代基在间位时优于邻位,且供电子基如羟基和甲氧基对活性有利,而吸电子基对活性不利。

图2 靛红、司马沙尼、舒尼替尼和尼达尼布的化学结构
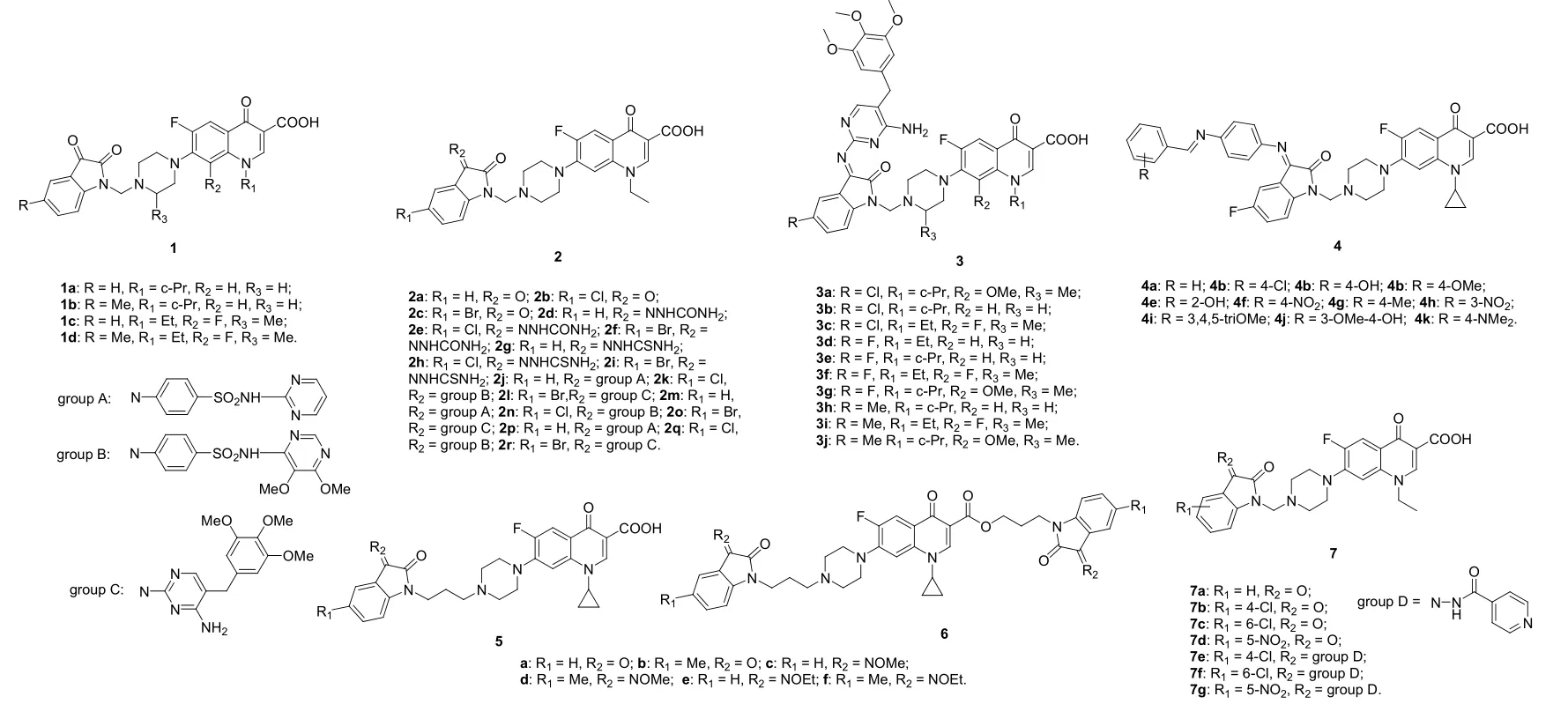
图3 具有抗菌活性的氟喹诺酮-靛红杂合体1-7的化学结构
对次丙基连接的单/双靛红-环丙沙星杂合体5a-f和6a-f的体外抗菌活性研究结果表明,单靛红-环丙沙星杂合体5a-f对所测8株革兰阳性菌(MIC: 0.125~64 μg/mL)和15株阴性菌(MIC: ≤0.03~2.0 μg/mL)具有良好的活性。其中,杂合体5d对包括耐甲氧西林金葡球菌(MRSA)和耐甲氧西林表葡球菌(MRSE)在内的多种耐药型和药敏型革兰阳性菌(MIC: 0.125~8 μg/mL)和阴性菌(MIC: ≤0.03~0.5 μg/mL)的活性与环丙沙星和左氧氟沙星相当或更优。SAR显示,单靛红-环丙沙星杂合体5a-f的抗菌活性明显高于相应的双靛红衍生物6a-f(MIC: 4~>128 μg/mL),提示C-3位的羧基对高活性而言不可或缺。向靛红的C-3位引入烷氧亚胺基可提高活性,且甲肟>乙肟>酮。与相应的C-5位无取代杂合体相比,甲基的引入对抗菌活性有利。次丙基相连的单/双靛红-加替沙星/-8-甲氧基环丙沙星杂合体也具有类似的结果。对杂合体5b和5d (50 mg/kg, 口服)的代谢稳定性和体内药代动力学性质研究结果表明,二者分别在1.3和1.2 h达到最大血药浓度(Tmax),最大血药浓度(Cmax)为1228 和832 ng/mL,半衰期(t1/2)为4.1和3.3 h,药时曲线下面积(AUC)为4988和2865 ng·h/mL。总体而言,二者的代谢稳定性和体内药代动力学性质劣于母药环丙沙星(Tmax: 1.8 h,t1/2: 5.2 h, Cmax: 3129 ng/mL和AUC: 17835 ng·h/mL),仍需进一步修饰。此外,诺氟沙星-靛红杂合体7a-g对绝大多数所测致病菌的活性略优于母药诺氟沙星,但并未有极大提高。
3 抗结核活性
结核病(TB)是由结核分枝杆菌(MTB)引起的传染性疾病,是全球第九大致死性疾病。耐药TB (DRTB)包括耐多药TB (MDR-TB)、广泛耐药TB (XDRTB)和完全耐药TB (TDR-TB)及MTB的新变种是导致TB疫情在世界范围内再度爆发的主要原因。因此,有必要研发起效快、耐受性良好、疗程短和对敏感型和耐药型MTB尤其是MDR-TB、XDR-TB、TDRTB和难治性变种均有效的抗TB新药。
氟喹诺酮的作用靶点为II型拓扑异构酶即DNA促旋酶和拓扑异构酶IV,研究证实MTB基因组并不含拓扑异构酶IV parC和parE基因同系物,故DNA促旋酶可能是这类化合物对MTB的唯一作用靶点。某些早期的氟喹诺酮如环丙沙星、氧氟沙星和左氧氟沙星等已被世界卫生组织推荐作为二线抗TB药物治疗耐药TB和对一线抗TB药物不耐受患者。此外,总体而言,对异烟肼和利福平均耐药的临床MTB分离株对氟喹诺酮依然敏感。由此可见,氟喹诺酮是研发抗TB新药的良好选择。
氟喹诺酮的脂溶性对这类化合物渗透MTB细胞壁进入作用靶点至关重要,故适当增大这类化合物的脂溶性可能会提高其抗TB活性。靛红类化合物也具有潜在的体内外抗TB活性,且将靛红引入至氟喹诺酮可达到提高脂溶性的目的,故氟喹诺酮-靛红杂合体可能具有更高的抗TB活性。
Sriram等评价了氟喹诺酮-靛红杂合体3的抗TB活性,发现所有杂合体对MTB H37Rv均具有优秀的活性,MIC为0.78~3.13 μg/mL。某些杂合体如 3e(MIC: 0.78 μg/mL)的活性优于乙硫异烟胺、乙胺丁醇、环丙沙星和卡那霉素(MIC: 2.5, 1.88, 2和5 μg/mL),但均弱于异烟肼和利福平(MIC: 0.05和0.125 μg/mL)。在MTB感染小鼠模型中,与安慰剂组(Log CFU/Lung: 8.78和Log CFU/Spleen: 6.84)和环丙沙星组(Log CFU/Lung: 6.82 和Log CFU/Spleen: 4.64)相比,杂合体3e (Log CFU/Lung: 5.26和Log CFU/Spleen: 4.08)可显著的降低肺部和脾组织中的细菌负载量。
除8l (MIC: 10.82 nmol/L,见图4)外,环丙沙星-靛红杂合体8 (MIC: 1.21~3.09 nmol/L)对MTB H37Rv的活性均优于母药环丙沙星(MIC: 6.04 nmol/L)。其中,5个杂合体8a,g-i,k (MIC: 1.21-1.59 nmol/L)的活性还优于莫西沙星(MIC: 1.94 nmol/L)。体内毒性测试结果表明,即使杂合体8h的给药剂量高达 1000 mg/kg,仍未见明显的毒副作用,提示这类杂合体安全性良好。在小鼠体内模型中,与安慰剂组(Log CFU/Lung: 8.78和Log CFU/Spleen: 6.84)相比,杂合体8h可降低脾组织(Log CFU: 6.08)的细菌负载量,但遗憾的是,该化合物在肺组织(Log CFU: 9.26)中未显示出任何活性。
加替沙星-靛红杂合体9 (MIC: 0.0125~0.78 μg/mL)对MTB H37Rv和MDR-TB均显示出良好的活性,对MDR-TB的活性是加替沙星(MIC: 3.12 μg/mL)的4~64倍,其中的4个杂合体9a,f,o,p (MIC: 0.05~0.1 μg/mL)对MTB H37Rv的活性也优于加替沙星(MIC: 0.2 μg/mL)。代表物9a (MIC: 0.0125和0.05 μg/mL)在浓度为 62.5 μg/mL时对VERO细胞系仍未显示出细胞毒性,选择性指数(IC50/MIC) >1250。在MTB感染的CD-1小鼠模型中,杂合体9a (Log CFU/Lung: 4.26和Log CFU/Spleen: 5.08)可分别降低3.62-和3.76-log10单位肺组织和脾组织 细菌负载量,在相同剂量(50 mg/kg)下优于加替沙星(Log CFU/Lung: 5.82和Log CFU/Spleen: 6.14)。
次乙基连接的巴洛沙星-靛红杂合体10的脂溶性明显高于母药巴洛沙星,但对耻垢分枝杆菌和枯草分枝杆菌活性的活性弱于母药。次乙基连接的加替沙星-靛红杂合体也具有类似的结果。然而,杂合体10g-j (MIC: <0.5~8 μg/mL)对MDR-TB 09710临床分离株的活性优于巴洛沙星(MIC: 16 μg/mL)。代表物10h(MIC: 0.25和<0.5 μg/mL)对MDR-TB 09710和MTB H37Rv的活性与莫西沙星(MIC: 0.25和<0.5 μg/mL)相当,而是巴洛沙星(MIC: 16和8 μg/mL)的>32倍。以上结果说明,脂溶性并非影响此类杂合体抗TB活性的唯一因素。SAR表明,靛红C-3位亚胺基对活性的贡献顺序为乙肟>硫脲>羟肟>脲。对一系列次甲基和次乙基连接的8-甲氧基环丙沙星-/莫西沙星-靛红杂合体11和12的体外抗耻垢分枝杆菌、MTB H37Rv和MDR-TB 09710临床分离株的活性评价结果表明,所有莫西沙星-靛红杂合体(MIC: 0.39~>16 μg/mL)对所测所有菌株的活性均弱于莫西沙星(MIC: 0.1~1.0 μg/mL),但某些8-甲氧基环丙沙星-靛红杂合体对MTB H37Rv和MDR-TB 09710临床分离株的活性则高于8-甲氧基环丙沙星、环丙沙星、异烟肼和利福平。SAR显示,次甲基连接的杂合体活性高于相应的次乙基连接衍生物,提示连接子对活性而言至关重要。对靛红的C-3位而言,硫脲和脲对活性有利。总体而言,向靛红的C-5位引入氟原子可提高活性,但细胞毒性也随之增强。其中,杂合体11b (MIC: 0.074 μmol/L)对MTB H37Rv的活性是对照药的2~13倍,而杂合体11f和11i-k (MIC: 6.72-7.05 μmol/L)对MDR-MTB 09710的活性则是8-甲氧基环丙沙星的>1.5倍,是环丙沙星、异烟肼和利福平的3.5~>44倍。
次丙基连接的环丙沙星-靛红杂合体5和13也具有良好的抗MTB H37Rv和MDR-TB活性,MIC为0.1~64 μg/mL。除杂合体5f 和13a,b外,所有杂合体的活性均不次于母药环丙沙星。SAR表明,单靛红-环丙沙星杂合体的活性优于双靛红杂合体,而单靛红-加替沙星杂合体14的活性同样优于双靛红-加替沙星杂合体15。对单靛红-环丙沙星杂合体而言,向靛红的C-3位引入亚胺或向C-5位引入甲基均会导致活性的降低。对单靛红-加替沙星杂合体14而言,向靛红的C-3位引入甲肟或向C-5位引入氟原子均对活性有利。其中,单靛红-环丙沙星杂合体5b对MTB H37Rv和MDR-TB的MIC分别为0.1和0.5 μg/mL,对MTB H37Rv的活性是环丙沙星和利福平(MIC: 0.78和0.39 μg/mL)的4和8倍,对MDR-TB的活性是环丙沙星、利福平和异烟肼(MIC: 2.0, 32和>128 μg/mL)的4~>256倍。单靛红-加替沙星杂合体14e对MTB H37Rv和MDR-TB的MIC分别为0.25和0.25 μg/mL,对MTBH37Rv的活性与利福平(MIC: 0.25 μg/mL)相当,而是加替沙星(MIC: 0.5 μg/mL)的2倍,对MDR-TB的活性是加替沙星、利福平和异烟肼(MIC: 1.0, 64和>128 μg/mL)的4~>512倍。
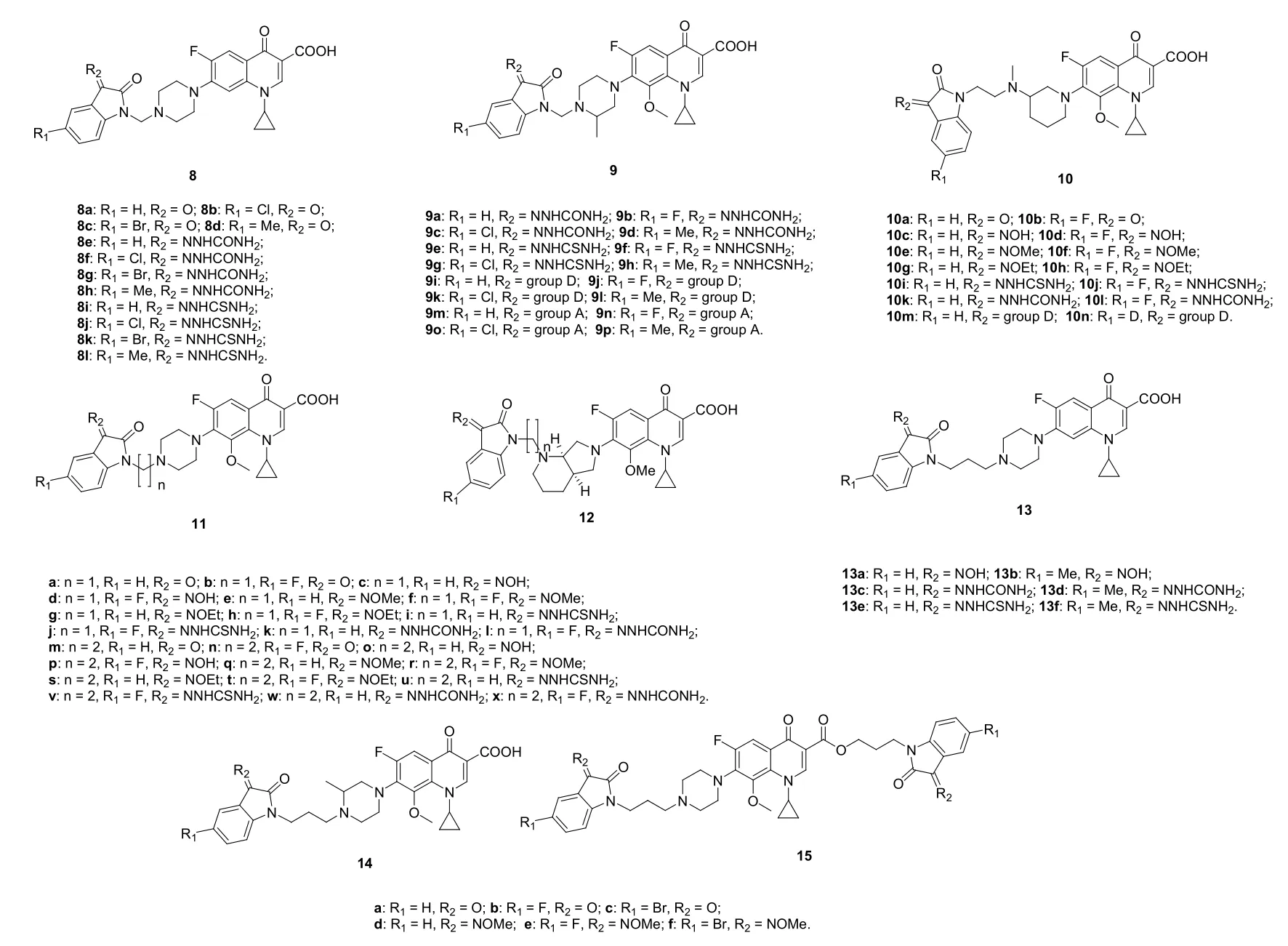
图4 次甲基、次乙基和次丙基连接的具有抗TB活性的氟喹诺酮-靛红杂合体8-15的化学结构
第四代氟喹诺酮莫西沙星具有极高的体内外抗MTB包括MDR-TB临床分离株活性,对不同程度耐氟喹诺酮的MTB也具有良好的活性。目前,莫西沙星正处于治疗TB的III期临床评价中,有望于不久的将来用于TB的治疗。1,2,3-三氮唑可发挥多种非共价键作用,具有广泛的生物活性。某些1,2,3-三氮唑衍生物如I-A09具有良好的体内外抗TB活性,且1,2,3-三氮唑易于合成,故1,2,3-三氮唑可能是良好的连接子。基于此,Xu等评价了一系列次乙基-1,2,3-三氮唑-4-次甲基连接的莫西沙星-靛红杂合体16 (MIC:0.10-0.78 μg/mL,见图5)的体外抗MTB H37Rv和MDR-TB活性,发现所有杂合体的抗MDR-TB活性均优于利福平(MIC: 32 μg/mL)和异烟肼(MIC: >128 μg/mL),但对所测2菌株的活性均不高于母药莫西沙星(MIC: 0.10和0.12 μg/mL)。代表物16f (MIC: 0.10 μg/mL)对MTB H37Rv的活性与莫西沙星相当,而是利福平(MIC: 0.39 μg/mL)的4倍。杂合体16e (MIC: 0.10 μg/mL)对MDR-TB的活性与莫西沙星相当,而是利福平和异烟肼的256和>1024倍。
次乙基-1,2,3-三氮唑-4-次甲基连接的加替沙星-靛红杂合体17 和8-甲氧基环丙沙星杂合体18 (MIC:0.025~8 μg/mL)对MTB H37Rv和MDR-TB也具有潜在的活性,其中的某些化合物活性优于加替沙星、利福平和异烟肼。靛红C-3位取代基对活性有较大影响,且贡献顺序为硫脲>脲>甲肟>羰基>乙肟>羟肟。靛红C-5位含卤素如氟和氯时可提高抗MTB H37Rv和MDR-TB活性,而供电子的甲基和甲氧基则对活性不利。其中,含硫脲的加替沙星-靛红杂合体17x (MIC: 0.025 μg/mL)对MTB H37Rv的活性是加替沙星、异烟肼和利福平(MIC: 0.78, 0.05和0.39 μg/mL)的2~32 倍,而杂合体17w (MIC: 0.06 μg/mL)对MDR-TB的活性则是3种对照药(MIC: 1.0~>128 μg/mL)的16~>2,048倍。对8-甲氧基环丙沙星-靛红杂合体18而言,杂合体18h (MIC: 0.20 μg/mL)对MTB H37Rv的活性是环丙沙星、8-甲氧基环丙沙星和利福平(MIC: 3.12, 1.56和0.39 μg/mL)的2~16倍,而杂合体18l (MIC: 0.25 μg/mL)对MDR-TB的活性则是3种对照药(MIC: 2.0~64 μg/mL)的8~256倍。
莫西沙星-靛红杂合体19对MTB H37Rv和MDRTB的MIC为0.05~2.0 μg/mL,弱于杂合体16,提示将靛红与1,2,3-三氮唑之间的连接子由次乙基换成柔性更强的次丙基对活性不利。与次乙基连接的杂合体一样,靛红的C-位含有卤素氟、氯和溴时对活性有利,而供电子的甲基和甲氧基则对活性不利。代表物19k (MIC: 0.05和0.06 μg/mL)对MTB H37Rv的活性与异烟肼(MIC: 0.05 μg/mL)相当,而是莫西沙星和利福平(MIC: 0.39 μg/mL)的2~8倍,对MDR-TB的活性则是莫西沙星、利福平和异烟肼(MIC: 0.12, 32和>128 μg/mL)的2~>2048倍。

图5 1,2,3-三氮唑连接的氟喹诺酮-靛红杂合体16-19的化学结构
值得一提的是,1,2,3-三氮唑连接的氟喹诺酮-靛红杂合体16-19的耐药性指数(RI: MICMDR-TB:MICMTBH37Rv)在1左右,提示此类杂合体可能具有全新的作用机制,具有治疗药敏型和耐药型TB的潜力。
除此之外,某些乙酰基和二乙二醇连接的氟喹诺酮-靛红杂合体也具有潜在的抗TB活性,但绝大多数弱于母药,无进一步研究价值。
氟喹诺酮-靛红杂合体抗TB的SAR见图6,丰富的SAR为进一步研究奠定基础。
4 抗病毒活性
病毒如人类免疫缺陷病毒(HIV)和丙肝病毒(HCV)仍极大的危害人类健康,而氟喹诺酮和靛红具有潜在的抗病毒活性,故值得研究二者杂合体的抗病毒活性。
据世界卫生组织估计,截止到2017年全球共有3690万HIV/AIDS患者,每年新增180万,死亡100万。高效抗逆转录病毒疗法对HIV/AIDS患者的治疗至关重要,但耐药性的产生使得研发新型药物迫在眉睫。氟喹诺酮-靛红杂合体2h,i对人MT-4细胞内的HIV-1具有潜在的活性,EC50为11.3和13.9 μg/mL,选择性指数(SI: CC50/EC50)>5。环丙沙星-/加替沙星-/诺氟沙星-靛红杂合体3a-c不仅对MT-4和CEM细胞内的HIV-1具有良好的抑制活性(22.07%~101%),而且对HCV (85%~108%)的活性也较高。氟喹诺酮-靛红杂合体20(见图7)对MT-4和CEM细胞内的HIV-1显示出优秀的活性,且对MT-4细胞内HIV-1的活性明显优于CEM细胞内HIV-1活性。其中,杂合体20g 对人MT-4细胞内的HIV-1的EC50为12.1 μg/mL,SI>13。不仅如此,杂合体20g 还具有潜在的抗TB活性(对MTB H37Rv的MIC为1.22 μg/mL)。显然,此类杂合体具有广谱生物活性。
5个氟喹诺酮-靛红-拉米夫定杂合体21对CEM细胞内的HIV-1显示出潜在的活性,代表物21b的活性与拉米夫定相当,EC50为0.0742 μmol/L、CC50为>200 μmol/L,SI为>2100。SAR显示,向靛红的C-5位引入氟原子可提高抗HIV-1活性,氯原子会提高对CEM细胞的细胞毒性。
诺氟沙星-靛红-硫脲杂合体22具有良好的抗HIV活性,EC50为3.12 μmol/L,仅次于依法韦仑(EC50:0.78 μmol/L)。氟喹诺酮-靛红-硫脲杂合体23和24对HIV-1的EC50为1.86~33.38 μmol/L,弱于奈韦拉平和troviridine (EC50: 0.13和0.016 μmol/L)。SAR显示,氟喹诺酮母核对活性有显著影响,且加替沙星>洛美沙星>环丙沙星≈诺氟沙星。靛红C-5位取代基与活性息息相关,且贡献顺序为氟≈甲基>氯。杂合体24的活性优于相应的衍生物23,提示向羟基上引入甲基可提高活性。活性最高的杂合体24l (EC50: 1.86 μmol/L)也具有良好的抗TB (MIC: 0.31 μmol/L)活性和低毒性(CC50: 154.06 μmol/L),值得进一步研究。
5 抗肿瘤活性
肿瘤是仅次于心血管疾病的人类第二大致死性疾病,每年约有1400万人罹患癌症,880万人因此丧命。现有的抗肿瘤药物已不能满足患者日益增长的需求,因此亟需开发新型抗肿瘤药物。氟喹诺酮和靛红都有潜在的抗肿瘤活性,且某些衍生物正处于临床评价阶段或已应用于临床,故合理的搭配氟喹诺酮和靛红可能会进一步提高抗肿瘤活性。
加替沙星-靛红杂合体25(见图8)对58株人白血病、非小细胞肺、结肠、中枢神经系统、黑色素瘤、卵巢、肾、前列腺和乳腺癌细胞系具有潜在抑制活性,半数生长抑制浓度(GI50)为0.269~>100 μmol/L。SAR显示,向靛红的C-3位引入亚胺可增强抗肿瘤活性,且活性顺序为甲氧苄啶>磺胺嘧啶>磺胺多辛。向靛红的C-5位引入卤素如氟、氯和溴对活性有利,且氟最优。杂合体25h对所测58株人肿瘤细胞系的活性最高,GI50为0.305~63.5 μmol/L,对绝大多数肿瘤细胞系的活性与对照药依托泊苷(GI50: 0.221~142.56 μmol/L)相当或更优。
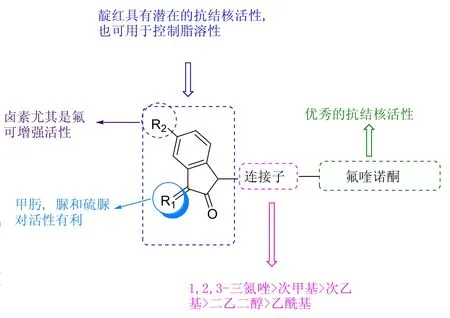
图6 氟喹诺酮-靛红杂合体抗TB的SAR

图7 具有抗病毒活性的氟喹诺酮-靛红杂合体20-24的化学结构
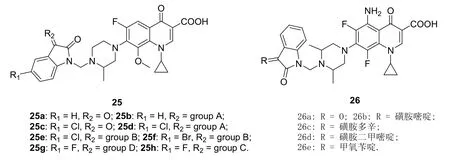
图8 具有抗肿瘤活性的氟喹诺酮-靛红杂合体25和26的化学结构
司帕沙星-靛红杂合体26对人结肠腺癌细胞SW480、人宫颈癌细胞、人肺癌细胞A549和人肝癌细胞HepG2的IC50为18.31~>50 μg/mL,其中,代表物26c对所测4种肿瘤细胞系的IC50为18.31~33.61 μg/mL,值得进一步优化。
6 结束语
与母药相比,杂合体具有生物活性谱更广、活性更高和毒性更低等诸多优点。氟喹诺酮和靛红类化合物均具有多种生物活性,在临床上有着广泛的应用。显然,将氟喹诺酮与靛红杂合是获取新药的有效途径之一。近年来,药物化学家设计合成了众多氟喹诺酮-靛红杂合体,并评价了其生物活性。某些氟喹诺酮-靛红杂合体具有广谱生物活性,值得深入研究。本文综述了氟喹诺酮-靛红杂合体在抗菌、抗结核、抗病毒和抗肿瘤领域的最新研究进展,并归纳了构-效关系,以启迪科学家更合理的设计此类杂合体。

