麦冬多糖的提取工艺优化及其抗氧化活性分析
王莹,王华,赵丽,李屿君
(1.江苏农牧科技职业学院动物药学院,江苏泰州225300;2.南京理工大学泰州科技学院药学院,江苏泰州225300)
麦冬为多年常青草本植物,生长在温暖湿润的地方,主要分布在广东、广西、福建、台湾、浙江、江苏等地。麦冬作为养阴润肺的上品,不仅具有抗疲劳、清除自由基,提高细胞免疫功能以及降血糖的作用,还具有催眠、抗心律失常、促进胰岛细胞功能恢复等作用。麦冬的主要化学成分有甾体皂苷、多糖、氨基酸等[1-2]。麦冬多糖作为麦冬的主要活性成分之一,具有耐缺氧、降血糖、抗炎、抗肿瘤、抗氧化等多种药理作用,广泛应用于食品、医药、化妆品等领域[3-9]。目前,已有文献报道,麦冬多糖对四氧嘧啶所致糖尿病小鼠有降血糖作用并能改善小鼠的耐糖力,并且可提高长期负荷训练大鼠的免疫功能,抑制过氧化损伤和糖原的耗竭,具有良好的开发前景[10-11]。由此可见,寻找一种经济合适的麦冬多糖的提取方法至关重要。目前,已有学者采用水提醇沉法提取多糖,利用响应曲面法和正交设计法优化襄麦冬多糖和山麦冬多糖的工艺参数[12-13],但鲜有采用二次通用旋转设计优化广东麦冬多糖的提取工艺以及抗氧化能力的报道。本文以广东麦冬为原料,采用水提醇沉法提取多糖,以苯酚-硫酸法测定提取物中多糖的含量,采用二次通用旋转组合设计优化提取工艺,并研究麦冬多糖的抗氧化活性,为广东麦冬多糖的开发和利用提供参考依据。
1 材料与方法
1.1 材料与试剂
材料:产自广东省经炮制过的麦冬原料,60 ℃下真空干燥,经多功能粉碎机粉碎,过20 目筛,所得麦冬粉末密封贮藏,备用。
葡萄糖对照品、苯酚(分析纯):国药集团化学试剂有限公司;无水乙醇(分析纯):无锡灵达化工有限公司;硫酸(分析纯):无锡市佳妮化工有限公司。
1.2 仪器与设备
HK-02A 多功能粉碎机:上海烨昌食品机械有限公司;HH-1 数显恒温水浴锅:国华电器有限公司;UV-1800PC-DS2 紫外可见分光光度计:上海美谱达仪器有限公司;DZF-6050 真空干燥箱:上海越众仪器设备有限公司;SHZ-DⅢ循环水式真空泵:河南省予华仪器有限公司;LE204E 电子天平:梅特勒-托利多有限公司。
1.3 方法
1.3.1 葡萄糖标准曲线的绘制
精密称取葡萄糖对照品13.2 mg,加蒸馏水溶解,定容至 25 mL,精密吸取 0.00(空白)、0.20、0.40、0.60、0.80、1.00 mL 上述溶液于10 mL 容量瓶中,分别加1 mL 5%苯酚水溶液,5 mL 浓硫酸,蒸馏水定容至刻度线,混合均匀,20 ℃放置30 min,在490 nm 处测定吸光度[14],以吸光度值对葡萄糖溶液浓度绘制标准曲线,进行线性回归得葡萄糖标准曲线方程,见图1。
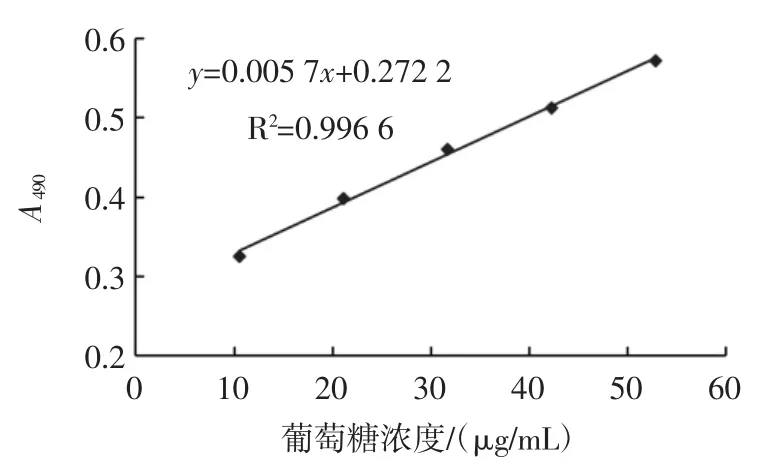
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
1.3.2 麦冬多糖的提取及测定
准确称取10 g 干燥的麦冬粉末于250 mL 烧杯中,按照一定的液料比加入蒸馏水,热水浸提,抽滤,收集滤液,将滤液浓缩至10 mL 后加入足量95%乙醇,静置,待多糖全部沉降,抽滤,滤饼经真空干燥即得麦冬多糖。
将麦冬多糖用适量蒸馏水溶解后定容至250 mL,准确移取1.00 mL 多糖溶液于250 mL 容量瓶中,加入5%苯酚水溶液1 mL、浓硫酸5 mL,定容,摇匀后放置30 min,在490 nm 处测定吸光度,通过葡萄糖标准曲线进行分析计算,从而得出麦冬多糖得率。
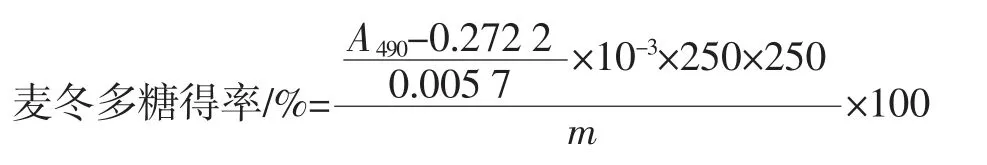
式中:m 为麦冬粉末的质量,mg;A490为稀释后的多糖溶液的吸光度;前一个250 为稀释倍数;后一个250 为麦冬多糖溶液体积,mL。
1.3.3 麦冬多糖的抗氧化性作用试验
取适量干燥的麦冬多糖,配制 20、40、60、80、100、120 mg/L 麦冬多糖水溶液,备用。
采用DPPH 法[15-18],准确移取0.20 mL 不同浓度的麦冬多糖提取液于比色管中,加入预先配置好的4 mL 0.15 mmol/L 的DPPH 甲醇溶液,摇匀后暗处放置30 min,以样品溶剂为空白,测定其在515 nm 波长处吸光度A,同时测定样品溶液在515 nm 处的吸光度A0及DPPH 甲醇溶液在515 nm 处的吸光度A1,每个样品重复3 次。

2 结果与分析
2.1 单因素试验
2.1.1 液料比对麦冬多糖得率的影响
称取5 份质量为10 g 的麦冬粉末,按液料比为4 ∶1、6 ∶1、8 ∶1、10 ∶1、12 ∶1(mL/g)加入蒸馏水,70 ℃水浴浸提1.5 h,滤液浓缩至10 mL,加入50 mL 95%乙醇进行醇沉,结果见图2。

图2 液料比对多糖得率的影响Fig.2 Effect of ratios of water to materials on extraction yield of polysaccharides
由图2 可知,当液料比在 4 ∶1(mL/g)~8 ∶1(mL/g)范围内时,随着溶剂体积的增大,麦冬多糖的得率显著上升;溶剂体积继续增大时,麦冬多糖得率趋于稳定。这是因为蒸馏水用量越大,水中麦冬多糖浓度相对就越低,麦冬细胞内外多糖浓度差越大,传质推动力越大,麦冬多糖就越容易浸出[19]。
2.1.2 提取时间对麦冬多糖得率的影响
称取5 份质量为10 g 的麦冬粉末,按液料比8 ∶1(mL/g)加入蒸馏水,置于 70 ℃的恒温水浴锅中分别浸提 0.5、1、1.5、2、2.5 h,醇沉时加入 50 mL 95%乙醇,结果见图3。
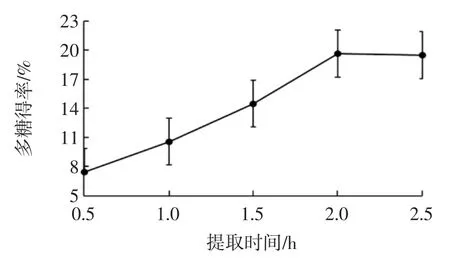
图3 提取时间对多糖得率的影响Fig.3 Effect of time on extraction yield of polysaccharides
由图3 可知,随着提取时间的增多,多糖的得率逐步升高,这是由于当提取时间较短时,多糖还未充分提取出来,当提取时间为2 h 时,多糖得率最高,继续提取,多糖得率几乎不变。
2.1.3 乙醇用量对麦冬多糖得率的影响
分别称取5 份质量为10 g 的麦冬粉末,按液料比8 ∶1(mL/g)加入蒸馏水,置于 70 ℃的恒温水浴锅中浸提 1.5 h,醇沉时分别加入 40、50、60、70、80 mL 95%乙醇,结果见图4。
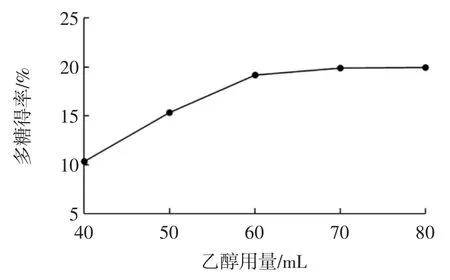
图4 乙醇用量对多糖得率的影响Fig.4 Effect of ethanol content of the yield of polysaccharides
由图4 可知,随着乙醇用量的增多,麦冬多糖水提液的乙醇浓度不断增加,多糖得率逐步升高,当乙醇用量超过60 mL 时,多糖得率趋于稳定,这表明采用60 mL 乙醇进行醇沉时,水提液中的大部分多糖已经被沉降。
2.1.4 提取温度对麦冬多糖得率的影响
称取5 份质量为10 g 的麦冬粉末,按液料比8 ∶1(mL/g)加入蒸馏水,分别置于 50、60、70、80、90 ℃的恒温水浴锅中提取1.5 h,醇沉时加入50 mL 95 %乙醇,结果见图5。

图5 提取温度对多糖得率的影响Fig.5 Effect of temperature on extraction yield of polysaccharides
由图5 可知,随着温度的升高,麦冬多糖的得率逐步增大。当温度由50 ℃上升至80 ℃时,多糖得率上升明显,当温度超过80 ℃时,多糖得率上升趋势趋缓。温度越高,多糖分子扩散速度加快,相同提取时间内,多糖得率越高[20]。
2.2 二次通用旋转组合设计优化试验分析
2.2.1 设计因素和水平
综合考虑单因素试验结果,应用二次通用旋转组合设计法对提取工艺进行分析并优化。通过Data Processing System 软件设计试验,分析因素及水平编码表见表1。
2.2.2 二次通用旋转组合设计试验优化结果与分析
麦冬多糖提取的二次通用旋转组合设计试验结果见表2。方差分析表见表3。
试验号根据多项式回归方程Y=b0+∑biXi+∑bijXiXj+∑Xii,结合试验结果计算出拟合方程的各项系数,得到回归方程:Y=19.430 00+0.700 83X1-0.020 83X2+1.010 83X3+0.685 00X4-0.684 79X12-0.836 04X22-0.511 04X32-0.792 29X42+0.232 50X1X2-0.210 00X1X3-0.027 50X1X4+0.108 75X2X3-0.083 75X2X4+0.238 75X3X4。

表1 二次通用旋转组合设计法分析的因素和水平Table 1 Factors and levels of quadratic general rotary unitized design

表3 试验结果方差分析Table 3 Variance analysis of results
由表3 可知,在单因素试验中,只有液料比(X2)这个因素的效果不显著,剔除α=0.10 的不显著项后[21-24],显著项的各个系数都可由表而知,得到得率对试验因素的回归方程:Y=19.430 00+0.700 83X1+1.010 83X3+0.685 00X4- 0.684 79X12- 0.836 04X22- 0.511 04X32-0.792 29X42。
2.3 单因素分析
根据试验结果对单因素进行效应分析,结果见表4 及图6。
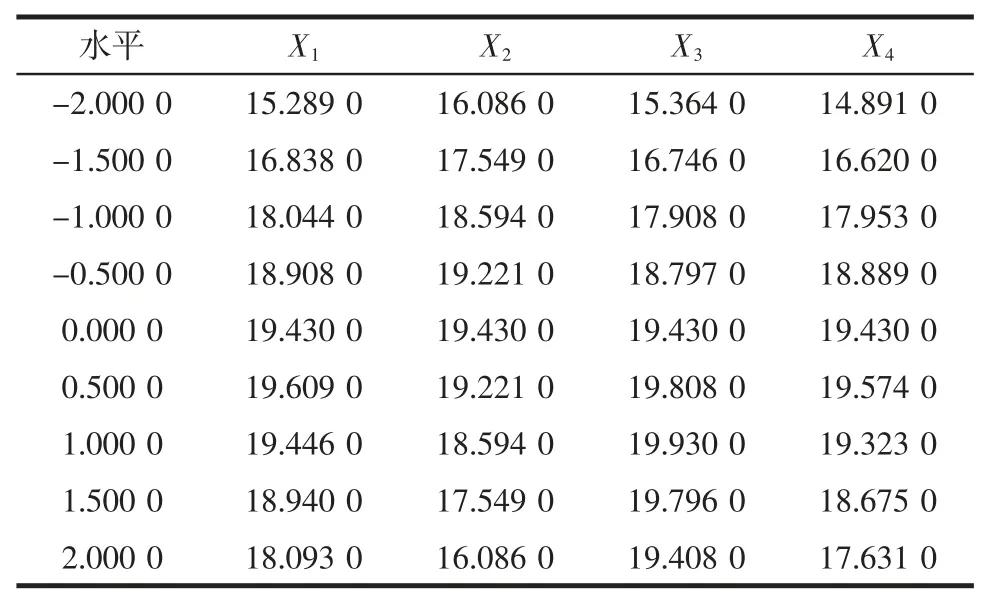
表4 单因素效应分析Table 4 Effect analysis of single factor
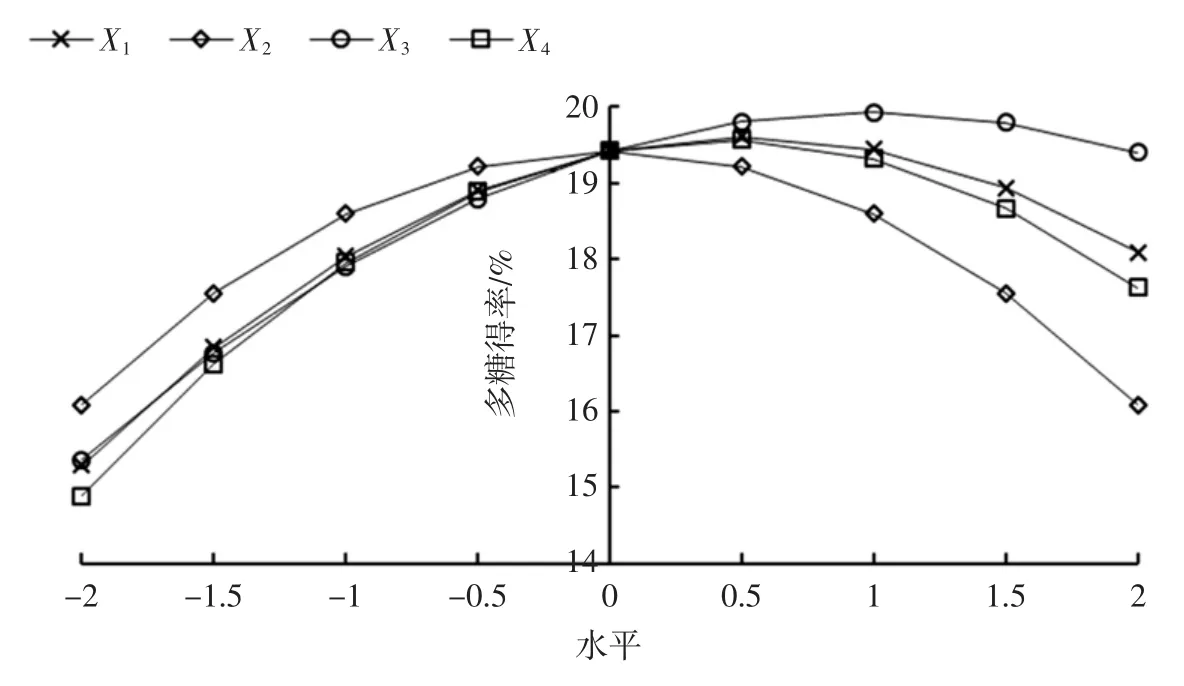
图6 各单因素与多糖得率的关系Fig.6 Relationship of single factors and yield of water soluble polysaccharide
由表4 和图6 可知,提取时间影响得率变化最大,然后依次是提取温度和乙醇用量,液料比最小。
当试验水平为0.500 0 时,即提取时间为1.75 h时,多糖的得率最高,当提取时间继续延长,多糖得率呈现下降趋势。因为热水提时间过长时,多糖的组分则比较容易降解,使分子内和分子间的氢键等弱相互作用力失效加剧降解,造成得率下降[21]。
乙醇用量的试验水平在0.500 0 时达到最高,此时乙醇用量为65 mL。继续增加乙醇用量时,多糖得率降低。
当提取温度的试验水平为1.000 0 时,即提取时温度设置为80 ℃,麦冬多糖的得率达到最高。当温度继续增加时,多糖的耐热性较差容易降解[17],使得得率下降。
多糖从麦冬中溶出是一个由浓度差推动的扩散过程[22],在理论上讲,水提时加入的蒸馏水越多,多糖就越容易扩散。然而除了多糖扩散的因素之外,也受细胞组织的影响。由于后续醇沉步骤中,为节省乙醇用量,需要将多糖的水提液浓缩,因此过大的溶剂体积会对试验造成不便,所以液料比选 8 ∶1(mL/g)较适宜。
2.4 优化与验证
由试验结果可知,在试验中不但存在着单因素效应,而且还有因素间的相互作用。综合考虑试验中一些条件限制,比如热水提取时加入蒸馏水的量不宜过大、提取温度不宜过高等,需要对本文中回归模型再进行更深一步的研究。采用频数分析法分析此模型确定最优良的工艺条件,结果见表5。

表5 各变量取值的频数分布Table 5 Probability distribution of variables
由表5 可知,麦冬多糖的最优提取条件为:乙醇用量区间为 63.45 mL~67.28 mL、液料比区间为 7.69 ∶1(mL/g)~8.31 ∶1(mL/g)、提取温度区间为 76.98 ℃~80.58 ℃、提取时间区间为1.651 h~1.837 h。在此范围内,考虑到实际的可操作性,结合单因素效应分析结果,将最佳工艺条件定为:乙醇用量 65 mL、液料比为 8 ∶1(mL/g)、提取温度为80 ℃、提取时间为1.7 h,在最佳条件下,麦冬多糖理论得率为20.29%。
通过验证得到麦冬多糖得率为20.17%,和理论值较为接近,表明本文拟合得到的回归方程能够较好的应用于麦冬多糖的提取。
2.5 麦冬多糖物DPPH自由基清除能力
麦冬多糖对DPPH 自由基的清除作用结果见图7。
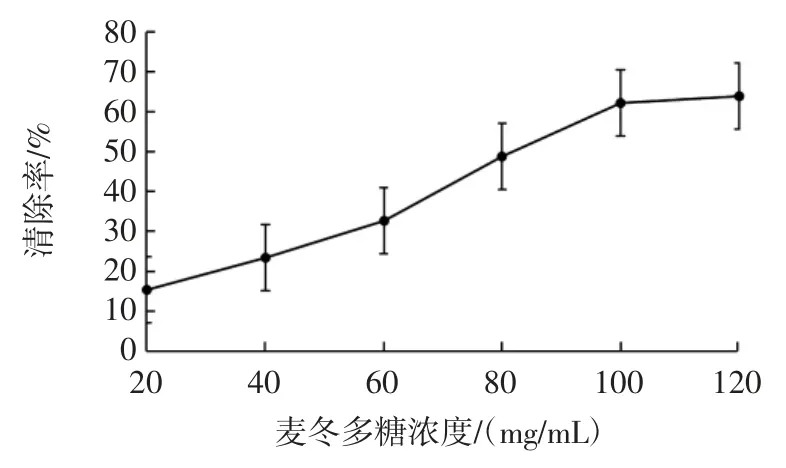
图7 麦冬多糖对DPPH 自由基的清除作用Fig.7 Scavenging effect of Liriope spicata polysaccharide on DPPH free radicals
试验结果表明,麦冬多糖对DPPH 自由基具有一定的清除能力,且清除能力与麦冬多糖浓度呈现明显的量效关系,即随着麦冬多糖浓度的增加其清除DPPH 自由基的能力也在逐渐增加。当麦冬多糖浓度达到100 mg/mL 时,麦冬多糖对DPPH 自由基的清除率达到63.78%,且趋于稳定。
3 结论
本文采用二次通用旋转组合设计有助于克服二次回归正交设计的缺陷,即二次回归预测值依赖于试验点在因子空间中的位置,不能根据预测值直接寻找最优区域,减少了误差的干扰,从而易于得到组合较优的提取条件。最终确定最佳提取工艺条件为:10 g 麦冬粉末,乙醇用量 65 mL、液料比为 8 ∶1(mL/g)、提取温度为80 ℃、提取时间为1.7 h,麦冬多糖得率为20.17%。麦冬多糖对DPPH 自由基的清除能力随着麦冬多糖浓度的增加而增强,当麦冬多糖浓度达到100 mg/mL 时,对DPPH 自由基的清除率达到63.78%,且趋于稳定。
目前,麦冬多糖的提取方法,除了水提醇沉法,还有酶提取法、微波提取法,酶提取法提取条件较温和,可明显提高植物成分的提取效率,但成本较高[25]。微波超声法能够提升释放多糖的速度,缩短提取时间,但是超声时间过长多糖会发生降解,影响多糖的得率[12]。水提醇法成本较低,提取方法简单方便,适合于大规模生产,因此,研究水提醇沉麦冬多糖的最佳工艺参数和抗氧化活性可为今后深入研究和开发利用麦冬多糖提供参考。

