环状RNA FBLIM1在肝细胞癌中生物学功能的初步研究
彭婀敏,夏发达,王文龙,姚磊,梁婕,白宁
(中南大学湘雅医院 1.国际医疗部 2.普通外科 3.急诊科,湖南 长沙 410008)
原发性肝癌是世界范围内最为常见的消化系统恶性肿瘤之一,至今仍没有得到充分有效的控制,呈现较高的病死率[1-3]。原发性肝癌病理类型包括肝细胞癌(hepatocellular carcinoma,HCC)(75%~85%)、胆管细胞癌(10%~15%)、混合型肝癌以及其他罕见类型。目前,针对HCC的治疗方法主要是以外科手术为主的包括:肝移植、经皮穿刺射频消融、介入治疗和分子靶向药物、免疫治疗药物等为辅的综合治疗[4-6]。然而,尽管手术技术和与之相配套的综合治疗方案在过去几十年不断改善,但HCC的预后仍然很差[7-9]。大部分HCC患者在初诊的时候已经处于晚期,失去了手术治疗的机会,并且即使接受了系统的治疗,HCC患者5年复发率也高达70%[10]。因此,对HCC发生发展的分子机制进行深入研究,寻找新的分子靶点以发掘更有效的HCC治疗策略成为需迫切解决的问题。
环状RNA(circular RNA,circRNA)是内源性非编码RNA的一类,其结构为共价环状闭合的单链RNA。近年来,随着生物信息学以及RNA测序技术的发展,研究者逐渐认识到circRNA在生命科学当中的重要作用。Sand 等[11]发现23 个circRNA在基底细胞癌中上调,48个下调。另有研究[12]发现hsa_circ_002059在胃癌的表达明显比癌旁组织低,可作为胃癌的生物标志物。与mRNA和lncRNA相比,HCC中circRNA的研究仍处于初步阶段,在HCC中circRNA的作用及分子机制仍然不明。到 目前为止,在HCC 中仅鉴定和表征了少量功能性circRNA。笔者前期对HCC患者的肿瘤组织及其癌旁肝组织进行了高通量的circRNA芯片筛选,发现hsa_circ_0010090是在HCC 细胞系当中上调最为明显的环状RNA,根据人类参考基因组(GRCh37/hg19),发现hsa_circ_0010090(chr1:16084668-16113084)是源自于位于染色体1p36.21上的FBLIM1基因,故将其命名为“circFBLIM1”。本研究将进一步探讨circFBLIM1在HCC中的功能,为发现circRNA在HCC中的诊断、治疗及预后评估方面的潜在价值提供基础。
1 材料与方法
1.1 细胞株及培养
HCC细胞系HepG2、7402、97H均购买自美国ATCC,并且严格按照美国模式培养物保藏所的要求进行培养。所有细胞系在使用后每6个月通过短串联重复DNA分析重新鉴定,并且排除支原体感染。所有细胞培养于含有10%FBS(巴西GIBCO)的DMEM(美国Invitrogen)中,于37 ℃,5%CO2条件下细胞培养箱中培养。
1.2 实验动物
4周龄,BALB/c雌性裸鼠,30只,(20±2)g,由上海斯莱克实验动物有限公司提供。在无特定病原体条件下饲养,饲养地点:中南大学实验动物部。所有动物研究均经中南大学湘雅医院的机构动物护理和使用委员会(IACUC)批准。根据IACUC方案遵循标准动物护理和实验室指南。
1.3 主要试剂及仪器
RNAiso plus、逆转录试剂盒及qRT-PCR试剂盒均购自日本Takara公司;Transwell小室、基质胶Matrigel(BD);ThermoND2000C超微量分光光度计(Thermo)、GeneAmp PCR system 9700扩增仪(PerkinElmer)、Ligh tCycler®480 II System(Roche)。circFBLIM1干扰序列(sicircFBLIM1):GCA AUA CAC AAG UGC AUA CTT;阴性对照序列:UUC UCC GAA CGU GUC ACG UTT(广州锐博生物科技有限公司合成)。
1.4 方法
1.4.1 细胞转染 取对数生长期的HCC 细胞株接种于6 孔板(5×105/ 孔)中待生长至汇合度为50% 时,按照Lipofectamine2000 说明书要求分别转染si-circFBLIM1 与阴性对照序列。
1.4.2 qRT-PCR 提取好的RNA 进行浓度测定,各取1 μg RNA 参照逆转录试剂盒说明书进行逆转录合成cDNA。将cDNA 进行一定的稀释,作为RT-PCR 的模板,参照荧光定量PCR 试剂盒(SYBR染料法)说明书进行PCR。mRNA 相对表达水平的定量采用比较Ct 法来计算相对定量,内参选择GAPDH。
1.4.3 CCK-8 实验 HCC 细胞株转染后24 h 后,以100 μL 细胞悬液(约1×103细胞)接种到96 孔板,分别在0、1、2、3、5 d 后加入10 μL/孔CCK-8 溶液,避光37 ℃培养2 h,用Bio-Tek EPOCH2 检测450 nm 波长处的吸光度。
1.4.4 Transwell 试验 HCC 细胞株转染后24 h后,采用胰酶消化细胞并离心弃上清,用无血清的培养基重悬细胞,按照1:8 比例稀释50 mg/L的Matrigel 后,加50 μL稀释后的Matrigel 包被Transwell 小室底部膜,将1×105/100 μL 细胞悬液接种到上室,下室加500μL 含10%FBS 的DMEM 培养液,48 h 后取出小室,弃上室培养基,用棉签拭掉顶部的未侵入细胞,在光学显微镜下计数入侵细胞。
1.4.5 裸鼠皮下成瘤实验 将HepG2 细胞悬浮于无血清培养液中,调整浓度至5×107/mL,将细胞接种于裸鼠一侧腋部皮下后为2 组,每组5 只裸鼠,以40 μL 阴性对照序列或si-circFBLIM1 进行接种部位原位多点注射,1 次/4 d;记录观察裸鼠的一般情况、移植瘤形成的时间及大小;每4 天用游标卡尺测移植瘤最长径(L)和最短径(W),连续测量28 d,绘制移植瘤生长曲线;实验结束后,将肿瘤完整剥离并进行大体照相,测量肿瘤体积及质量。
1.5 统计学处理
采用SPSS21.0 统计学软件进行统计学分析。分别使用t检验、One-way ANOVA进行各组之间的差异分析。所有数据显示为均数±标准差(±s),P<0.05为差异有统计学意义。
2 结 果
2.1 干扰效果检测
qRT-PCR检测结果显示,转染si-circFBLIM1后,HepG2、7402和97H细胞中的circFBLIM1的表达水平均明显下调,与各自转染阴性对照序列的同种细胞比较,差异均有统计学意义(均P<0.01)(图1)。
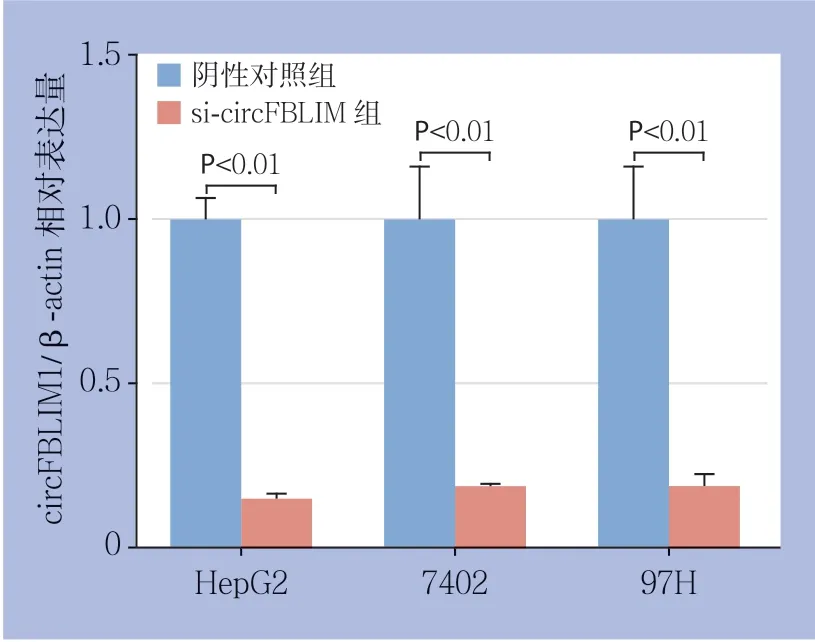
图1 si-circFBLIM 在3 种HCC 细胞中的转染效率检测Figure 1 Determination of the transfection efficiency of sicircFBLIM in the three different HCC cells
2.2 下调circFBLIM1 对HCC 细胞增殖的影响
CCK8实验结果显示,在转染si-circFBLIM1后,3种HCC细胞的增殖能力均明显减弱,在450 nm处的OD值在转染后3、4、5 d明显均较各自阴性对照组明显降低(均P<0.01)(图2)。
2.3 下调circFBLIM1 对HCC 细胞侵袭能力的影响
Transwell实验结果显示,3种HCC细胞转染si-circFBLIM1后,细胞穿过Transwell膜的数目与各自阴性对照组比较均明显减少(均P<0.01)(图3)。
2.4 下调circFBLIM1 对HCC 细胞在裸鼠体内生长的影响
皮下注射裸鼠成瘤实验中,通过连续28 d的观察,结果发现利用si-circFBLIM1下调HepG2细胞中circFBLIM1的表达水平之后,HCC在裸鼠体内的生长速度明显减慢,肿瘤体积与质量明显降低,与阴性对照组有明显差异(均P<0.01)(图4)。
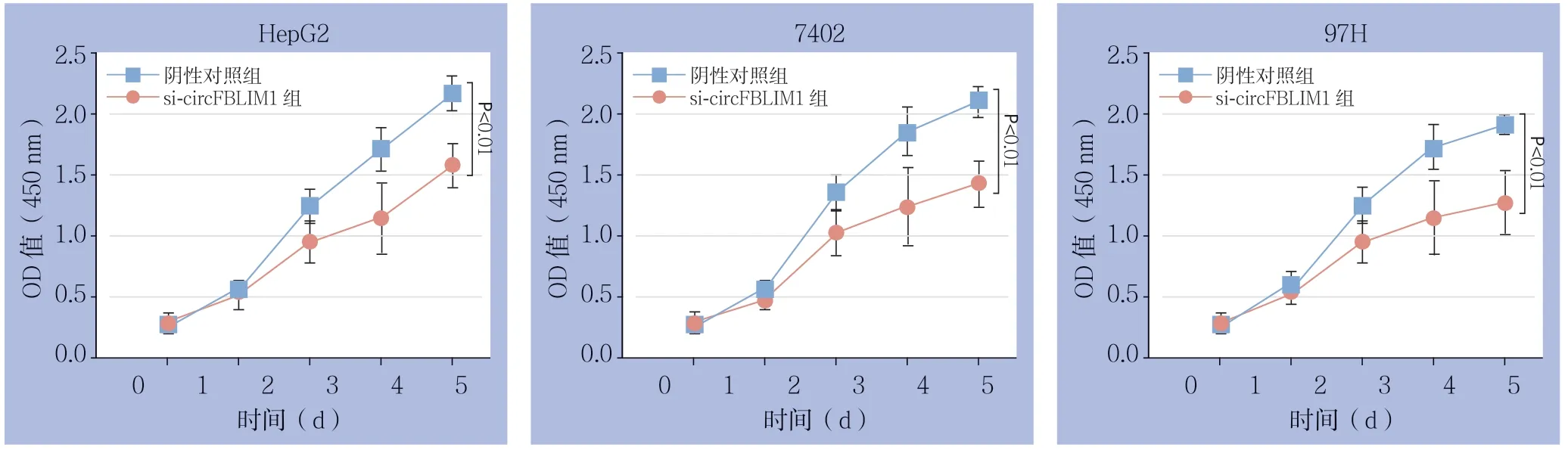
图2 CCK-8 实验检测HCC 细胞增殖Figure 2 Proliferation of HCC cells detected by CCK-8 assay
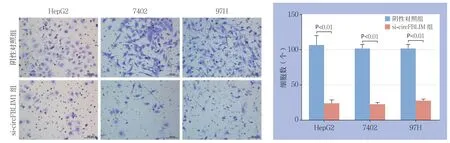
图3 Transwell 实验检测HCC 细胞的侵袭能力(×200)Figure 3 Invasion ability measured by Transwell assay (×200)
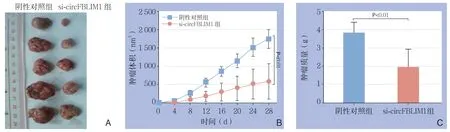
图4 裸鼠移植瘤实验 Figure 4 Nude mouse tumor transplantation mode
3 讨 论
circFBLIM1即hsa_circ_0010090(chr1:16084668-16113084),其来源于FBLIM1基因(1p36.21)。通过调研文献,circFBLIM1的生物学功能到目前为止尚未见报道。为了初步评估circFBLIM1在HCC中的生物学功能,本研究通过转染si-circFBLIM1的方式来下调HCC细胞系(HepG2、7402和97H)中circFBLIM1的表达。通过CCK-8细胞增殖实验发现,在HCC细胞中下调circFBLIM1的表达,能够显著抑制HCC细胞的增殖能力。后续的Transwell实验结果显示,通过抑制circFBLIM1的表达能够使得HCC细胞系穿过Transwell膜的能力大大下降,提示侵袭能力受到抑制。在皮下注射裸鼠成瘤实验当中,通过向10只BALB/c裸鼠皮下注射HepG2细胞,并瘤内注射阴性对照序列或si-circFBLIM1进行处理,结果发现,瘤内注射si-circFBLIM1后,肿瘤体积显著缩小,此项结果提示,下调circFBLIM1能显著减慢HCC体内肿瘤生长速度。以上实验结果表明,下调circFBLIM1能抑制HCC细胞增殖、侵袭、促进凋亡,在体内抑制肿瘤生长,进一步从反向证明了中circFBLIM1在HCC中发挥促进细胞增殖、侵袭的作用。
文献[13-14]报道,HCC组织中circMTO1的减少可以作为患者生存率低的预后预测因子。Lin等[15]报道在各种HCC 细胞系和HCC 患者的组织样品中,circCDK13表达受到抑制。在HCC细胞中诱导的circCDK13过表达显着抑制了它们的迁移速率,改变了细胞周期进程,并抑制了细胞迁移和侵袭能力。微阵列分析还鉴定了由circCDK13调节的许多下游基因,特别JAK/STAT以及PI3K/Akt信号通路。致瘤性测定的结果显示,circCDK 13过表达显着抑制裸鼠的HCC进展。Qin等[16]研究发现,基于89对HCC组织和邻近肝组织样本的分析,hsa_circ_0001649表达在HCC组织中显著下调(P=0.0014),并且ROC曲线下面积(AUC)为0.63。此外,hsa_circ_0001649表达与HCC中肿瘤大小(P=0.045)和瘤栓的发生(P=0.017)密切相关。
近来,随着生物信息学以及RNA 测序技术的发展,研究者逐渐认识到circRNA在生命科学当中的重要作用。据报道,RNA 可以作为竞争性内源性RNA(competing endogenous RNA,ce RNA),通过竞争共有的miRNA 而互相调节[17-18]。circ RNA 主要存在于细胞胞质内,具有比一般的ce RNA 更多更稳定的miRNA 应答元件(MRE),因此circ RNA 能够更有效的结合miRNA,成为miRNA海绵,作为ceRNA发挥作用,通过自身的MRE 竞争结合miRNA,调控靶基因的表达水平,最终影响其功能[19]。譬如过表达CDR1as能够有效地“吸附”miR-7,从而下调miR-7,导致miR-7靶标的表达水平升高[20-21]。Zheng 等[22]证实circ HIPK3 通过充当海绵“吸附”miR-124等miRNA,从而抑制肿瘤的增殖。Hansen等[23]发现circRNA Sry可充当miR-138的海绵。Yang等[24]研究发现来自FOXO3的cir cRNA hsa_circR NA_104170,通过吸附miR-22等一系列miRNA,抑制乳腺癌的细胞增殖及肿瘤血管生成。这些研究结果表明:circRNA在多种肿瘤中差异表达,可作为关键调节分子,通过miRNA海绵的作用,影响肿瘤的多种生物学行为,发挥重要的调控功能。
目前,circRNA在HCC中研究仍处于起步阶段,对其在HCC的功能了解甚少,而机制的研究更为缺乏。本研究虽然初步观察了circFBLIM1在HCC中的基本生物学作用,但对其作用机制仍未做深入研究。笔者推测circFBLIM1也可能通过充当海绵“吸附”miRNA,进而通过ceRNA机制调节miRNA靶基因的表达参与HCC的发生与发展。因此,本研究后续将通过各种生物信息学方法与不同分子生物学手段预测并查明circFBLIM1的靶miRNA,并进一步构建全面的circFBLIM1相关ceRNA网络,系统探明circFBLIM1在HCC中的功能及作用机制。
总之,本研究基于前期发现circ FBLIM1 在HCC 中的高表达,初步证明circ FBLIM1 能促进HCC 细胞的增殖与侵袭,在HCC 中发挥促瘤作用。circFBLIM1可能作为HCC诊断治疗中的新的生物标志物和潜在靶点。

