苯基吡唑缩单胺类席夫碱衍生物的合成和电化学、光物理性能
陈连清,吴忠达,黄林伟,陈贵娣
(中南民族大学 化学与材料科学学院,武汉 430074)
席夫碱是一类含有亚胺或甲亚胺特性基团的化合物,由于含有氮原子,具有很强的配位作用,可与许多过渡金属离子或金属有机化合物形成单核或多核配合物[1-4],同时席夫碱配合物也是良好的光致发光材料,可以利用席夫碱配合物,制备电致发光器件与光传感器[5].目前,研究较多是水杨醛与胺缩合生成的缩胺类单席夫碱或双席夫碱[6],由于这类席夫碱有活性羟基,可作为多齿配体[7,8].随着席夫碱合成的研究发展,很多是关于席夫碱及其衍生物或配合物的的合成与与性质[9],但是有关苯甲醛及其取代化合物合成的席夫碱衍生物或含氮杂环衍生物的发光性能的报道却很少.苯基吡唑是一类具有广泛生物活性的含氮杂环化合物[10],在医农药领域应用已非常成熟.在医药领域,苯基吡唑类化合物可以消炎镇痛[11];在农药领域,苯基吡唑类化合物可以用作除草剂[12]和防治病虫害[13].因此对苯基吡唑类化合物的结构改造屡见不鲜,苯基吡唑类席夫碱的合成也成为新颖的研究课题.其次,从材料分子结构的角度来看,苯基能与吡唑杂环形成了良好的共轭体系,拥有高荧光量子产率和分子内电荷转移特性[14,15],故对苯基吡唑类席夫碱光物理性能的研究很有意义。因此,本文以苯基吡唑为原料合成了六种苯基吡唑缩单胺类席夫碱衍生物[16],并测试了6种目标化合物的紫外、荧光光谱,证明6种苯基吡唑缩单胺类席夫碱衍生物具有较好的共轭结构与发光效率,是良好的发光材料.
1 实验部分
1.1 试剂和仪器
亚硝酸钠、浓硫酸、浓氨水、溴素、无水硫酸镁、氢氧化钾、硫氰化钾、冰乙酸、2,6-二氯-4-三氟甲基苯胺、2,3-二氰基丙酸乙酯、无水乙醇、1,2-二氯乙烷、溴乙烷、甲醇、石油醚、甲苯、呋喃甲醛、苯甲醛、茴香醛、水杨醛、对硝基苯甲醛均为市售分析纯,使用前未进一步纯化.
核磁共振谱仪(Bruker AVANCE III 400 M型,德国,氘代试剂为CDCl3);质谱仪(ZAB 3F-HF型,美国);元素分析仪(Vario-EL III CHNS型,美国);傅立叶红外光谱仪(NeXUS 470 FTIR,日本津岛);紫外-可见光谱分光光度计(Perkin-Elmer Lambda-Bio35,日本津岛);荧光光谱仪(PE LS-55型,美国);数字熔点仪(WRS-1B,上海精科);循环伏安仪(CHI660C型,上海振华);单晶衍射仪 (Bruker SMART APEXII,德国).
1.2 苯基吡唑的合成路线
以2,6-二氯-4-三氟甲基苯胺为原料合成苯基吡唑类化合物APY,NCS和NCH,合成路线见图1.
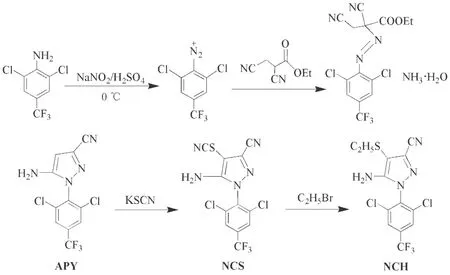
图1 苯基吡唑的合成路线
1.2.1 5-氨基-3-氰基-1-(2,6-二氯-4-三氟甲苯基)吡唑(APY)的合成
在500 mL四口烧瓶中加入9.8 g亚硝酸钠,依次装上搅拌器、滴液漏斗及尾气处理装置,在冰浴条件下,加入36.0 mL冰乙酸和39.0 mL浓硫酸的混合溶液,将30.4 g 2,6-二氯-4-三氟甲基苯胺溶入70.0 mL冰乙酸溶液中,缓慢滴入上述烧瓶中,在15~20 min内滴完.保持低温30 min,将20.0 g 2,3-二氰基丙酸乙酯溶入85.0 mL冰乙酸溶液中备用,再量取175 mL蒸馏水,依次滴入上述溶液,搅拌5 h.甲苯萃取,分出有机层,加入32 mL浓氨水,快速搅拌2 h,静置分层,用饱和NaCl溶液洗涤,无水MgSO4干燥,旋蒸,用甲苯和石油醚混合溶液重结晶,析出淡黄色针状晶体.产率91%,m.p.149.6~150.0 ℃; IR(KBr,ν/cm-1):3335,3416(N—H),1462,1567(苯环骨架振动),2248(—CN),1629(吡唑骨架振动),1320(C—F),884(芳环C—H);1H NMRδ: 7.8 (s,2 H,Ar—H),6.06(s,1H,Ar—H),3.76 (s,2H,N—H).Anal.calcd for C11H5N4Cl2F3: C 41.15,H 1.57,N 17.45; found C 40.65,H 1.66,N 17.34.MS (FAB):m/e,319 (M+).
1.2.2 5-氨基-3-氰基-1-(2,6-二氯-4-三氟甲基-苯基)-4-硫氰基-吡唑(NCS)的合成
在500 mL反应瓶中加入23.3 g硫氰化钾,32.8 mL冰乙酸和100 mL 1,2-二氯乙烷,滴加7.5 mL液溴,30 min滴完.过滤,滤液备用.在反应瓶中加入30.0 g APY和200 mL 1,2-二氯乙烷,混合均匀并冷却至室温后,缓慢滴入上述滤液,30 min滴完.搅拌30 min,反应液倒入250 mL冰水中,浓氨水调节pH=9,过滤,滤饼用水洗至中性,烘干得到产品.收率93%,m.p.178.1~ 178.7 ℃; IR(KBr,ν/cm-1):3338,3453(N—H),1567,1510(苯环骨架振动);1H NMRδ: 7.80(s,2H,Ar—H),4.58(s,2H,N—H).Anal.calcd for C12H4N5Cl2F3S: C 38.11,H 1.07,N 18.52; found C 38.23,H 1.16,N 18.49.MS (FAB):m/e,376 (M+).
1.2.3 5-氨基-3-氰基-1-(2,6-二氯-4-三氟甲苯基)-4-乙硫基吡唑(NCH)的合成
在250 mL反应瓶中加入3.1 g NCS和50 mL无水乙醇,完全溶解后,加入2.5 mL溴乙烷和氢氧化钾溶液(0.1 g/mL)10 mL,反应完全后,加入180 mL蒸馏水,过滤,得产品.收率95%,m.p.157.5~158.0 ℃; IR(KBr,ν/cm-1):3330,3431(N—H),1559,1511(苯环骨架振动),2248(—CN),16229(吡唑环骨架振动),1319(C—F),879(芳环C—H);1H NMRδ:7.79(s,2H,Ar—H),2.70 (t,2H,C—H),4.18(s,2H,N—H),1.26(t,3H,C—H).Anal.calcd for C13H9N4Cl2F3S: C 40.96,H 2.38,N 14.70; found C 41.10,H 2.48,N 13.55.MS (FAB):m/e,379 (M+).
1.3 苯基吡唑类席夫碱衍生物的合成
1.3.1 APY(PhOH)的合成
在100 mL的三口烧瓶中加入3.2 g APY和60 mL甲醇,完全溶解后,滴加三滴冰乙酸和3 mL水杨醛,磁力搅拌下加热冷凝回流10 h,反应结束后,旋蒸,用无水乙醇重结晶,得黄色晶体(合成路线见图2).产率86%,m.p.170.5~170.9 ℃; IR(KBr,ν/cm-1): 3144 (O—H),1568,1521,1472(苯环骨架振动),2241(—CN),1608(CN),1313,1212(C—F),887(芳环C—H);1H NMRδ: 6.809(s,1H,Ar—H),8.728 (s,1H,C—H),11.067(s,1H,O—H),6.899(t,2H,Ar—H),7.777(s,2H,Ar—H),7.409(s,2H,Ar—H).Anal.calcd for C18H9Cl2F3N4O: C 50.85,H 2.13,N 13.18; found C 50.70,H 2.18,N 13.15.MS (FAB):m/e,424 (M+).
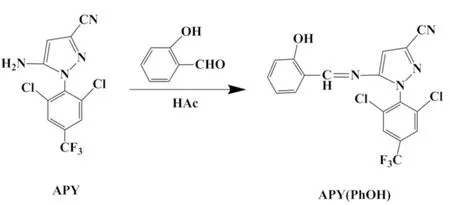
图2 APY(PhOH)的合成路线
1.3.2 3-氰基-4-乙硫基-1-(2,6-二氯-4-三氟甲苯基)-5-氨基吡唑类席夫碱衍生物的合成
在100 mL的三口烧瓶中加入1.91 g NCH和60 mL甲醇,完全溶解后,滴加三滴冰乙酸和1.5 mL呋喃甲醛/苯甲醛/茴香醛/水杨醛/对硝基苯甲醛,磁力搅拌下加热冷凝回流反应5 h,反应结束后,旋蒸,用无水乙醇重结晶,得到产品(合成路线见图3).
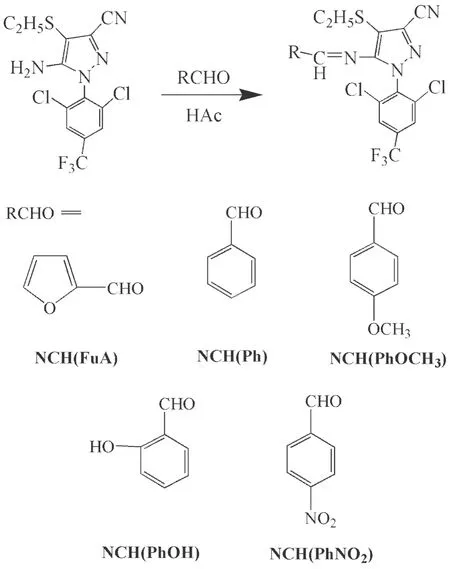
图3 5-氨基-1-(2,6-二氯-4-三氟甲苯基)-4-乙硫基-1H-吡唑-3-氰基席夫碱衍生物的合成路线
NCH(FuA)收率85%,m.p.136.4~136.9 ℃; IR(KBr,ν/cm-1):2242(—CN),1618 (CN), 1312,1247(C—F);1H NMRδ: 2.833(t,2H,C—H),1.220(d,3H,C—H),7.061(s,1H,Ar—H),6.552 (s,1H,Ar—H),7.614(s,1H,Ar—H),8.936(s,1H,C—H).Anal.calcd for C18H11Cl2F3N4OS: C 47.07,H 2.41,N 12.20; found C 46.99,H 2.39,N 12.15.MS (FAB):m/e,458 (M+).
NCH(Ph)收率78%,m.p.113.2~114.1 ℃; IR(KBr,ν/cm-1): 1574,1498,1450(苯环骨架振动),2 249(—CN),1 619(CN),1 310,1 213(C—F),888(芳环C—H);1H NMRδ: 2.844(d,2H,C—H),1.217 (t,3H,C—H),7.724(s,4H,Ar—H),7.511(s,1H,Ar—H),7.417(d,2H,Ar—H),9.149(s,1H,C—H).Anal.calcd for C20H13Cl2F3N4S: C 51.18,H 2.79,N 11.94;found C 50.90,H 2.78,N 11.85.MS (FAB):m/e,468 (M+).
NCH(PhOCH3)收率61%,m.p.113.1~116.9 ℃; IR(KBr,ν/cm-1): 1516,1459(苯环骨架振动),2237(—CN),1591(CN),1312 (C—O—C),889(芳环C—H);1H NMRδ: 2.835 (d,2H,C—H),1.224 (d,3H,C—H),7.681(t,4H,Ar—H),3.835(s,3H,C—H),6.914(d,2H,Ar—H),9.064(s,1H,C—H).Anal.calcd for C21H15Cl2F3N4OS: C 50.51,H 3.03,N 11.22; found C 50.53,H 3.01,N 11.12.MS (FAB):m/e,498 (M+).
NCH(PhOH)收率81%,m.p.129.7.5~130.5 ℃; IR(KBr,ν/cm-1): 3 075 (O—H),1568和1503(苯环骨架振动),2247 (—CN),1607(CN),1310,1279(C—F),886(芳环C—H);1H NMRδ:2.8 96(d,2 H,C—H),1.238(s,3H,C—H),11.103(s,1H,O—H),6.895(t,2H,Ar—H),7.766(d,2H,Ar—H),9.324(s,1H,C—H),7.418(s,2H,Ar—H).Anal.calcd for C20H13Cl2F3N4OS: C 49.50,H 2.70,N 11.54;found C 49.46,H 2.68,N 11.58.MS (FAB):m/e,484 (M+).
NCH(PhNO2)收率72%,m.p.142.7~143.2 ℃; IR(KBr,ν/cm-1): 1598,1588,1527(苯环骨架振动),2242(—CN),1624(CN),1182,1315(C—F),816(芳环C—H),1346(—NO2);1H NMRδ: 2.923 (d,2 H,C—H),1.232(t,3H,C—H),7.866(s,2H,Ar—H),8.265(d,2H,Ar—H),7.751(s,2H,Ar—H),9.293 (s,1H,C—H).Anal.calcd for C20H12Cl2F3N5O2S: C 46.71,H 2.35,N 13.62; found C 46.90,H 2.38,N 13.65.MS (FAB):m/e,513(M+).
2 结果与讨论
2.1 合成路线的选择
酸催化条件下有利于醛类化合物的亲核加成反应;碱性条件下席夫碱不稳定,实验以冰乙酸为催化剂,取得了理想的效果.当胺醛摩尔比为1∶1.5时,反应较为彻底,去除溶剂并用无水乙醇重结晶,可得到产品,避免了席夫碱碳氮双键的共轭体系与硅胶吸附而难以分离.选用的呋喃甲醛、苯甲醛、茴香醛、水杨醛、对硝基苯甲醛是取代或未取代的芳香醛,取代基团与芳基影响亲核加成反应.NCH(Ph)与NCH(FuA)产率较高,由于呋喃环与碳氮双键的共轭性相较于苯环与碳氮双键共轭性好,茴香醛与对硝基苯甲醛对位均有取代基,当对位是给电子取代基时,产率有所下降;而对位是吸电子取代基时,对产率却影响不大.合成的6种苯基吡唑缩单胺席夫碱具有较大的共轭体系,导致化合物吸光红移,呈黄色晶体,6种席夫碱衍生物的物性常数见表1.
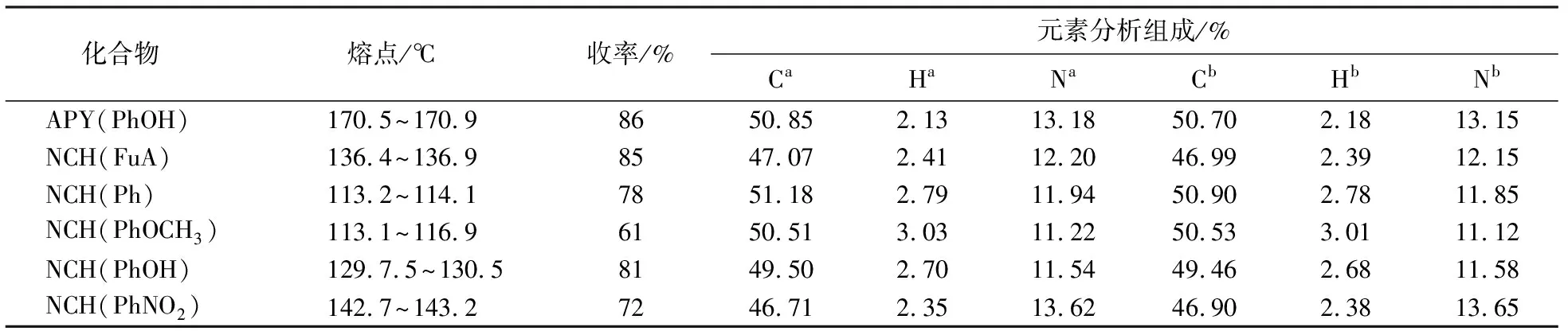
表1 6种席夫碱衍生物的物性常数
2.2 产物的结构表征
6种席夫碱的质谱和红外吸收峰数据结果见表2.在MS谱图中目标化合物的分子碎片峰符合分子理论组成.由表2红外吸收峰数据中可见:在第一峰区中,3144 cm-1与3075 cm-1吸收峰归属为APY(PhOH)与NCH(PhOH)的O—H特征伸缩振动峰;在第二峰区中,2237~2249 cm-1归属为—CN的特征伸缩振动峰;在第三峰区中,1591~1624 cm-1和1450~1600 cm-1分别归属为CN和苯环的骨架伸缩的伸缩振动峰,约1346 cm-1和816~888 cm-1归属为NCH(PhNO2)的—NO2和芳环C—H特征伸缩振动峰.
表3为6种席夫碱的核磁谱峰归属数据结果见表3.由表3的核磁谱峰归属数据可见:芳环上δH约为6~8;δH在8.7~9.3时,可归属为6种席夫碱中的—CHN—;δ在1.217~1.238和2.8~2.9分别归属为NCH(Ph),NCH (PhOH),NCH(PhNO2),NCH(PhO CH3),NCH(FuA)中—SCH2CH3上甲基氢和亚甲基氢;11.067 (s,1H,O—H),11.103 (s,1H,O—H),3.835(s,3H,C—H)分别归属于APY(PhOH),NCH (PhOH)上羟基氢和NCH (PhOCH3)上甲氧基中三个氢的特征化学位移.

表2 6种席夫碱衍生物的红外和质谱数据

表3 6种席夫碱衍生物的核磁氢谱
由6种席夫碱衍生物各自的红外、质谱、氢谱和元素分析的数据,证实其与所设计的目标化产物的结构相符.
2.3 产物的光物理性能
6种席夫碱衍生物紫外吸收和荧光发射光谱数据见表4.
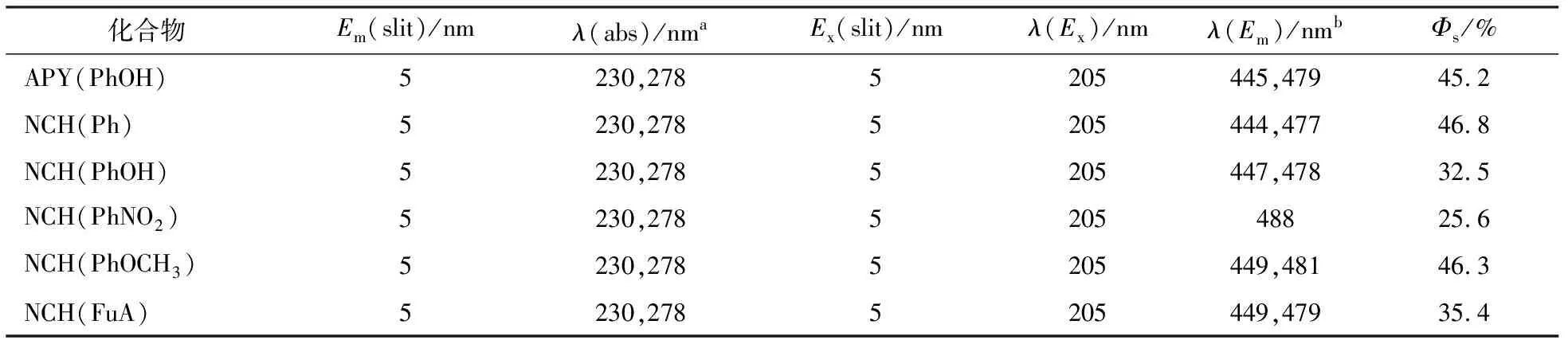
表4 六种席夫碱衍生物的光物理性能
2.3.1 紫外光图谱
在298 K,苯基吡唑缩单胺类席夫碱溶解到CH2Cl2溶液中的紫外吸收光图谱见图4.由图4可知:APY(PhOH),NCH(Ph),NCH(PhOH),NCH(PhNO2),NCH(PhOCH3),NCH(FuA)在230 nm和278 nm附近有较强的吸收峰,归属为苯环和吡唑环的共轭吸收峰.生成的席夫碱衍生物中,苯环与吡唑环形成更大的共轭结构,致使紫外吸收红移,在320 ~387 nm有中强度的吸收峰,表明6种席夫碱具有明显的精细结构,具有较大的共轭体系,其紫外吸收主要归结于化合物共轭体系的π-π*跃迁.
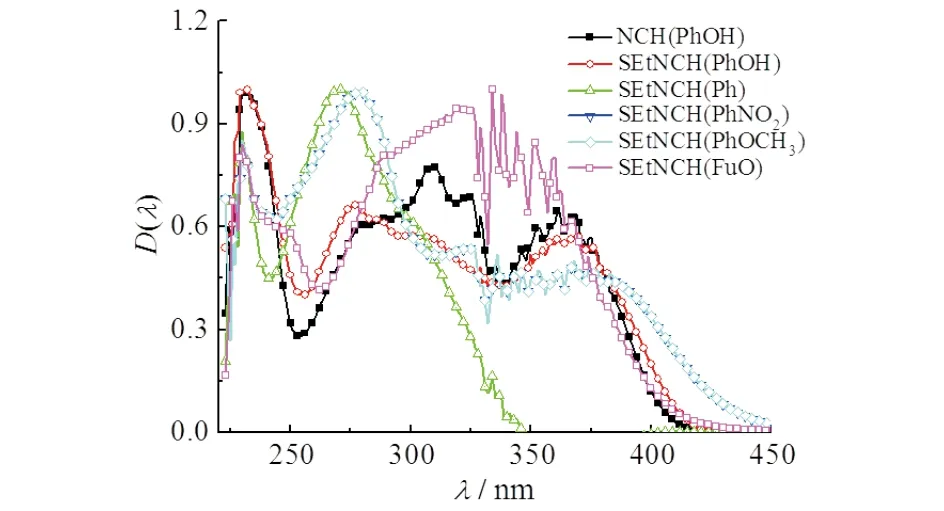
图4 6种席夫碱衍生物的紫外光谱图
2.3.2 荧光图谱
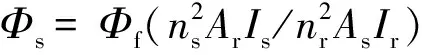
由图5可知:当Ex=205 nm时,化合物APY(PhOH),NCH(Ph),NCH(PhOH),NCH(PhOCH3),NCH(FuA)分别在445,479 nm;444,477 nm;447,478 nm;449,481 nm;449,479 nm处均有较强的荧光吸收峰,而NCH(PhNO2)在446 nm处无荧光吸收峰,由于硝基是强吸电子基团,使激发态的电子更分散,激发态能量变低,荧光吸收峰加强,右移至488 nm处.荧光量子产率测试表明:该类化合物具有较好的荧光量子产率,是一类比较好的发光材料.
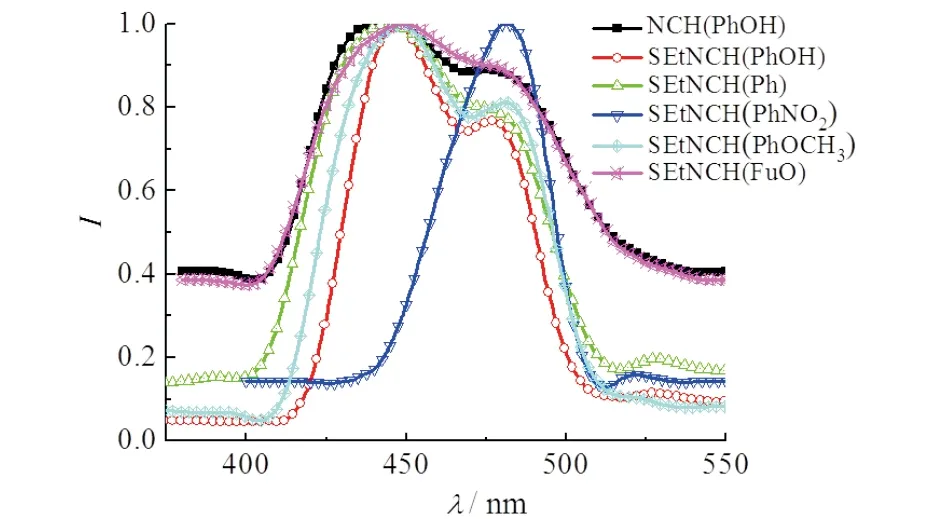
图5 6种席夫碱衍生物的荧光光谱图
2.4 产物的电化学性质
用循环伏安法研究了6种席夫碱衍生物的电化学数据见表5,其中可见所有铕配合物的氧化还原电位.计算获得化合物的HOMO和LUMO能值以及两者间的能隙值,并由席夫碱衍生物的HOMO和LUMO能级数据,算得6种席夫碱衍生物的荧光发射波长分别为:480,478,477,482,480,488 nm,与其对应的荧光光谱的最大发射波长数据(见表4)较吻合.因此,根据循环伏安法测得的电势计算发射波长和实际测试的发射波长基本相符,证实了引入强紫外-可见吸收基团极大地提高了席夫碱衍生物的发光效率.
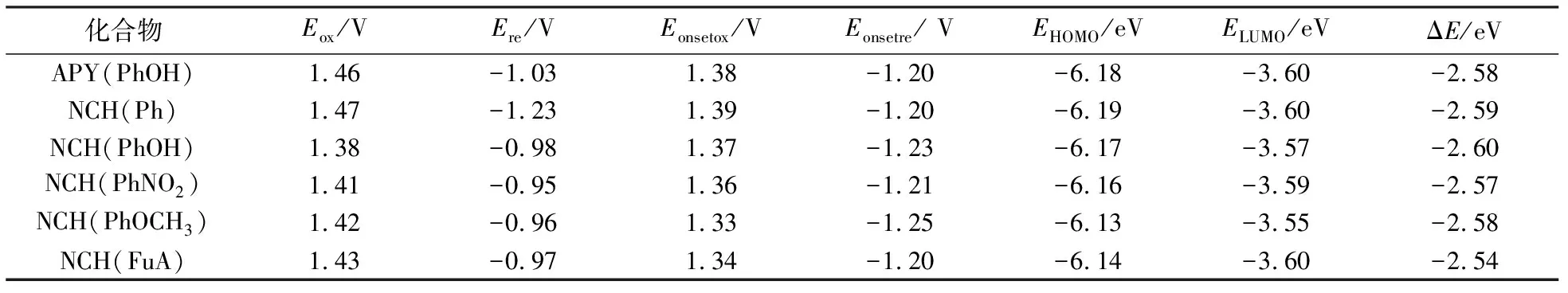
表5 6种席夫碱衍生物的电化学性质
2.5 晶体结构
化合物APY(PhOH)的分子结构图和结构堆积图分别见图6和图7,两个骨架结构通过 N(4)—C(7)形成碳氮双键相互连接构成苯基吡唑缩单胺席夫碱化合物APY(PhOH).化合物APY(PhOH)的晶胞参数和部分键长、键角数据分别见表4和表5.分析可知:APY(PhOH)的分子式为C18H9Cl2F3N4O,属于单斜晶系,空间群为P21,N(4)—C(7)是将水杨醛和APY相连接的碳氮双键,其键长1.266(9)Å明显较其他C—N键长短;C(7)—C(8)为单键,受N(4)—C(7)中碳氮双键及水杨醛中苯环结构的共轭作用影响,键长平均化为1.282(8)Å,较C(5)—C(6)键长1.438(8)Å更短;APY(PhOH)中两个骨架连接处C(7)—N(4)—C(6)呈现以一定的扭曲角存在的118.7(5)°二面角.由分子结构图可知:吡唑环及原水杨醛结构上的酚环在空间分布上几乎处于同一平面,两者与原APY结构上苯环的空间平面分布呈现90°,呈现双排重叠式构型,晶格中吡唑环上的氰基在两排分子结构间以相互平行的形式相向延伸.
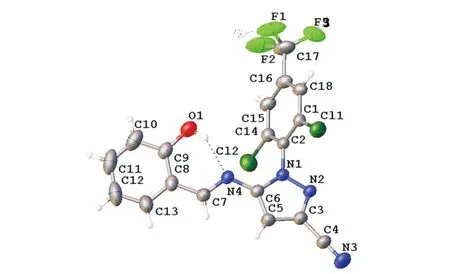
图6 化合物APY(PhOH)的分子结构图
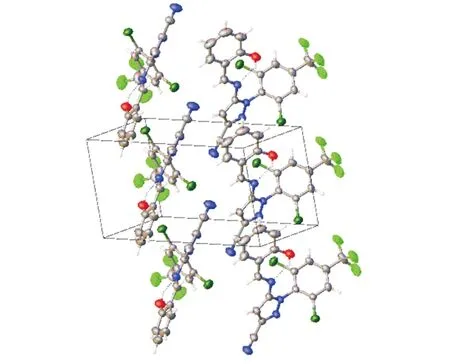
图7 化合物APY(PhOH)的结构堆积图

表6 化合物APY(PhOH)的晶胞参数
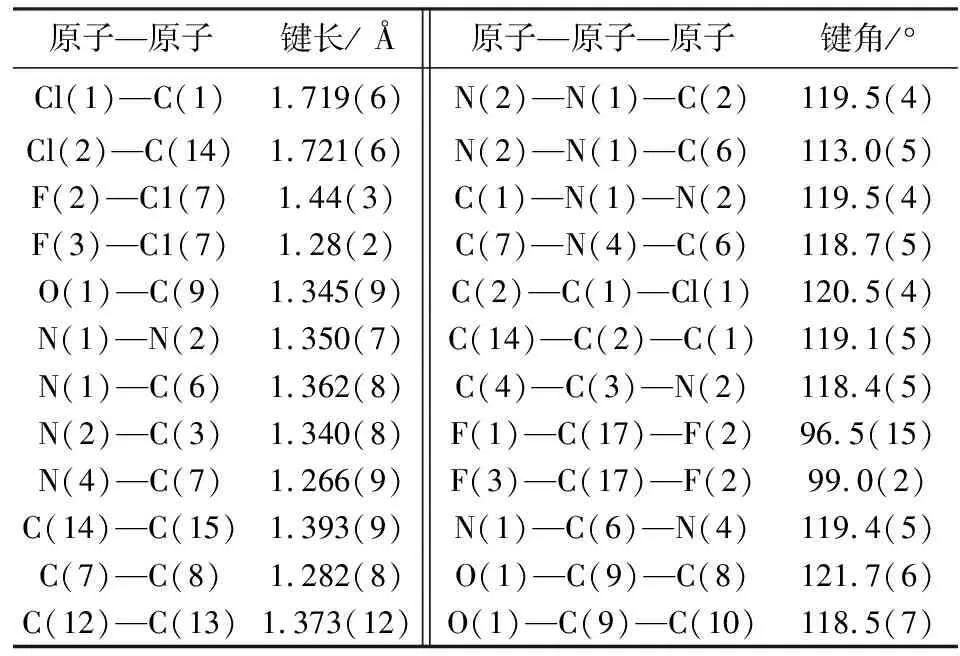
表7 化合物APY(PhOH)的部分键长和键角数据
3 结语
选用苯基吡唑结构为母体,合成了6种苯基吡唑缩单胺类席夫碱,分别为APY(PhOH),NCH(Ph),NCH(PhOH),NCH(PhOCH3),NCH(PhNO2),NCH(FuA).对6个化合物进行了IR,1H NMR,MS和元素分析等表征,在单晶衍射下确证了APY(PhOH)的晶体结构,测试了6种席夫碱的紫外、荧光光谱,探讨了其光物理性能和电化学性质.结果表明:6种苯基吡唑类席夫碱光物理性能相似,具有明显的精细结构,共轭体系的π-π*跃迁使其具有较好的共轭体系,发射波长和实际测试的发射波长基本相符合,证明引入强紫外-可见吸收基团极大地提高了席夫碱衍生物的发光效率.此类化合物具有结构精细、共轭效应良好、发光效率高的特点,为设计合成具有发光性能优良的共轭型有机发光材料奠定了基础.

