疱疹病毒UL11基因及其编码蛋白的研究进展
阳林江,汪铭书,程安春
(1.四川农业大学动物医学院/ 预防兽医研究所,四川成都 611130;2.四川农业大学动物医学院/ 禽病防治研究中心,四川成都 611130;3.动物疫病与人类健康四川省重点实验室,四川成都 611130)
疱疹病毒在自然界分布广泛,可以感染两栖类、禽类、哺乳类,也能感染灵长类和人类。多数疱疹病毒感染后可以引起机体不同程度的临床症状和病理变化,如血管损伤、组织出血、消化道黏膜丘疹样病变、淋巴器官和实质器官的变性[1-2];但也有感染后无临床症状和病理变化的,如成年猪感染伪狂犬病毒为隐性感染[3]。疱疹病毒感染典型的流行病学特征是能够建立潜伏感染,感染或康复者长期携带病毒。因感染的人或动物会成为无症状的携带者,其仅在子代病毒间歇性地通过出芽、胞吐或诱导细胞凋亡而离开宿主细胞被释放时才能检测到,这使得疱疹病毒难以监测和控制[4]。
根据病毒的理化性质,疱疹病毒科可以分为α、β、γ 3 个亚科[5]。α 疱疹病毒主要包括人单纯疱疹病毒1 型(Herpes simplex virus,HSV-1)、水痘带状疱疹病毒(Varicella-zoster virus, VZV)、 伪狂犬病病毒(Pseudorabies virus,PRV)、马疱疹病毒1 型(Equine herpesvirus 1,EHV-10 和鸭瘟病毒(Duck plague virus,DPV)等;β 疱疹病毒主要包括巨细胞病毒(Cytomegalovirus,CMV),如人CMV,即人疱疹病毒5 型(Human herpesvirus 5,HHV-5)等;γ 疱疹病毒如爱泼斯坦-巴尔氏病毒(Epstein-Barr virus,EBV),即人疱疹病毒4 型(Human herpesvirus 4,HHV-4)等。疱疹病毒体积较大、结构较复杂,基因组为双链DNA,其基因编码的蛋白中约有30 多种为病毒结构蛋白,分别凝聚形成核心、衣壳、皮层以及囊膜[6]。皮层填充于衣壳与囊膜间,但目前很多皮层蛋白的准确功能还不是十分清楚[7-9],其极有可能在病毒复制时具有双重功能即参与病毒的初期感染和后期组装,调控病毒的侵入、基因表达和免疫逃逸[10]。
UL11 基因编码的皮层蛋白pUL11 对病毒粒子进入细胞、装配、囊膜化、释放等方面均具有重要作用。本文就UL11 基因及其编码蛋白pUL11 的特点、结构、定位以及相关功能等方面做一简要综述,以期为疱疹病毒及UL11基因的深入研究提供参考。
1 疱疹病毒UL11 基因及其编码蛋白的特点
1.1 UL11 基因序列的特点 疱疹病毒的基因组由一独特长区(UL)和一独特短区(US)构成,包绕于UL 和US 两侧的为反向重复序列。不同疱疹病毒的UL11 基因在基因组中的位置及基因大小有差异,如:HSV-1 UL11 基因的开放阅读框(ORF)大小为288 bp[11];EHV-1 UL11 由ORF51开放阅读框编码,大小为225 bp[12];DPV 的UL11 基因位于基因组的100 220 bp~100 483 bp,全长为264 bp[13];HCMV 的UL11 基因位于基因组的18 268 bp~19 119 bp,全长为852 bp[14]。大多数UL11 基因位于UL 区的UL10与UL12 之间,其编码序列与UL12 基因的部分阅读框重叠[15];但也有不重叠的,如HHV-5 的UL11 基因不与UL12 重叠[14]。在所有高等脊椎动物疱疹病毒中均有UL11或同源基因,如EBV 中的BBLF1 即为UL11 的同源基因[16]。部分代表性疱疹病毒的UL11 ORF 在基因组中的定位及其与UL12 的关系见图1。
1.2 UL11 基因编码蛋白质的特点 疱疹病毒UL11 基因的编码蛋白pUL11 是一种小的外周结合膜蛋白。虽然不同疱疹病毒pUL11 的氨基酸序列同源性通常较低,但所有疱疹病毒pUL11 同系物的N 末端含有预测的N- 肉豆蔻酰化信号以及可用作棕榈酰化基质的一个或几个连续的半胱氨酸残基,pUL11 通过N- 末端肉豆蔻酸酯和邻近的棕榈酸酯部分结合宿主膜的细胞质面或病毒囊膜的内面[17];C 端在不同疱疹病毒的功能尚未确定,Han 等的研究显示,HSV-1 pUL11 的非保守C 末端具有与gE 的细胞质尾结合的功能[18](图2)。
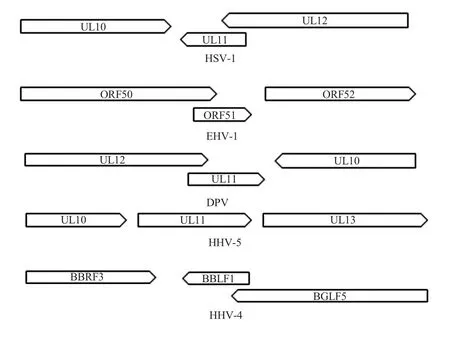
图1 部分代表性的疱疹病毒UL11 开放阅读框及其与UL12 的关系
Leege 等的研究表明,HSV-1 pUL11 高尔基体靶向作用参与了蛋白质的分类、包装及输出,“晚期”蛋白质修饰,保证蛋白与脂质的单向转运,因此推测pUL11 可能与感染细胞的膜相关[19]。
疱疹病毒pUL11 含有与肉豆蔻酸和棕榈酸两种脂肪酸共价修饰的氨基酸基序,这种双重修饰的蛋白质通常能与抗去垢剂膜(Detergent-resistant membranes,DRMs)相结合,DRMs 是细胞膜中富含胆固醇和鞘脂的微区,是信号转导、细胞骨架组织和病原体进入和退出等功能重要的“平台”。Baird 等研究发现,HSV-1 pUL11 中亮氨酸- 异亮氨酸和酸性簇氨基酸基序控制pUL11 分子与DRMs 的结合[20](图2)。pUL11 作为一种膜相关的调节蛋白,需要用肉豆蔻酸酯和棕榈酸酯进行酰化,用于膜结合、脂笩运输和病毒的积聚[21]。人类免疫缺陷病毒1 型(HIV-1)Gag需要通过肉豆蔻酰化来生产病毒,因此推测UL11 的酰化对于疱疹病毒有效的病毒粒子生产是必需的。
Western blot 检测表明,传染性喉气管炎病毒(Infectious laryngotracheitis virus,ILTV)在感染鸡胚肾细胞(CEK)后3 h、6 h 和9 h 检测到低水平的pUL11,说明pUL11在病毒感染的晚期才表达[22]。

图2 UL11 结构域简图及其与抗去垢剂膜的关系
1.2.1 UL11 基因编码蛋白在感染细胞中的定位疱疹病毒UL11 基因编码蛋白在感染细胞中定位于细胞的各种膜结构中,如细胞膜、胞浆中含膜结构的细胞器。Kopp 等通过免疫荧光试验和共聚焦激光扫描发现,在PRV 感染的兔肾细胞(RK13)中,pUL11 特异性荧光主要在细胞质的高尔基体以及细胞膜中,但不具通透性的细胞上未检测到pUL11 特异性荧光,表明pUL11 定位于细胞膜的内表面[17];Yeh-PC 等研究表明,HSV-1 感染细胞后,pUL11 锚定在细胞膜的细胞质侧[23];Badr 等将EHV-1 Ab4p 株感染胎马肾细胞(FHK-Tcl3.1)和RK13 细胞,通过间接免疫荧光(IFA)发现,pUL11 主要集中在[12]高尔基体;在β 疱疹病毒中,Gabaev 等将表达人CMV UL11 的腺病毒载体转导上皮细胞和成纤维细胞,发现pUL11 暴露在细胞膜上[21];在γ 疱疹病毒中, Chiu 等将EBV BBLF1-Flag 质粒转染A7 细胞,通过IFA 发现BBLF1 定位在反面高尔基体区域[16]。
1.2.2 pUL11 在病毒粒子中的定位为了确定pUL11 是否是病毒粒子的组份及其在病毒颗粒中的定位,Kopp 等用兔抗pUL11 对纯化的PRV 粒子进行胶体金免疫染色,通过电子显微镜观察到胶体金标记的pUL11 紧邻囊膜,表明PRV 的pUL11 是膜相关的蛋白质[17];PRV 感染的RK13 超薄切片中,特异性pUL11 血清可以标记胞质内具有囊膜的病毒粒子和可能为高尔基体衍生的胞内膜以及细胞外病毒颗粒,而核周膜和核膜中的初级包膜病毒颗粒没有特定的金颗粒标记,表明UL11 定位在出核后的病毒粒子中。
2 UL11 基因编码蛋白质的功能
疱疹病毒UL11 基因编码的蛋白会影响病毒复制。Schimmer 等在RK13 细胞中研究UL11 基因对1 型马疱疹病毒(Equine herpesvirus 1,EHV-1)分离株和疫苗株在细胞中的一步生长动力学的影响,结果缺失UL11 基因后可引起细胞内和细胞外病毒滴度降低约10 至20 倍[24]。Kopp研究UL11 基因缺失对PRV 在RK13 细胞中的一步生长动力学的影响,结果显示,与亲本病毒株相比,UL11 缺失株的病毒滴度降低了10 倍,非必需包膜糖蛋白M 缺失株的病毒滴度降低了50 倍[25];UL11/gM 双缺失株与gM 缺失株、UL11 缺失株相比,病毒滴度降低了大约100 倍。表明,gM 与UL11 同时缺后会对病毒粒子的复制产生显著影响。Kim 等研究也发现,仅在同时删除UL11 和编码gM 的UL10 基因后才观察到HSV-1 的复制缺陷,表明两种蛋白质可能有助于病毒粒子的复制[26]。Walter 等研究发现,缺失UL11 的ILTV 感染CEK,形成的空斑大小较野毒株缩小了58 %,而回补株表现出与野毒株一致的空斑大小;缺失株的最大病毒滴度比野毒株降低了10 倍[22]。这些研究表明,多数疱疹病毒的pUL11 虽然对病毒在细胞中的复制不是必需的,却可以影响病毒复制。而Badr等构建了缺失UL11 和UL11 C 端截断的EHV-1 感染性克隆,结果显示将UL11 缺失和截短的BAC DNAs 转染细胞后不产生子代病毒,而回复UL11 后转染细胞则可以产生病毒,表明EHV-1 的UL11 对病毒复制是必需的[12]。UL11 基因编码蛋白对病毒复制周期的影响具体体现在进入宿主细胞、囊膜化、释放等方面。
2.1 诱导病毒包膜与细胞膜融合 Kim 等研究了UL11对HSV-1 进入细胞的影响,缺失gM 或UL11 的病毒株与野毒株相比形成相同的空斑形成单位所需的时间更长,表明gM 或UL11 缺失使病毒进入细胞的速度变慢,且严重抑制病毒诱导细胞融合[26];Han 等用缺失了UL11 的HSV-1 感染HaCa T 细胞,发现与野毒株相比缺失病毒在细胞上产生的空斑变小[27]。Schimmer 等用缺失UL11 的病毒株EHV-1 感染RK13 细胞,发现UL11 的缺失对空斑形态影响显著,最大空斑的平均直径分别降低到亲本病毒空斑的23.2 %或34.7 %,并且对缺失株形成合胞体的能力有影响[24]。这些研究表明pUL11 与病毒的侵入及病毒在细胞与细胞之间的扩散有关。
2.2 参与病毒粒子初级包膜的形成和次级囊膜化过程对HSV-1、 ILTV、 PRV 和鼠巨细胞病毒(Murine cytomegalovirus,MCMV)的研究均表明,UL11 在病毒粒子的次级囊膜化过程中具有重要作用,pUL11 的缺失将导致病毒粒子在细胞质中次级包膜的缺损[22,25,28-29]。Leege 等在电镜下观察发现,HSV-1 的UL11 缺失株与亲本株相比,其发生次级囊膜化缺陷,表现在细胞质中存在裸露核衣壳;在感染HSV-1 的gM/UL11 双缺失突变株的RK13 细胞中,形成大量由与电子致密物质皮层结合的核衣壳组成的胞质内包涵体[19]。Kopp 等用PRV UL11 缺失株感染RK13,电子显微镜观察到感染细胞的细胞核形态正常,在核膜的内层没有明显的衣壳积聚且细胞核未受任何损伤,然而胞质内膜(特别是高尔基体附近或高分子膜)扭曲,膜聚集弯曲并且紧密连接,推测pUL11 可能会妨碍蛋白质核衣壳到次级囊膜化位点的进程[17]。
Fulmer 等研究中,还观察到UL11 的缺失会抑制细胞核中病毒核衣壳初级包膜的形成从而引起衣壳在细胞核内的积聚,并且UL11 缺失的病毒粒子形成具有弥漫性的衣壳的聚集体,表明UL11 对病毒粒子的初级囊膜化也具有重要的作用[30]。
2.3 影响病毒粒子的释放 UL11 基因对病毒粒子的出芽有一定的影响。Baines 等的研究表明,缺失61 % UL11 基因的HSV-1 突变病毒与野生型病毒相比,从Vero 细胞中释放到细胞外的感染性病毒的量降低了1 000 倍以上;缺失61 % UL11 基因的突变病毒释放到细胞外的过程显著延迟,在感染后20 h~26 h 细胞外的感染性病毒颗粒只增加15 倍,而野生型病毒在感染后8 h~14 h 细胞外病毒却增加500 倍[31];Chouljenko 等构建了HSV-1 的UL11缺失株,采用Q-PCR 检测发现,感染细胞上清中病毒粒子比细胞中病毒粒子少[32]。
3 pUL11 与病毒其它蛋白以及宿主相关蛋白的相互作用
3.1 pUL11 与pUL16 和pUL21 的相互作用 pUL11 可与多种蛋白相互作用,其中与pUL16、pUL21 之间的相互作用受到了广泛的关注。Yeh 对HSV-1 pUL11 和pUL16 皮层蛋白相互作用进行研究,认为pUL11 和pUL16 之间的相互作用是直接的,并且研究表明两种蛋白间的结合需要pUL16 内几种保守的半胱氨酸[23]。
Chadha 等通过共转染表达pUL11 和pUL16,观察到二者的共定位;然后将大肠杆菌表达的含His 标签的UL16 蛋白与含pUL11 的GST 和不含pUL11 的GST 混合孵育后进行Pull down 试验,用His 标签抗体对pUL16 进行免疫印迹分析,结果GST-pUL11 能显出pUL16 条带,而GST 却不能[33]。PRV 的GST-pUL11 能下拉pUL16 和pUL21,但GST-pUL11 不能下拉缺失了UL16 基因病毒的pUL21[34],表明pUL11 与pUL16 具有直接相互作用,但只有在pUL16 存在的情况下,pUL11、pUL16 和pUL21 才能结合在一起,pUL11 与pUL21 不存在直接相互作用。
Han 等将UL11、UL16 和gE 真核表达质粒分别两两共转染Vero 细胞,发现UL16 与gE 的相互作用很弱,但pUL11 能募集pUL16 而促进pUL16 与gE 在核周位置共定位[28]。
3.2 UL11 与gE 相互作用 Kopp 等最先报道pUL11 可以与gE 结合[17]。pUL11 能特异性结合到gE 胞内域(CT)。Farnsworth 采用免疫沉淀方法检测量化分析后,发现结合到全长gE 的pUL11 与缺失了gE CT 结构域的gE- 突变株相比,大约多了5 倍;与缺少大部分CT 结构域的突变株相比,大约多了2 倍;只表达gE 495 位之后氨基酸和519 位之后氨基酸的两个突变株免疫共沉淀结果为全长gE 的83.6 %,表明pUL11 特异性结合gE 主要涉及gE CT 结构域C 末端附近的495~550 位氨基酸残基[35]。Han等分别缺失UL11 和gE 尾端后,对感染细胞的病毒粒子进行纯化,免疫印迹检测显示,在缺失gE 尾端的情况下,参与病毒粒子装配的pUL11 的量降低[28];同样,在缺失UL11 的情况下,参与病毒粒子装配的gE 的量也下降[17]。
3.3 pUL11 与pUL16、pUL21 和gE 的相互作用 pUL11-pUL16-pUL21 复合体通过pUL11 和pUL16 组装在gE 的细胞质尾部上与膜相互作用,pUL11 与gE 直接结合促进gE-pUL16 相互作用。pUL11-pUL16-pUL21 复合物对gE 在感染细胞膜上的积累很重要,gE 可促进病毒感染细胞合胞体的形成和病毒在细胞之间的传播,缺失UL11、UL16和UL21 后的HSV-1 感染Vero 细胞后,gE 在细胞表面的积累大幅度降低[27]。
Han 等研究了pUL11、pUL16、pUL21 和gE 的共定位,单独转染表达时,pUL16 和pUL21 分布在整个细胞中但主要在胞核;gE 分布在核膜和细胞质中类似于高尔基体腔和内质网腔区域的斑点区;而pUL11 如预期在反面高尔基体网状结构(Trans-golgi network,TGN)中分布。当4 者共同表达时,它们发生了共定位:pUL16 和pUL21的定位发生了改变,由原来的细胞核定位转移到核周位置;gE 的定位也发生了改变,从核膜转移并与其它3 种蛋白质在相同的核周位置积聚[27]。
综上可知,UL11 与gE、UL16 和UL21 均存在较强的结合能力,但UL16 与gE 结合能力较弱;UL11 与UL21不存在直接的相互作用,但可与UL16 结合间接与UL11发生相互作用,且UL21 可以促进UL11 与UL16 的相互作用;UL11 可以促进gE 与ULL16 的结合(图3)。

图3 pUL11 的定位及其与其他蛋白的相互作用
3.4 pUL11 与CD45 的相互作用与免疫逃逸 受体型酪氨酸磷酸酶CD45 在淋巴细胞的发育成熟、功能调节及信号传递中具有重要意义,在T 细胞受体(T cell receptor,TCR)信号的转导中具有中心作用。Gabaev 等通过质谱分析发现,HCMV 膜结合的pUL11 以及可溶性pUL11-Fc 蛋白均可以与CD45 相互作用,当T 细胞与较高浓度的可溶性UL11-Fc (人IgG 的Fc 区域与pUL11 C 末端胞外域融合)融合蛋白孵育后,再用TCR 特异性抗体刺激,T 细胞的增殖减弱。该结果表明,pUL11 可能降低CD45 的活性而抑制T 细胞效应子功能,有助于保护感染细胞免受HCMV 特异性T 细胞的侵害[21]。可见,pUL11 具有免疫抑制特性,通过抑制CD45 破坏T 细胞功能是HCMV 的一种免疫调节策略。
3.5 pUL11 与CD8 T 细胞 Gabaev 将野生HCMV 及其UL11 缺失病毒分别感染人胚肺成纤维细胞后,再与HCMV 立即早期蛋白IE1 和被膜蛋白pp65 抗原特异性的细胞毒性T 淋巴细胞(Cytotoxic T lymphocytes,CTLs)共同培养,结果检测到野生HCMV 及其UL11 缺失病毒组IE1和pp65 蛋白的表达量、人白细胞抗原(Human leukocyte antigen,HLA)以及IFN-γ 的表达水平相似;进一步用慢病毒载体在HEK293T 细胞中高水平表达pUL11 后,用ELISA 的方法检测干扰素产生量,结果IFN-γ 水平与对照组也无差异,表明pUL11 不影响CD8 T 细胞活性[36]。
4 展 望
目前,疱疹病毒UL11 基因及其功能的研究大都是针对人源疱疹病毒的,动物疱疹病毒的研究较少,对多种疱疹病毒UL11 基因的研究将有利于全面阐明UL11 基因的功能和作用。UL11 基因虽然小,但对于病毒粒子复制和装配具有重要意义,因此进一步开展UL11 基因及其编码蛋白与病毒DNA 的复制相关的出芽、包装、囊膜化、释放等机制的研究,不仅可为阐述病毒复制的生命周期提供参考,也有利于了解疱疹病毒致病机理。此外,大多数皮层蛋白均具有免疫逃逸的功能[37-39],UL11 也编码一种皮层蛋白,且与其发生相互作用的pUL16 和gE 也具有逃逸功能[40-41],但UL11 与免疫逃逸的关系报道较少,因此有必要进一步明确其在病毒免疫逃逸中的作用及其作用机制。

