基于RNA-Seq技术分析植物激素信号途径在水稻幼苗中对低温胁迫的应答规律
胡潇婕,毛东海
(1. 中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,湖南 长沙410125;2.中国科学院大学,北京 100049)
水稻(Oryza sativa)是世界主要粮食作物,然而,作为起源于热带与亚热带地区的低温敏感植物,低温灾害天气会导致水稻减产[1]。例如,在我国长江中下游及华南地区的稻作区,早稻播种后,生长中的幼苗常常遭遇3、4月的“倒春寒”天气,导致秧苗黄叶、生长迟缓,甚至卷叶和死亡;并且因此延误晚稻播种,致使晚稻的抽穗开花受到“寒露风”的危害,最终导致水稻减产。随着全球气候变化加剧,低温灾害天气更是频繁发生。因此,低温胁迫已成为我国乃至全球水稻主产区水稻生产的主要限制因素之一[2]。
低温损伤植物的膜系统,从而引起植物体内的一系列生理生化反应[3-4]。为了抵御低温带来的伤害,植物经过一段非致死温度的作用后,通过一系列分子机制,增强对更低温度的耐受性,我们称之为“冷驯化(cold acclimation)”[5]。其中的机制之一就是通过调节体内各类激素的水平,从而调节生理过程,维持生理的稳态[6]。在前人的大量研究工作中,已经报道了植物中的多种激素都参与了对低温逆境的响应[7],包括常见的植物激素——生长素、赤霉素、脱落酸、细胞分裂素、乙烯、油菜素内酯、水杨酸以及茉莉酸等[8-10]。现已基本明确在植物耐低温过程中起正调控作用的激素有脱落酸[11]和茉莉酸[12],起负调控作用的有赤霉素和细胞分裂素[13]。乙烯在不同的作物中对耐低温过程的调控存在一定的差异[7],而生长素、油菜素内酯和水杨酸在植物耐低温胁迫中的作用还不明确。目前的多数研究都致力于探索单个植物激素参与耐低温胁迫的分子机理,而整合所有主要植物激素在低温胁迫下的调控模式则少有报道。
二代高通量测序方法——转录组测序(RNASeq) 技术作为转录组分析的理想工具,具有精准度高、成本低等诸多优点,现已被广泛的应用于水稻耐逆相关功能基因组学研究[14]。在本研究中,我们运用RNA-Seq技术在籼稻品种特青与粳稻品种02428中,对8种植物激素(生长素、赤霉素、脱落酸、细胞分裂素、乙烯、油菜素内酯、水杨酸以及茉莉酸)信号途径中的关键基因进行表达量分析,为深入了解植物激素与水稻苗期低温响应间的相互关系提供参考,也为利用植物激素防治水稻低温伤害提供新的研究思路。
1 材料和方法
1.1 试验材料
供试材料为籼型常规品种特青以及粳型常规品种02428。
1.2 试验方法
1.2.1 培养条件 种子在蒸馏水中浸泡3 d后转移到湿润的滤纸上,37 ℃恒温催芽24 h。苗期使用1/2 Kimura B营养液[15]浇灌,在恒温生长箱中培养,培养条件为:昼夜温度28 ℃/25 ℃,13 h/11 h,相对湿度为70%~80%。待幼苗长至三叶期后转移至昼夜温度保持在10 ℃,13 h/11 h,相对湿度为70%~80%的生长箱中低温处理,持续5 d。处理结束后转移至恒温生长箱中恢复7 d,培养条件同低温处理前。以恢复后的存活率判断植株耐低温性强弱,植株叶片完全枯萎判断为死亡,叶片呈现绿色并仍具有生长迹象判断为存活,存活率=活苗株数/总株数×100%。每次处理设置三个重复,每个重复中幼苗株数约为15株。
1.2.2 RNA提取及文库构建 三叶期水稻幼苗在10 ℃分别低温处理0、3和24 h,取叶片放入液氮中速冻,使用TRIzol®试剂提取叶片中的RNA。随后委托深圳华大基因科技有限公司完成质控、建库及Illumina HiSeqTM2000测序工作[16]。采用双端测序,reads长度为125 bp。
1.2.3 数据处理 测序得到的原始图像数据经base calling转化为序列数据,我们称之为raw reads,原始序列带有一段3'adaptor序列,其中含有少量低质量序列以及各种杂质成分。
对raw reads进行如下处理:去除3'adaptor序列;去除空载Tag;去除低质量Tag;去除长度过小或过大的Tag,取长度为21 nt的Tag;去除拷贝数为1的Tag,最后得到Clean Tag[17]。
1.2.4 差异表达基因的筛选 在本研究中,以特青和02428在低温处理0 h的基因表达量分别作为两品种中的对照,10 ℃处理3 h或24 h作为处理,分别与对照进行比较,确定差异表达基因(differentially expressed gene,DEG)。具体方法参考Audic等[18]的方法,即将差异表达基因定义为与对照相比,伪发现率(FDR,false discovery rate)≤0.001,且表达量改变倍数的对数值的绝对值大于或等于1(|log2Ratio|≥1)的基因。
1.2.5 Gene Ontology功能分析 把所有差异表达基因向Gene Ontology数据库(http://www.geneontology.org/)的各term映射,计算每个term中的基因数目,然后应用超几何检验,找出与整个基因组背景相比,差异表达基因显著富集的GO条目。
1.2.6 KEGG Pathway分析 KEGG数据库(kyoto encyclopedia of genes and genomes,京都基因与基因组百科全书)是目前已知有关通路(pathway)的主要公共数据库[19],我们在KEGG数据库中搜索差异表达基因的KEGG注释,对基因功能信息进行生物学通路的注释、预测以及通路定位,找出显著富集的通路。
1.2.7 qRT-PCR验证 利用TRIzol Reagent提取低温处理0、3以及24 h苗期叶片中的总RNA;使用HiScript II First Strand cDNA Synthesis Kit(Vazyme)试剂盒合成cDNA。随机选取7个差异表达基因并设计引物,使用 ABI StepOne Plus(ABI公司,美国)仪器及 ChamQTM SYBR qPCR Master Mix(Vazyme)试剂盒进行荧光定量检测,其反应程序参考产品说明书,每个样品设置3次技术重复。利用2-ΔΔCt法,以特青及02428品种在低温处理前(0 h)的各基因表达量分别作为对照,分别计算基因在两品种低温处理后的表达倍数,以Log2Ratio值表示,误差线表示标准偏差。以OsActin为内参基因对目的基因进行转录水平的相对定量分析,内参基因及验证基因引物序列见表1。
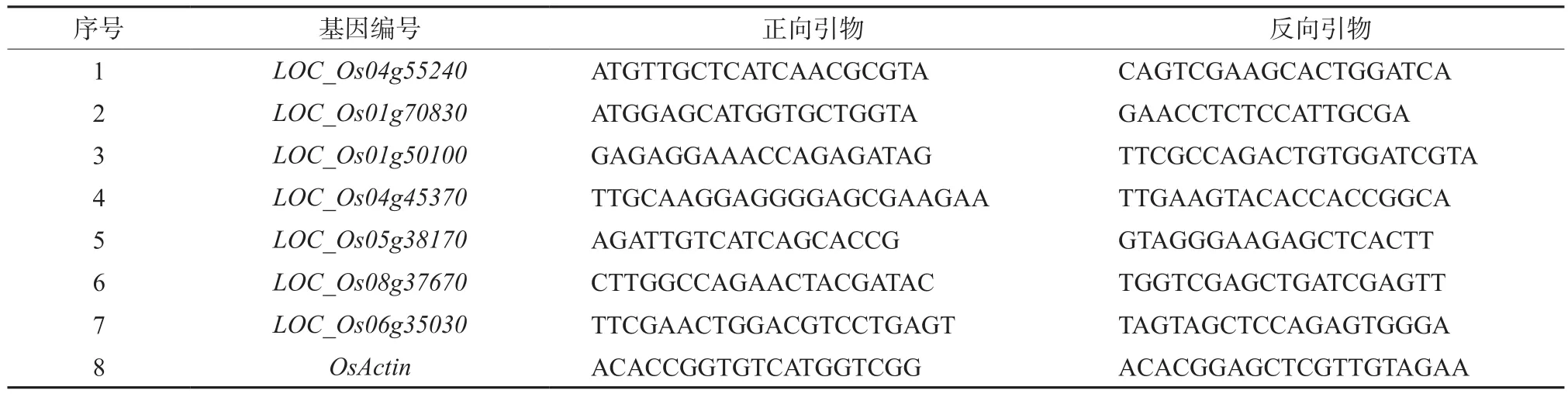
表1 qRT-PCR引物Table 1 Primers used for qRT-PCR analysis
1.2.8 数据统计与分析 用Microsoft Excel 2018进行数据处理、统计分析与图表绘制。利用t-检验分析特青和02428耐低温表型差异的显著性。
2 结果与分析
2.1 苗期耐低温表型差异
为了验证两种试验材料在耐低温性上的差异,我们对正常生长至三叶期的幼苗在10 ℃条件下进行了为期5 d的低温处理,又经过7 d的常温恢复后,两个品种间的表型差异十分明显(图1),02428的存活率显著高于特青。表明在苗期,02428的耐低温性显著强于特青。

2.2 转录组数据质量评估
在本研究中,我们对特青和02428在10 ℃处理0、3和24 h三个时间点的样品进行测序,在6个测序样本中,clean tag的数量在总tag中的占比均超过97%。将clean tag与粳稻品种日本晴的参考基因及参考基因组进行比对,成功注释到参考基因的tag数占总tag的比例均达到82%以上(表2),其中注释到单一参考基因的tag数占总tag数比例达44%以上。在测序饱和度分析中,测序量达到2 000 000时,检测到的基因数趋近饱和,而本研究中的六个样本测序量均超过2 000 000,说明样本的数据饱和度很好,可以用于基因的表达模式分析。
2.3 差异表达基因
在不同时长的低温处理下,我们对特青和02428两个品种进行了转录组分析。如图2所示,在10 ℃处理3 h时,在特青和02428中分别检测到1 654和2 345个差异表达基因:在特青中,表达上调的有667个,下调的有987个;在02428中,上调的有691个,下调的有1 654个;在两品种中,都上调表达的有350个,都下调的有364个。在10 ℃处理24 h时,在特青和02428的样品中分别检测到4 712和5 125个差异表达基因:在特青中,表达上调的有2 076个,下调的有2 636个;在02428中,表达上调的有2 203个,下调的有2 922个;在两品种中,都上调表达的有1 408个,都下调的有1 798个。在24 h处理时,在两品种中检测到的差异表达基因较3 h处理的更多,而且下调表达的基因数始终多于上调表达的基因数。
2.4 qRT-PCR验证基因表达
为了验证转录组数据分析的可靠性,我们从特青与02428中与对照相比具有表达量差异的基因中,随机选择了7个(基因的ID号为:LOC_Os01g38530、LOC_ Os02g44102、LOC_Os01g50100、LOC_Os04g45370、LOC_Os05g38170、LOC_Os06g35030、LOC_ Os02g54600) 进 行 qRT-PCR实验(表1)。使用RNA-Seq和qRT-PCR比较基因表达量,以低温处理前的各基因表达量为对照,分别统计低温处理后各基因在两品种中的相对表达量(以Log2Ratio值表示)。结果表明,LOC_Os01g38530、LOC_ Os02g44102、LOC_Os01g50100、LOC_Os04g45370、LOC_Os05g38170、LOC_Os02g54600在qRT-PCR的验证结果和RNA-Seq中的结果相吻合,而LOC_Os06g35030在qRT-PCR中的log2Ratio值与其转录组数据在数值上存在较大差异,但整体变化趋势一致,都显示该基因受到低温影响表达量下降(图3)。因此,qRT-PCR分析结果表明转录组分析所得的数据具有较高的可靠性。
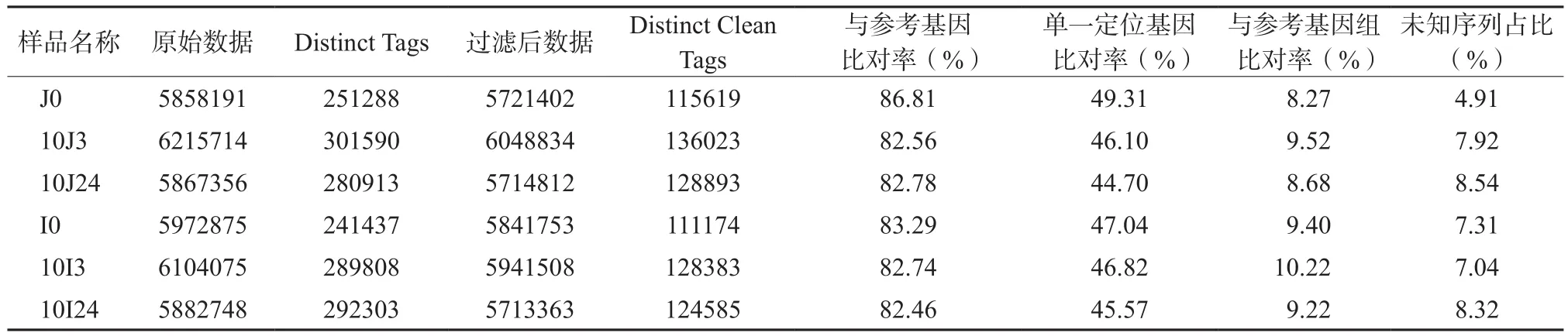
表2 6个文库中获得的tag数量Table 2 Numbers of sequence tags in the 6 transcriptome libraries

图2 特青与02428中的差异表达基因Fig. 2 DEGs in Teqing and 02428
2.5 差异表达基因的GO功能注释分析
低温处理后,特青与02428中的差异表达基因广泛涉及GO功能分类体系中的生物过程(Biological process,BP)、细胞组分(Cellular component,CC)和分子功能(Molecular function,MF)3个大类别中的36个小类别。代谢过程(metabolic process)是生物过程中涉及差异表达基因数目最多的条目,特青和02428在10 ℃处理3 h和24 h时,与整个基因组表达相比,平均有57%的差异表达基因富集到该通路。DNA结合(DNA binding)是分子功能大类中最主要富集的通路,特青和02428在10 ℃处理3 h和24 h时,与整个基因组表达相比,约有14%的差异表达基因富集到该通路。胞间互作(intracellular)是细胞组分大类中涉及差异表达基因数目最多的条目,特青和02428在10 ℃处理3 h和24 h时,与整个基因组表达相比,约有45%的差异表达基因富集到该通路(图4)。

图3 差异表达基因的qRT-PCR与RNA-seq结果对比Fig. 3 Comparation of the differentially expressed genes between qRT-PCR and RNA-seq

图4 低温处理后两个时间点差异表达基因的GO功能分类Fig. 4 Gene Ontology classification of the DEGs of rice at the two time points after cold treatment
2.6 差异表达基因的KEGG通路分析
为了寻找差异表达基因富集的途径,我们对两个品种中所得到的差异表达基因分别进行了KEGG分析。结果表明,将KEGG数据库作为参考,在特青与02428中检测到的差异表达基因可以详细注释到115条KEGG通路。其中,10.6%的差异表达基因富集于植物激素信号转导(ko04075)通路(图5)。由此说明,植物激素信号途径作为一类重要的信号通路,在水稻苗期低温胁迫的响应过程中发挥着重要作用。

图5 低温处理后两个时间点差异表达基因的KEGG代谢途径显著性富集分析Fig. 5 Pathway enrichment analysis of the DEGs of rice at the two time points after cold treatment
2.7 植物激素响应低温胁迫
植物激素,主要包括细胞分裂素(cytokinin,CK)、生长素(indole-3-acetic acid, IAA)、赤霉素(gibberellin,GA)、脱落酸(abscisic acid,ABA)、乙烯(ethylene,ET)、油菜素内酯(brassinosteroid,BR)、茉莉酸(jasmonic acid,JA)和水杨酸(salicylic acid,SA)等,它们在植物的生长发育过程中起着重要作用[20]。植物通过调节体内的各个激素水平来应对受到的多种非生物胁迫[21]。为了进一步探究激素在水稻耐低温中的响应模式,我们对特青和02428两品种中8种激素相关基因的表达量进行了分析。
2.7.1 细胞分裂素相关基因 细胞分裂素信号转导主要是一个磷酸基团转移的过程,在拟南芥中,细胞分裂素与受体AHK(Arabidopsis Histidine Kinases)结合,导致AHK的磷酸化,再将磷酸基团转移到下游的AHP(Histidine Phosphotransfer Protein),AHP进入细胞核后,将磷酸基团转移给B-ARR(Arabidopsis Response Regulator),继而激活转录因子A-ARR[22]。如图6(A)所示,细胞分裂素信号途径中,我们发现两品种中共有10个差异表达基因,其中包括2个AHK同源基因,2个AHP同源基因,2个B-ARR同源基因和4个A-ARR同源基因。在10 ℃处理3 h时,在两品种中均响应低温的差异表达基因包括1个B-ARR同源基因(LOC_Os03g12350),其表达上调,2个A-ARR同源基因(LOC_Os01g72330,LOC_Os04g36070),下调表达。在10 ℃处理24 h时,2个AHK同源基因(LOC_Os02g50480,LOC_Os03g50860)在特青与02428中均下调表达,1个B-ARR同源基因(LOC_Os03g12350)在两品种中均上调表达,3个A-ARR同源基因(LOC_Os01g72330,LOC_Os02g35180,LOC_Os04g36070)在两品种中下调表达。在低温处理后,细胞分裂素途径中的差异表达基因主要为下调表达。
2.7.2 生长素相关基因 在拟南芥中,生长素与TIR1(Transport Inhibitor Response 1)基因结合能够促进TIR1与AUX/IAA(Auxin/ Indoleacetic Acid-induced Proteins)相互作用,而AUX/IAA蛋白则负调控下游的ARF(Auxin Response Factor)转录因子,从而抑制生长素信号通路[23]。如图6(B)所示,在本研究中,我们发现两品种中共有33个差异表达基因,其中包括1个TIR1同源基因,9个AUX/IAA同源基因,6个ARF同源基因,1个GH3(GH3 Auxin-responsive promoter)同源基因和16个SAUR(Small Auxin Up RNA)同源基因。在10 ℃处理3 h时,在两品种中均响应低温的差异表达基因包括4个AUX/IAA同源基因(LOC_Os03g43410,LOC_Os03g58350,LOC_Os05g09480,LOC_Os12g40900),均上调表达;7个SAUR同源基因,其中2个(LOC_Os04g45370,LOC_Os06g50040)下调表达,5个(LOC_Os09g37330,LOC_Os09g37390等)上调表达。10 ℃处理24 h时,在两品种中均响应的基因包括1个TIR1同源基因(LOC_Os11g31620)上调表达,1个AUX/IAA同源基因(LOC_Os01g13030)下调表达;3个ARF同源基因,其中2个(LOC_Os02g04810,LOC_Os06g 48950)上调表达,1 个(LOC_Os04g36054)下调表达;1个GH3同源基因(LOC_Os01g55940),下调表达;6个SAUR同源基因,其中1个(LOC_Os09g 37330)上调表达,4个(LOC_Os04g45370,LOC_Os06g50040,LOC_Os08g35110,LOC_Os09g37394)下调表达,还有1个(LOC_Os09g37430)在特青与02428中呈现相反的表达变化趋势。低温胁迫影响了生长素信号途径中的基因表达,但整体没有明显的上调或下调趋势。
2.7.3 赤霉素相关基因 拟南芥中,赤霉素GA与GID1(GA-INSENSITIVE DWARF1)结合,激活GID1与DELLA蛋白的互作,从而使得DELLA蛋白与E3泛素连接酶GID2的结合更加紧密,最终使DELLA蛋白进入26S降解途径[24]。如图6(C)所示,本研究中,低温条件下特青与02428赤霉素信号途径中的差异表达基因共有47个,其中34个是GID1同源基因,13个是DELLA同源基因。在10 ℃处理3 h时,在两品种中均响应低温的包括10个GID1同源基因,其中3个(LOC_Os03g15270,LOC_Os07g06850,LOC_Os12g15400)上调表达,7个(LOC_Os07g06830,LOC_Os07g44860,LOC_Os08g37040,LOC_Os09g28620,LOC_Os09g28690,LOC_Os09g28740,LOC_Os09g28750)下调表达,6个DELLA同源基因,其中3个(LOC_Os01g65900,LOC_Os04g49110,LOC_Os04g46860)上调表达,3个(LOC_Os02g45760,LOC_Os04g49110,LOC_Os03g48450)下调表达。在10 ℃处理24 h时,在两品种中均响应低温的包括27个GID1同源基因,其中9个(LOC_Os01g06220等)上调表达,18个(LOC_Os03g14730等)下调表达;7个DELLA同源基因,其中3个(LOC_Os01g65900,LOC_Os11g47870,LOC_Os12g38490) 上 调 表 达,4个(LOC_Os02g45760,LOC_Os02g44360,LOC_Os03g48450,LOC_Os06g01620)下调表达。在低温处理后,赤霉素途径中的差异表达基因主要为下调表达,且24 h处理时的差异表达基因多于3 h处理。
2.7.4 脱落酸相关基因 在拟南芥中,当脱落酸存在时,信号途径中的PP2C(2C-type protein phosphatase)活性被PYR/PYL(Refulatory Component of ABA Receptor)抑制,而下游的SnRK2(SNF1-related protein kinase 2)则被激活,从而启动ABA途径中的ABF(ABA-responsive element (ABRE)-binding transcription factor)表达[25]。如图6(D)所示,在我们的分析中,低温条件下,特青与02428中脱落酸信号途径中的差异表达基因共有27个,其中包括3个PYR/PYL同源基因,15个PP2C同源基因,4个SnRK2同源基因,5个ABF(ABA-responsive element (ABRE)-binding transcription factor) 同源基因。在10 ℃处理3 h时,在两品种中均响应低温胁迫的包括1个PYR/PYL同源基因(LOC_Os06g36670),其表达下调;5个PP2C同源基因,其 中 2个(LOC_Os02g05630,LOC_Os09g15670)下调表达,1个(LOC_Os05g46040)上调,另外2个(LOC_Os02g46490,LOC_Os03g10950)在两品种中表达变化趋势相反;1个ABF同源基因(LOC_Os05g41070),其表达量在两品种中变化趋势相反。在10 ℃处理24 h时,在两品种中均响应低温的包括3个PYR/PYL同源基因,其中1个(LOC_Os05g12260)上调表达,2个(LOC_Os06g36670,LOC_Os03g18600)下调表达;11个PP2C同源基因,其中8个(LOC_Os01g40094等)上调表达,3个(LOC_Os02g05630,LOC_Os03g60650,LOC_Os03g61690)下调表达;2个SnRK2同源基因(LOC_Os12g39630,LOC_Os01g46040),均为上调表达;2个ABF同源基因,其中1个(LOC_Os07g48660)上调表达,1个(LOC_Os09g28310)下调表达。该途径中的负调控因子PP2C在低温处理3 h时没有明显变化趋势,而在24 h时多数基因呈现上调表达,其他正调控因子在上调与下调基因数量上没有统一的规律。
2.7.5 乙烯相关基因 拟南芥中,乙烯与受体蛋白ETR(ETH Response)结合并导致受体蛋白失活,使得受CTR1(Constitutive Triple Response 1)负调控的MAPK途径得以激活,并开启EIN2(ETH Insensitive 2)的表达,EIN2激活下游EIN3及其同源蛋白,进而激活下游ERF1/2(ETH Response Factor 1/2)引起一系列乙烯响应反应。同时,EIN3也受到EBF1/2(EIN3-Bind F-box protein 1/2)的负调控[26]。如图6(E)所示,在我们的研究中,两品种在乙烯途径中的差异表达基因共有57个,其中包括3个CTR1同源基因,2个SIMKK(sativa stress-induced MAPKK) 同 源 基 因,6个MPK6(mitogen-activated protein kinase)同 源 基 因,3个EIN2同源基因,43个EBF1/2同源基因。在10 ℃处理3 h时,在两品种中均响应低温的包括1个SIMKK同源基因(LOC_Os02g54600),上调表达;2个MPK6同 源 基 因(LOC_Os03g17700,LOC_Os06g48590),上调表达;1个EIN2同源基因(LOC_Os07g48630),上调表达;15个ERF1/2同源基因,其中11个(LOC_Os04g46220等)上调表达,4个(LOC_Os01g54890,LOC_Os03g22170,LOC_Os02g32140,LOC_Os04g46400)下调表达。在10 ℃处理24 h时,在两品种中均响应低温的包括2个CTR1同源基因(LOC_Os04g52140,LOC_Os06g12590),下调表达;1个SIMKK同源基因(LOC_Os02g54600),上调表达;2个MPK6同源基因(LOC_Os08g06060,LOC_Os05g50120),下调表达;1个EIN2同源基因(LOC_Os07g48630),上调表达;21个ERF1/2同源基因,其中11个(LOC_Os02g43790等)上调表达,8个(LOC_Os03g22170等)下调表达,3个(LOC_Os01g54890,LOC_Os03g64260,LOC_Os01g54890)在两品种中表达变化趋势相反。在乙烯途径中的主要正调控因子如SIMKK、MPK6、EIN2、ERF1/2的同源基因在低温处理3 h和24 h时,都主要表现为上调表达。
2.7.6 油菜素内酯相关基因 拟南芥中,油菜素内酯受体BRI1(BR Insensitive 1)感知到油菜素内酯存在后,能磷酸化BKI1(BRI1 Kinase Inhibitor 1),使其解离到细胞质中从而与BRI1结合,BRI1-BKI1结合体使下游的BSK(BR-Signaling Kinase)磷酸化,进而引起下游的BSU1(BRI Supressor 1)去磷酸化,去磷酸化后的BSU1蛋白可以抑制BIN2(Brassinosteroid Insensitive 2)的活性,而BZR1/2(BR Resistant 1/2)则被去磷酸化,引起下游基因表达[27]。如图6(F)所示,低温能诱导特青和02428中的油菜素内酯相关基因表达。我们在两品种中共检测到20个差异表达基因,其中包括在油菜素内酯信号通路中起正调控作用的2个BRI1(BR Insensitive 1)同源基因,3个BSK(BR-Signaling Kinases)同源基因,1个BKI1(BRI1 Kinase Inhibitor 1)同源基因,1个BSU1(BRI Supressor 1)同源基因,3个BZR1/2(BR Resistant 1/2)同源基因,3个TCH4(Xyloglucan endotransglycosylase)同源基因,5个CYCD3(cyclin D3)同源基因,以及起负调控作用的2个BIN2(Brassinosteroid Insensitive2)同源基因。在10 ℃处理3 h时,在两品种中均响应低温的包括1个BSK同源基因(LOC_Os10g42110),但它在两品种中表达变化趋势相反;1个BKI1同源基因(LOC_Os08g26970),下调表达;1个BIN2同源基因(LOC_Os01g10840),上调表达;1个BZR1/2同源基因(LOC_Os02g13900),上调表达;1个TCH4同源基因(LOC_Os04g51460),上调表达;2个CYCD3同源基因(LOC_Os09g02360,LOC_Os03g42070),下调表达。在10 ℃处理24 h时,在两品种中均响应低温的包括1个BRI1同源基因,上调表达;2个BSK同源基因,上调表达;1个BKI1同源基因,下调表达;1个BIN2同源基因(LOC_Os05g11730),下调表达;2个BZR1/2同源基因,其中1个上调表达(LOC_Os06g35900),1个(LOC_Os07g39220)下调表达;1个TCH4同源基因(LOC_Os06g48200),上调表达;2个CYCD3同源基因(LOC_Os09g02360,LOC_Os03g42070),均下调表达。油菜素内酯信号途径中的正负调控因子在低温处理后未表现出统一的表达变化趋势。

图6 各类植物激素信号通路中的关键基因对低温响应的表达量热图Fig. 6 Heatmap of differentially expressed genes involved in plant-hormone pathways
2.7.7 茉莉酸相关基因 拟南芥处于正常生理状态时,茉莉酸水平很低,JAZ(Jasmonate ZIM-domain) 结 合 MYC2(MYC-related Transcriptional Activator 2)并抑制JA应答基因的转录[28];当植物处于胁迫状态时,体内JA转变为具有高生物活性的JA-Ile(jasmonoyl-L-isoleucine),促使COI1(Coronatine Insensitive 1)与JAZ结合,它们形成的SCFCOI1/JAZs复合体被E3泛素连接酶识别,使JAZ进入26s降解途径,而MYC2则被释放,进而启动JA应答基因的表达[29]。如图6(G)所示,在本研究中,两品种中响应低温的茉莉酸相关差异表达基因共有10个,其中负调控因子JAZ同源基因有7个,正调控因子COI1,MYC2和ORCA3(octadecanoid-derivative responsive Catharanthus AP2-domain protein 3)同源基因各有1个。在10 ℃处理3 h时,在两品种中均响应低温的包括5个JAZ同源基因(LOC_Os03g08320等),1个MYC2同源基因(LOC_Os10g42430),1个ORCA3同源基因(LOC_Os10g41330),它们均为上调表达。在10 ℃处理24 h时,在两品种中均响应低温的包括1个COI1同源基因(LOC_Os05g37690),表达上调;4个JAZ同源基因,其中1个(LOC_Os03g08320)上调,3个(LOC_Os07g42370,LOC_Os03g08330,LOC_Os10g25230)下调。茉莉酸信号途径中的负调控因子JAZ由处理3 h的上调表达变为24 h的多数下调表达,而正调控因子在处理3 h和24 h时都上调表达。
2.7.8 水杨酸相关基因 在拟南芥中,NPR1(Nonexpressor of PR 1)是水杨酸信号途径中一个十分重要的正调控因子,NPR1在细胞核中通过与TGA(TGACG-Binding Factor 1)互作来调控PR-1(Pathogenesis-related Protein 1)的表达[30]。 如图6(H)所示,在本研究中,两品种中响应低温的有12个水杨酸相关差异表达基因,其中包括6个NPR1同源基因,1个TGA同源基因,5个PR-1同源基因,它们均为水杨酸途径中的正调控基因。在10 ℃处理3 h时,在两品种中均响应低温的包括1个NPR1同源基因(LOC_Os01g56200),上调表达;1个PR-1同源基因(LOC_Os07g03710),它在两品种中的表达变化趋势相反。在10 ℃处理24 h时,在两品种中均响应低温的包括2个NPR1同源基因,其中1个(LOC_Os01g56200)上调表达,1个(LOC_Os03g46440)下调表达;1个TGA同源基因(LOC_Os11g05480),下调表达;4个PR-1同源基因,其中3个(LOC_Os07g03600,LOC_Os07g03710,LOC_Os07g03730)上调表达,1个(LOC_Os02g54560)下调表达。在处理24 h时水杨酸信号通路中的差异表达基因多于3 h处理,且多数差异表达基因受低温诱导表达上调。
3 讨论
在前人的研究中,已有利用转录组数据分析激素调控水稻耐低温性的报道。例如,Yang等[31]对水稻品种TNG67和TCN1进行比较转录组分析,寻找影响水稻耐低温性的激素,并探讨了激素之间的互作关系。在本研究中,我们对所得到的差异表达基因进行KEGG分析后,发现特青与02428品种内的差异表达基因均显著富集于植物激素信号通路,说明植物激素信号通路在水稻苗期低温响应中发挥着十分重要的作用。
细胞分裂素是促进植物细胞分裂的激素。非生物胁迫会减少植物体内的细胞分裂素含量,例如小麦受到低温胁迫时,会激活体内的细胞分裂素氧化酶,从而降低内源细胞分裂素水平[32]。在我们的研究中,受到低温胁迫时,细胞分裂素信号途径中A-ARR和AHK同源的基因下调表达,所以我们认为低温与细胞分裂素信号通路可能存在负相关性,与前人的研究相符合。
生长素作为一类重要的植物激素,在植物的生长发育进程中起着不可替代的重要作用,生长素通过与其它激素互作来调控植物的生长发育,但对于生长素如何参与调控植物耐低温还所知甚少[9]。我们的转录组分析结果显示,低温能影响生长素信号基因的表达。生长素信号途径中的正调控因子SAUR在生长素早期响应的三类家族(GH3、AUX/IAA和SAUR)中是感应生长素最快的一类,而SAUR在10 ℃处理3 h时,在两品种中多表现为上调表达,在24 h处理时,则多数表现为下调表达,而且GH3和ARF等同源基因在24 h时的表达量也下调,我们推测这可能是由于低温刺激导致了生长素水平的先升高,随后回落,引起位于信号通路下游SAUR同源基因的表达量先升后降。
赤霉素是常见植物激素之一,至今已发现100多种,总称为赤霉素类[33]。有研究发现,CBF基因表达会影响植物内源GA的水平[34],低温诱导和CBF1过表达都能引起植物内源赤霉素含量下降,从而促进DELLA蛋白积累,导致植物生长变缓,耐低温性增强[24]。在本研究中,赤霉素途径中DELLA的同源基因在上调与下调的数量上没有明显差异,而正调控因子GID1同源的差异表达基因在两个处理时间点在两品种中下调表达的基因数量都较上调更多,据此我们推测赤霉素在水稻苗期耐低温响应中起负调控作用,这一结果也与前人的研究相吻合。
低温诱导往往导致植物体内脱落酸含量上升。研究表明,多种植物在施加脱落酸后耐低温性增强,在施加了脱落酸的拟南芥中观察到多个COR基因表达量提高,包括RAB18,RD29A和KIN2[35,36]。Lee等[37]发现脱落酸信号途径中的ABF2能与DREB2C互作,但是,并不是所有的植物在施加脱落酸的条件下都能激发CBF基因的表达,例如大麦在施加脱落酸后,CBF基因的表达没有明显变化[38]。在我们研究中,10 ℃处理24 h时,11个属于PP2C家族的差异表达基因中,有8个表达上调,而通路中的正调控因子表达量没有统一的变化趋势。结合前人的研究,我们推测在水稻受到低温胁迫时脱落酸途径被激活,提高了植物的耐低温性,而在胁迫后期(24 h)脱落酸水平回落,导致PP2C表达量上升。
在植物中,乙烯参与响应许多生物和非生物胁迫[39]。例如,在黄瓜、西红柿、向日葵、烟草等多种植物中,乙烯合成的增多都能使植物耐低温性增强[40-42]。对烟草施加促进乙烯合成的ACC(1-氨 基-环 丙 烷-1-羧 酸,1-aminocyclopropane-1-carboxylic acid),植株的耐低温性增强,施加抑制乙烯合成的AVG(2-氨基乙氧基乙烯甘氨酸,aminoethoxyvinylglycine)或乙烯受体拮抗剂硝酸银,植株的耐低温性减弱[42]。本研究发现,在10 ℃处理3 h与24 h时,乙烯信号通路中的大部分正调控基因表达量上调,例如SIMKK、MPK6、EIN2和ERF1/2的同源基因,这一结果说明乙烯在水稻苗期耐低温中起正调控作用。
油菜素内酯调控细胞的伸长和分裂,促进植物茎秆伸长[6]。BRI是油菜素内酯信号通路中的正调控因子,有研究发现,拟南芥bri1突变体的耐低温性增强[43],而BRI1过表达植株则较野生型耐低温性减弱[44]。此外,外施油菜素内酯还能促进CBF信号通路中的COR15A基因表达[45]。在本研究中,油菜素内酯信号通路中负调控基因和正调控基因在受到低温影响后没有统一的表达量变化趋势,所以油菜素内酯信号途径中基因表达量的变化是否与水稻苗期耐低温性有关,还有待进一步的研究。
茉莉酸参与了植物体内多种生理生化进程,如根的生长、种子萌发、导管形成、卷须缠绕、感夜性、雄性育性、花色素苷积累以及植株衰老等[46]。有研究报道对拟南芥外施茉莉酸能增加植物耐低温性,而且在受到低温胁迫时,植物内源的茉莉酸含量也增加[10,47]。在本研究中,特青与02428中茉莉酸信号途径中的JAZ同源基因在10 ℃处理3 h时上调表达,而24 h处理时大部分下调表达,我们推测,这是由于在处理后期低温胁迫使水稻幼苗中的茉莉酸水平上升,造成JAZ蛋白降解,解除了JAZ对ICE1的抑制,从而激活下游的茉莉酸信号途径,提高植物抵抗低温逆境的能力。
水杨酸被认为主要参与了植物响应生物胁迫的过程[48],同时水杨酸也能调控植物的生长发育过程,高浓度的水杨酸会抑制植物生长,而低浓度水杨酸则可以促进植物生长[49]。关于水杨酸与植物耐低温的关系,Kang等[50]曾报道在对玉米、黄瓜和水稻进行低温处理前喷施水杨酸溶液可以在一定程度上提高植物的耐低温性。在本研究中,10 ℃处理24 h时水杨酸信号通路中的差异表达基因多于3 h处理,我们推测这是由于在低温处理早期,水杨酸信号途径对低温的响应较弱。而水杨酸信号途径中的差异表达基因在两品种中的表达变化趋势与低温处理没有明显相关性,所以我们认为水杨酸与水稻耐低温性之间具体关系的确定还需要更深入的研究。
4 结论
1)低温胁迫能够诱导或抑制细胞分裂素、生长素、赤霉素、脱落酸、乙烯、油菜素内酯、茉莉酸及水杨酸共8种植物激素信号途径中的基因表达;在籼稻品种特青和粳稻品种02428中,低温响应的差异表达基因均显著富集在植物激素信号转导途径中。
2)在低温处理3h(处理前期)和24h(处理后期)时,水稻激素信号转导途径中差异表达基因的数量及表达量均有所差异,根据激素信号转导途径中关键基因的表达量变化趋势,我们认为在水稻苗期耐低温过程中可能起正调控作用的激素是乙烯、脱落酸和茉莉酸,起负调控作用的激素是细胞分裂素和赤霉素。

