NRF1抑制RNA病毒诱导的抗病毒天然免疫反应
齐 飞,周 斌,韩旭凌,李鹏程,武舫伊,钱 峰
(1.复旦大学 生命科学学院,上海 200438; 2.复旦大学 现代人类学教育部重点实验室,上海 200438)
病毒感染所诱导的免疫应答由宿主和病原体之间的特异性信号传导级联形成.宿主细胞配备有多种模式识别受体(Pattern-Recognition Receptors, PRR),以识别病原体相关分子模式.病毒相关分子模式通常以核酸为基础,包括双链(ds)RNA,单链(ss)RNA和病毒DNA[1].RIG-Ⅰ样受体(RIG-Ⅰ Like Receptor, RLR)是PRR中关键的成员[2],包括视黄酸诱导基因Ⅰ(Retinoic acid-Inducible Gene Ⅰ, RIG-Ⅰ)和黑素瘤分化相关蛋白5(Melanoma Differentiation-Associated protein 5, MDA5).RIG-Ⅰ识别ssRNA病毒,而MDA5主要负责识别微核糖核酸病毒家族成员[3-5],通过下游信号分子激活免疫应答.
病毒感染细胞会激活细胞免疫反应产生Ⅰ型干扰素(Interferon, IFN).大多数有核细胞具有产生和响应Ⅰ型干扰素的能力[6].Ⅰ型干扰素以非常低的水平组成型表达,受病毒感染诱导至高水平[7].RIG-Ⅰ和MDA5检测细胞质中的RNA结构,激活下游信号通路,导致干扰素调节因子3(Interferon Regulatory Factor 3, IRF3)磷酸化入核,磷酸化的转录因子IRF3与IFN基因特定启动子元件结合激活转录.释放到胞外的干扰素进一步与细胞膜表面受体结合启动更多的干扰素和干扰素诱导基因的表达,发挥抗病毒效应[8-10].
核呼吸因子(Nuclear Respiratory Factor 1, NRF1)是由核基因编码的能调控线粒体呼吸链表达的转录因子.人的NRF1基因与海胆和果蝇翅膀中的P3A2基因同源[11].基因位于染色体7q32.2,编码出大小为68 kDa的核蛋白[12].NRF1激活线粒体呼吸链蛋白组份的表达,调节线粒体运输蛋白和线粒体氧化应激相关蛋白,参与雌激素介导的线粒体生物合成和细胞代谢[13].NRF1与乳腺癌发生发展相关[14],其动态转录调节与癌症风险的预测、疗效预判密切相关[15].NRF1还参与调控端粒的转录,影响人体健康[16].
NRF1在免疫应答领域尚未被研究.文献报道NRF1在流感疫苗接种的免疫应答人群中活性增强[17],暗示NRF1参与了机体的免疫反应.本研究发现了NRF1在抗病毒天然免疫领域的新功能.实验发现NRF1参与细胞抗病毒免疫反应,调节了干扰素的产生.
1 材料与方法
1.1 材料
HEK293T细胞为本实验室保存;TRI Reagent试剂购自Sigma公司;实时定量PCR试剂购自Biomake公司;RIPA蛋白裂解液购自碧云天;NRF1和GAPDH抗体购自Proteintech公司;双荧光素酶报告基因检测试剂盒购自全式金公司;转染试剂购自翊圣生物公司;Protein A/G agarose beads购自Santa Cruz公司.
1.2 细胞培养与荧光成像
HEK293T细胞培养于10%FBS和1%的青霉素-链霉素双抗DMEM培养基,于37℃,5%CO2细胞培养箱培养.细胞感染VSV-GFP病毒(MOI=0.01)8h后,LEICA DFC310 FX荧光显微镜成像.
1.3 慢病毒感染建立敲低细胞系
慢病毒包装时,取生长状态良好的HEK293T细胞,铺于六孔板细胞培养皿中,利用转染试剂共转shRNA的慢病毒载体质粒、psPAX2(病毒包装质粒)和pMD2.G(病毒衣壳质粒),12h后换液,48h后收集病毒上清,4000r/min离心10min,取上清感染生长状态良好的HEK293T细胞,感染24h后传代并用含有2μg/mL的嘌呤霉素培养基筛选.

表1 shRNA引物设计
1.4 Western blot
细胞弃去培养基,用PBS(137mmol/L NaCl,2.7mmol/L KCl,10mmol/L Na2HPO4,2mmol/L KH2PO4)洗干净后,加入RIPA裂解液将细胞重悬置于冰上裂解25min,4℃离心10min后取上清,加入相应量蛋白上样缓冲液,煮沸5min,取适量进行SDS-PAGE电泳,电泳结束后300mA恒流转膜90min至PVDF膜,5%BSA封闭1h,TBST洗3次(每次5min),加入一抗(1∶1000,5%BSA稀释)4℃孵育过夜,TBST洗3次,再加相应二抗(1∶1000,5%BSA稀释)室温孵育1h,加入显色液拍照.
1.5 双荧光素酶报告基因实验
将细胞接种于24孔板中,待细胞密度达到80%,进行转染实验;每孔内加入50ng海参荧光素酶报告质粒、50ng的萤火虫荧光素酶报告基因质粒和适量的目的基因质粒,对照组用空载体配平,16h后用双荧光素酶报告基因检测试剂盒检测.用吸引泵吸去上清,加入裂解液,置于常温摇床裂解15min,吹打混匀裂解产物,将样品吸至96孔酶标板中,分别依次加入试剂盒中的底物,上机检测.
1.6 RNA抽提
细胞弃去培养基后使用PBS将培养基洗干净,加入TRI Reagent裂解,充分震荡打匀后,加入三氯甲烷震荡,4℃离心取上清,加入等量异丙醇充分混匀后15000r/min离心10min,沉淀用75%乙醇洗涤,离心,弃上清,晾干,加入适量DEPC处理的水溶解,保存于-80℃冰箱.

表2 qPCR引物设计
1.7 实时荧光定量PCR
RNA通过反转录试剂盒去基因组和反转录步骤获得cDNA.在CFX-96系统(Bio-Rad)中使用SYBR Green和基因特异性引物进行扩增,Actin基因作为内参.定量PCR引物根据表2序列合成.
1.8 免疫共沉淀实验
实验前将Protein A/G agarose beads用NETN(100mmol/L NaCl,20mmol/L Tris-Cl(pH 8.0),0.5mmol/L EDTA,0.5%P-40)清洗5次;细胞用PBS清洗后,置于冰上加入NETN裂解液充分裂解;4℃,15000r/min离心10min,收取上清,取少量做全细胞裂解液,剩余上清用适量Protein A/G Agarose Beads,4℃孵育过夜封闭,封闭后4℃ 1000g/min离心5min;沉淀用NETN清洗5次,加入适量的蛋白上样缓冲液,煮沸5min,-80℃冰箱冻存,上清加入相应抗体4℃摇床孵育2h;加入适量Protein A/G agarose Beads,孵育1h,弃上清,NETN清洗5次,加入适量的蛋白上样缓冲液,煮沸5min,-80℃冰箱冻存.
1.9 统计分析
研究中数值用“均值±标准差”表示,实验均重复3次以上,组间通过GraphPad Prism 6软件的t-检验进行统计学分析.
2 结 果
2.1 NRF1参与细胞抗病毒反应
为了研究NRF1在病毒感染下的表达情况,通过水疱性口炎病毒(VSV)感染HEK293T细胞.结果显示NRF1的蛋白表达水平随病毒感染上升(图1(a)).表明NRF1可能受病毒诱导表达,并参与到抗病毒天然免疫应答.
为了探索NRF1在细胞抗病毒反应中的潜在作用,构建NRF1敲低的HEK293T细胞系.内源性的NRF1蛋白的敲低水平通过Western blot的方法进行检测(图1(b))所示.利用NRF1敲低HEK293T细胞系进行病毒复制实验,用带有GFP荧光的VSV病毒感染8h.结果表明NRF1敲低组相比较于对照组,荧光强度明显减弱,说明在敲低NRF1的细胞中病毒复制能力减弱(图1(c))所示.同时利用qPCR的方法进行VSV RNA定量检测,发现病毒的复制量在NRF1敲低的细胞中明显少于对照组(图1(d))所示.以上结果表明,NRF1参与细胞的抗病毒反应.

图1 NRF1参与细胞抗病毒反应Fig.1 NRF1 is involved in cellular antiviral response(a) VSV(MOI=0.1)病毒刺激0h,2h,8h,12h,Western blot检测NRF1蛋白水平变化;(b) Western blot检测NRF1敲低细胞系中NRF1的蛋白表达量;(c) VSV-GFP(MOI=0.01)感染正常组和NRF1敲低组细胞,8h后荧光显微镜拍摄(标尺: 200μm);(d) qPCR检测VSV RNA水平.**P<0.01,***P<0.001.
2.2 NRF1抑制病毒诱导的细胞因子和趋化因子的产生
通过在HEK293T细胞中过表达NRF1研究其对病毒诱导的免疫应答的影响.Western blot检测NRF1-Flag质粒的表达(图2(a),@@@470页).用VSV病毒感染过表达NRF1的HEK293T细胞,qPCR检测诱导产生的细胞因子IFN-βRNA和趋化因子CCL5RNA的表达水平.结果显示过表达NRF1后细胞受病毒刺激所产生的IFN-βRNA和CCL5RNA显著下降(图2(b)).表明NRF1抑制病毒诱导的细胞因子和趋化因子的产生.

图2 NRF1抑制病毒诱导的细胞因子和趋化因子的产生Fig.2 NRF1 inhibits virus-induced production of cytokines and chemokines(a) Western blot实验检测NRF1过表达质粒表达情况;(b) 将NRF1过表达质粒转入HEK293T细胞中16h后,用VSV病毒(MOI=0.1)刺激12h,qPCR检测细胞因子IFN-β RNA和趋化因子CCL5 RNA的表达变化.*P<0.05.
2.3 NRF1抑制SeV诱导的干扰素信号激活
已知仙台病毒(SeV)能被RIG-Ⅰ识别,而RIG-Ⅰ介导的RLR抗病毒信号通路是关键的抗病毒天然免疫信号通路.为了验证NRF1是否对RLR信号通路有影响,通过双荧光素酶报告基因实验分别对RLR通路相关下游靶基因的启动子(IFN-β-luc、ISRE-luc和NF-κB-luc)活性进行检测.在HEK293T细胞中过表达NRF1,同时分别转入IFN-β-luc、ISRE-luc和NF-κB-luc报告基因质粒,16h后,用SeV病毒刺激12h,裂解细胞加入试剂盒底物通过双荧光素酶检测仪检测.结果发现病毒诱导的IFN-β-luc、ISRE-luc和NF-κB-luc活性都随着NRF1表达量的增加而降低(图3),说明NRF1抑制SeV诱导的干扰素信号激活.

图3 NRF1抑制SeV诱导的干扰素信号激活Fig.3 NRF1 inhibits SeV-induced interferon signaling activationNRF1抑制SeV诱导的RLR信号通路下游靶基因启动子(a) IFN-β-luc, (b) ISRE-luc, (c) NF-κB-luc的激活.在HEK293T细胞中共转NRF1(100~200ng)、pRL-TK(50ng)和如图所示启动子报告基因质粒(50ng),16h后,用SeV病毒(MOI=1)刺激12h,收集样品上机检测,所有实验均用空载质粒配平.
2.4 NRF1抑制RLR信号通路的激活
在RLR信号通路中,RIG-Ⅰ首先识别病毒的RNA,招募下游位于线粒体外膜的接头蛋白MAVS,MAVS接受信号后多聚化将信号传递给下游激酶TBK1,TBK1和IKKε形成复合物磷酸化转录因子IRF3,磷酸化激活的IRF3入核结合到IFN-β特定的结构域,启动IFN-β的表达,发挥抗病毒天然免疫功能.
为了探究NRF1在RLR信号通路中作用的靶点.在HEK293T细胞系中分别过表达RLR信号通路中关键分子RIG-Ⅰ、MAVS、TBK1、IKKε和IRF3,激活RLR信号通路.同时过表达NRF1检测其对该信号通路的影响.结果如图4所示,显示NRF1抑制IRF3或其上游信号分子所介导的IFN-β报告基因的激活.表明IRF3是NRF1在RLR信号通路中潜在的作用靶点.
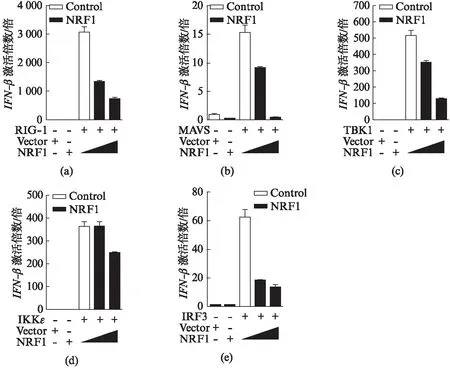
图4 NRF1抑制RLR信号通路的激活Fig.4 NRF1 inhibits activation of the RLR signaling pathwayNRF1抑制RLR信号通路中关键分子(a) RIG-Ⅰ,(b) MAVS,(c) TBK1,(d) IKKε和(e) IRF3所介导的IFN-β报告基因的激活.在HEK293T细胞中共转NRF1(100~200ng)、IFN-β-luc(50ng)、pRL-TK(50ng)和如图所示关键分子质粒,16h后检测IFN-β-luc的活性,所有实验均用空载质粒配平.
2.5 NRF1与转录因子IRF3的相互作用

图5 NRF1与转录因子IRF3的相互作用Fig.5 Interaction between NRF1 and transcription factor IRF3在HEK293T细胞中共转NRF1-Flag和IRF3-HA,16h后收样,通过免疫共沉淀实验检测二者的相互作用.
双荧光素酶报告基因实验表明NRF1潜在的作用靶点是IRF3.通过免疫共沉淀的实验方法,将带有Flag标签的NRF1质粒与带有HA标签的IRF3质粒共转入HEK293T细胞中,16h后收取样品,进行免疫共沉淀实验.结果发现NRF1与IRF3存在相互作用.该实验结果表明NRF1可能通过与IRF3互作来抑制RLR信号通路的激活.
3 讨 论
NRF1蛋白可以通过同源二聚的形式结合到特定的DNA识别序列来调控靶基因的转录[12].研究人员发现NRF1在胶质母细胞瘤衍生的细胞中调控691个基因转录,这些基因参与调节细胞生长、代谢能量产生、蛋白质翻译和DNA复制/修复[18-19].此外,NRF1调节线粒体相关基因的转录,特别是调控线粒体氧化呼吸链中重要基因的表达.
本研究首次揭示NRF1参与抗病毒天然免疫.通过病毒感染实验发现NRF1受病毒诱导上调.在细胞中敲低NRF1,用带GFP荧光的VSV进行感染,结果发现敲低组细胞病毒载量变少.过表达NRF1抑制病毒诱导的细胞因子和趋化因子的产生.这些结果表明NRF1在机体免疫系统中扮演着至关重要的角色.
在RLR信号通路中,RIG-Ⅰ识别病毒的RNA后,招募接头蛋白MAVS,接受信号的MAVS多聚化,继续将信号传递给下游激酶TBK1,TBK1和IKKε形成复合物磷酸化转录因子IRF3,磷酸化激活的IRF3入核结合到IFN-β特定的结构域,启动IFN-β的表达,发挥抗病毒天然免疫功能.通过过表达NRF1抑制了IRF3或其上游信号分子介导的干扰素的激活.利用免疫共沉淀的方法发现NRF1与IRF3存在相互作用.结果表明NRF1是通过RLR信号通路下游的转录因子IRF3来发挥其抑制功能.NRF1可能通过影响NRF1影响IRF3与IFN-β启动子的结合抑制其转录活性.
天然免疫反应受到细胞内信号分子的精确调控,过强的免疫反应会诱导细胞因子风暴,对机体造成免疫病理损伤.本研究表明NRF1是作为RLR信号通路的抑制因子,它的作用可能是为了控制免疫过激.对于防止机体免疫病理损伤具有重要作用.

