维氏气单胞菌AcrV基因的克隆与原核表达
孔祎頔,田佳鑫,赵林辉,陈秀梅,单晓枫,王桂芹
(吉林农业大学 动物科学技术学院,吉林 长春 130118)
维氏气单胞菌(Aeromonasveronii)是一种极其重要的人、兽及水生生物共患病原菌,又名维罗纳气单胞菌、凡隆气单胞菌,广泛存在于养殖水环境中,其绝大部分菌株具有较强的致病性[1-2]。近年来,国内维氏气单胞菌引发的水产疾病呈上升趋势,如泥鳅[3-4]、乌鳢[5]及鲶[6]等因感染维氏气单胞菌而出现腹水或出血等症状,给水产养殖业造成了巨大的经济损失。此外,维氏气单胞菌还能通过水源、伤口感染等途径进行传播,引起人类的肠胃炎、食物中毒等[7]。目前,针对维氏气单胞菌所引起的水产疾病多采用抗生素药物治疗,这不仅会导致药物在水产动物体内残留,而且还会引起多种耐药菌株的增加[8]。大量研究表明,接种疫苗是现阶段防治细菌类疾病的有效措施,除了能够安全、高效地治疗水产疾病,还有利于改善水体环境的污染,进而更好地解决水产品质量安全问题[9-10]。因此,开发针对维氏气单胞菌感染的新型疫苗是水产动物健康养殖发展的新方向。
维氏气单胞菌中存在诸多与其致病性密切相关的毒力因子,如脂多糖(LPS)、外膜蛋白(OMPs)、气溶素(Aer)、细胞毒性肠毒素(Act)及鞭毛(FlaA、FlaB)等[9],而有关低钙反应蛋白(AcrV)与毒力的关系尚未见报道。相关研究表明,PcrV蛋白为铜绿假单胞菌(Pseudomonasaeruginosa)Ⅲ型分泌系统(T3SS)中的转运体蛋白,直接输送细菌产生的毒力蛋白到达宿主细胞,造成对宿主细胞免疫功能的干扰[11]。同时,PcrV蛋白在Ⅲ型分泌系统的效应蛋白分泌调控中起着关键的作用,具有较好的免疫作用[12]。据有关报道,在鼠疫耶尔森氏菌中LcrV是重要的毒力因子,同时也是主要的保护性抗原,LcrV基因的表达调控着YopB和YopD 2个效应蛋白[13]。此外,LcrV是一种分泌性多功能蛋白,在适当条件下鼠疫耶尔森氏菌能分泌该蛋白,附着于菌体表面[14]。本课题组前期研究表明,AcrV基因与LcrV基因的同源性接近100%,故可推测AcrV与LcrV基因可能具有类似的功能,AcrV蛋白可能在维氏气单胞菌侵袭宿主的过程中发挥重要作用, 但这还需要试验证实。为此,本试验以鱼源维氏气单胞菌TH0426菌株为研究对象,对其AcrV基因进行了克隆及原核表达,以期为深入探索AcrV基因的功能提供参考,同时也为进一步制备维氏气单胞菌基因工程亚单位疫苗奠定理论基础。
1 材料与方法
1.1 材 料
1.1.1 菌株及试验动物 鱼源维氏气单胞菌TH0426菌株,由吉林农业大学预防兽医学实验室保存;大肠杆菌Trans T1、BL21(DE3) 工程菌购自北京全式金生物技术有限公司;2周龄BALB/c小鼠20只,平均体质量为20~22 g/只,由吉林省实验动物中心提供。
1.1.2 主要试剂 限制性内切酶EcoR Ⅴ、XhoⅠ及T4 DNA连接酶、克隆载体 pMD18-T、表达载体pET-30a(+)和BCA蛋白定量试剂盒,均购自宝生物工程(大连)有限公司;广谱蛋白Marker、预染彩虹蛋白Marker,购自北京全式金公司;DNA 凝胶回收试剂盒、质粒小量提取试剂盒、细菌基因组提取试剂盒,购自天根生化科技(北京)有限公司;BCA蛋白浓度测定试剂盒,购自北京索莱宝科技有限公司;HisPur Ni-NTA Spin Columns,购自Thermo公司;气单胞菌鉴别用Rimler-Shotts琼脂培养基,购自北京路桥技术有限责任公司。
1.2 方 法
1.2.1 引物的设计与合成 根据NCBI上GenBank已登录的维氏气单胞菌TH0426全基因组序列(GenBank登录号:CP012504.1)[15],利用Primer 5.0软件设计1对特异性引物,上游引物P1:5′-CG-
GATATCATGAGCACTATCCCTGACTAC-3′(下划线部分为EcoR Ⅴ酶切位点),下游引物P2:5′-AACTCGAGTCAAATTGCGCCAAGAA-3′(下划线部分为XhoⅠ酶切位点)。引物由吉林省库美生物科技有限公司合成。
1.2.2AcrV基因的克隆 将维氏气单胞菌TH0426菌株的菌液划线接种于Rimler-Shotts平板上,30 ℃培养24 h,挑取单菌落接种于LB 培养基中培养24 h,用细菌基因组提取试剂盒提取基因组 DNA。以提取的DNA为模板,PCR 扩增AcrV基因,PCR反应体系为25 μL:2×ESTaqMasterMix 12.5 μL,引物P1和P2各1 μL,DNA模板2 μL,ddH2O 8.5 μL。反应条件为:94 ℃ 预变性5 min;94 ℃变性1 min,62 ℃退火1 min,72 ℃延伸1 min,30个循环;72 ℃再延伸10 min。PCR扩增产物用1%琼脂糖凝胶电泳进行检测。
1.2.3 pMD18-T-AcrV重组载体的构建 切胶回收AcrV基因,与pMD18-T载体在16 ℃下连接过夜,构建重组载体pMD18-T-AcrV,连接产物转化到大肠杆菌Trans T1感受态细胞中,进行蓝白斑筛选,挑取白色克隆菌落接种于LB液体培养基中培养,对菌液进行PCR鉴定,并提取阳性菌质粒,用限制性内切酶EcoR Ⅴ和XhoⅠ进行双酶切鉴定。然后将PCR和双酶切鉴定正确的阳性质粒送往吉林省库美生物科技有限公司进行测序,通过DNAstar软件将测序结果与GenBank中已公布的维氏气单胞菌TH0426全基因组(GenBank登录号:CP012504.1)进行比对。
1.2.4AcrV基因编码蛋白的生物信息学分析 应用EditSeq翻译出AcrV基因编码的氨基酸序列,用ProtParam预测编码产物的基本理化性质,用ProtScale分析其疏水性,SingalP v3.0分析其信号肽,TMHMM v2.0 分析其跨膜区,COILS Server分析其Coil区,SMART分析其结构域,TargrtP 1.1分析其亚细胞定位,SSPro 4.0分析其二级结构,SWISS-MODEL预测其三级结构。
1.2.5 pET-30a(+)-AcrV表达载体的构建 将测序正确的重组质粒pMD18-T-AcrV和pET-30a(+)载体分别用EcoR Ⅴ和XhoⅠ双酶切,回收AcrV目的基因和pET-30a(+)载体,25 ℃条件下用T4 DNA 连接酶连接3 h,将连接产物转化至大肠杆菌Trans T1感受态细胞中,用含100 mg/mL卡那霉素(Kan)的LB培养基筛选阳性转化子,对阳性转化子进行菌落PCR鉴定。提取阳性重组质粒并将其转化至大肠杆菌BL21(DE3)感受态细胞中,用含100 mg/mL Kan的LB平板筛选,挑取单个菌落进行传代扩增培养后提取质粒,进行EcoR Ⅴ和XhoⅠ双酶切鉴定。将鉴定成功的阳性质粒送至吉林省库美生物科技有限公司进行测序,将测序结果与GenBank中已公布的维氏气单胞菌AcrV基因的核酸序列(GenBank登录号:CP012504.1)通过DNAstar软件进行比对,将测序正确的重组质粒命名为pET-30a(+)-AcrV。
1.2.6 重组蛋白AcrV诱导表达条件的优化 取1 mL含pET-30a(+)-AcrV的大肠杆菌BL21(DE3)菌液,接种至100 mL液体LB培养基中,37 ℃过夜培养至600 nm处吸光值(OD600)为0.6时,加入诱导剂IPTG使其终浓度分别为0.2,0.4,0.6和0.8 mmol/L,诱导4 h,6 000 r/min离心10 min,PBS洗涤菌体3次并重悬。取重悬后的菌液与5×SDS-PAGE缓冲液混匀煮沸15 min,进行SDS-PAGE检测,摸索IPTG最佳诱导浓度。将OD600为0.6的表达菌株在最佳IPTG浓度条件下分别诱导2,3,4和5 h,诱导表达产物经同样方法处理后进行SDS-PAGE检测,摸索最佳表达时间,同时设IPTG诱导的pET-30a(+)和未诱导的pET-30a(+)-AcrV为对照。
1.2.7 重组蛋白AcrV的纯化及质量浓度测定 将在最佳条件下诱导表达的重组蛋白AcrV用预冷的PBS洗涤3次并重悬,超声破碎菌体10 min后,4 ℃条件下 6 000 r/min离心10 min,取上清液过0.45 μm滤膜,收集滤液,备用。将上述滤液加至镍柱中,结合过夜,用1 mL洗脱液洗脱,收集洗脱液。将洗脱液装入透析袋中,依次置0,2,4,6 mol/L尿素透析液中进行梯度复性,每个浓度梯度透析10 h。对纯化和复性后的重组蛋白AcrV进行SDS-PAGE检测;按照BCA蛋白浓度测定试剂盒测定复性后蛋白的质量浓度。
1.2.8 多克隆抗体的制备 将复性后的重组AcrV蛋白作为抗原,免疫20只BALB/c小鼠,首免将纯化蛋白与等体积弗氏完全佐剂混匀乳化,肌肉注射,20 μg/只;间隔2周后二免,皮下接种弗氏不完全佐剂乳化的蛋白,20 μg/只;再间隔2周后三免,免疫方法同二免。三免后第5天眼眶采血,分离血清。
1.2.9 重组蛋白的Western blot分析 将SDS- PAGE电泳后的重组AcrV蛋白转移至PVDF膜上,将其于4 ℃条件下在0.05 g/mL脱脂牛奶中封闭8 h;以自制鼠抗AcrV抗体血清(用TBST 进行1∶200稀释)为一抗,4 ℃下孵育12 h,TBST洗涤3次,每次5 min;以羊抗鼠 IgG-HRP作为二抗(1∶2 000稀释)4 ℃下孵育2 h,TBST洗涤3次,每次5 min;最后采用ECL进行显色分析。
2 结果与分析
2.1 AcrV基因的克隆
对AcrV基因进行PCR 扩增,获得约1 086 bp的条带(图 1),与预期结果一致。
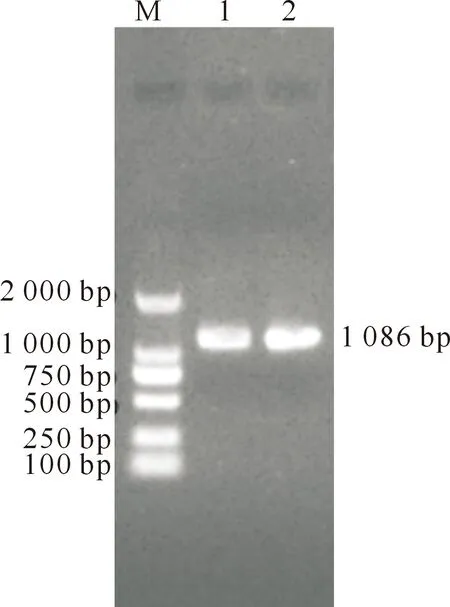
M.DL2000 DNA Marker;1,2.AcrV PCR产物 M.DL2000 DNA Maker;1,2.Products of AcrV genes by PCR
2.2 pMD18-T-AcrV重组载体的鉴定
重组载体pMD18-T-AcrV经PCR鉴定获得了1 086 bp的目的片段,经双酶切鉴定获得了1 086 bp的目的片段和2 692 bp的载体片段(图 2),均与预期结果一致。
测序结果经DNAstar软件与GenBank数据库中的AcrV序列(GenBank 登录号:CP012504.1)进行比对同源性为100%,表明AcrV已正确插入到克隆载体pMD18-T中。
2.3 AcrV基因编码蛋白的生物信息学分析
通过ProtParam预测编码产物的基本理化性质,结果表明,AcrV蛋白的氨基酸数目为361个,分子质量为40 269.85 ku,理论等电点为5.94,总共包括5 676个原子,分子式为C1 783H2 848N474O558S13; 在组成AcrV蛋白的22种氨基酸中,亮氨酸(Leu)所占比例最高,达到9.7%;AcrV蛋白的不稳定指数为25.29,脂肪指数为82.22,为稳定蛋白。应用ProtScale进行疏水性分析,结果表明AcrV蛋白为一个典型的疏水性蛋白。使用SingalP v3.0进行信号肽分析,结果表明,S平均值(meanS-score)为0.131,小于0.5,故不存在信号肽,整个编码序列可完全用于原核表达;利用TMHMM v2.0进行跨膜区分析,发现 AcrV蛋白无跨膜区,且所有氨基酸均位于细胞膜表面。应用COILS Server进行Coil分析,结果表明,AcrV蛋白含有多个典型的卷曲螺旋(coiled coil)结构。通过SMART进行结构域分析,结果显示,AcrV蛋白有较多高度保守的结构域,与LcrV家族成员共有的典型结构域相类似。采用TargrtP 1.1进行亚细胞定位分析,结果显示,AcrV蛋白在细胞内的定位临界值为0,定位于叶绿体的可能性为11.6%,线粒体的可能性为5.8%,分泌到细胞周质的可能性为6.7%,其他位置的可能性为87.2%,预测其定位在其他细胞器,可靠性级别为2级。应用SSPro 4.0分析二级结构,结果表明AcrV属于全α型蛋白,其α-螺旋(H)占53.33%,大于45%;β-折叠(E)占2.92%,小于5%。经SWISS-MODEL以同源建模的方法预测AcrV蛋白三级结构,结果表明,AcrV蛋白的三级结构组分是基于毒力相关LcrV蛋白结构1r6f.1的A链为模板所构建,AcrV与LcrV序列的一致性达到44.21%。
2.4 pET-30a(+)-AcrV表达载体的鉴定
重组表达载体pET-30a(+)-AcrV经PCR鉴定获得了1 086 bp的目的片段,经双酶切鉴定获得了1 086 bp的目的片段和5 422 bp的载体片段(图 3),均与预期结果相符。测序结果经DNAstar软件比对,与AcrV序列(GenBank 登录号:CP012504.1)进行比对相似性为100%,表明pET-30a(+)-AcrV表达载体构建成功。
2.5 重组蛋白AcrV诱导条件的优化
对以不同浓度IPTG诱导的蛋白进行SDS-PAGE分析,结果均在45 ku处出现条带,与预期分子质量大小一致;在IPTG终浓度为0.2,0.4 和0.6 mmol/L时重组蛋白AcrV的表达量基本一致,在IPTG浓度为0.8 mmol/L时重组蛋白AcrV表达量最大(图4),因此确定在本试验条件下IPTG的最佳诱导浓度为0.8 mmol/L。
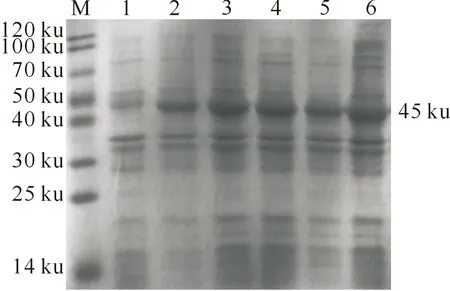
M.预染蛋白Marker;1.pET-30a(+)诱导表达产物;2.未诱导pET-30a(+)-AcrV表达产物;3~6.分别为pET-30a(+)-AcrV经0.2,0.4,0.6,0.8 mmol/L IPTG诱导表达的产物
对不同诱导时间的重组蛋白AcrV进行SDS-PAGE分析,结果均在45 ku处出现条带;诱导5 h时蛋白表达量最大(图5),因此确定在本试验条件下的最佳诱导表达时间为5 h。
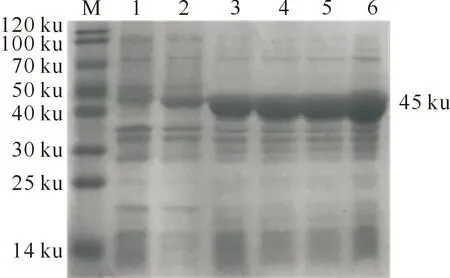
M.预染蛋白Marker;1.pET-30a(+)诱导表达产物;2.未诱导pET-30a(+)-AcrV表达产物;3~6.分别为0.8 mmol/L IPTG诱导2,3,4,5 h的表达产物
2.6 重组蛋白AcrV的纯化与复性
对纯化和复性后的重组蛋白AcrV进行SDS-PAGE分析,结果在45 ku出现了蛋白条带(图6),与预期结果一致。结果表明,AcrV重组融合蛋白主要以包涵体的形式存在,包涵体经洗涤,镍柱纯化,梯度透析复性,可以获得较纯的AcrV蛋白,经测定,复性后蛋白的质量浓度为100 μg/mL。
2.7 重组蛋白AcrV的Western blot鉴定
Western blot表明,在大肠杆菌BL21(DE3)中诱导表达的重组AcrV蛋白在45 ku处出现了与抗体特异性结合的条带(图7),表明AcrV重组蛋白表达正确,与维氏气单胞菌TH0426菌株阳性血清有较好的免疫反应性。

1.纯化的蛋白;2.复性的蛋白;M.预染蛋白Maker;1.Purified recombinant protein;2.Renatured recombinant protein; M.Blue Plus Protein Marker;图6 纯化和复性后重组蛋白AcrV的SDS-PAGE检测 Fig.6 SDS-PAGE of purified and denatured recombinant AcrV protein
M.预染蛋白Marker;1.纯化蛋白;2.pET-30a(+)阴性对照
M.Blue Plus Protein Marker;1.Purified protein;2.Negative control of pET-30a(+)
图7 重组维氏气单胞菌AcrV蛋白的Western blot检测
Fig.7 Western blot of mouse polyclonal antibody against AcrV protein fromAeromonasveronii
3 讨 论
在水产养殖中,应用疫苗来防治水产动物疾病,不仅可以有效减轻不规范使用抗生药物所带来的严重危害,而且可以大大降低水产病害给水产养殖者带来的巨大经济损失[16]。目前,针对嗜水气单胞菌(Aeromonashydrophila)已经研制出较多有效疫苗,如针对LPS、OMPs及胞外产物(ECPs)等的疫苗[17-19],这些疫苗对嗜水气单胞菌引起的疾病有一定的防治效果[20],而针对维氏气单胞菌的水产疫苗仍较少。近年来,本实验室已筛选了部分可能具有良好免疫原性的维氏气单胞菌抗原用于研制重组乳酸菌口服疫苗,期望为水产疾病的治疗提供更简捷、高效、无污染的方式。Zhang等[10]已通过重组乳酸菌口服免疫鲤抵抗维氏气单胞菌的侵袭,结果表明,重组蛋白具有良好的免疫效果。有研究报道,AcrV基因存在于嗜水气单胞菌[21]和杀鲑气单胞菌[22](Aeromonassalraonicida)Ⅲ型分泌系统中,笔者推测AcrV基因可能也存在于维氏气单胞菌中,并发挥着重要作用。因此,本试验克隆了维氏气单胞菌TH0426菌株AcrV基因,构建原核表达载体pET-30(+)-AcrV,将其转化至大肠杆菌,对IPTG诱导表达条件进行优化,结果表明,本试验条件下IPTG最佳诱导浓度为0.8 mmol/L,最佳诱导时间为5 h。曹晓梅等[23]在乳酸乳球菌中成功表达了重组LcrV蛋白,且证明其表达量随诱导时间的延长而增加,这与本试验结果相似。而后,本试验通过Western blot对重组AcrV蛋白的免疫原性进行检测,结果表明,重组AcrV蛋白能正确表达,且能与抗体特异性结合,证明其与维氏气单胞菌TH0426菌株阳性血清有较好的免疫反应性。Sarah等[24]研究表明,在杀鲑气单胞菌Ⅲ型分泌系统中AcrV参与基因易位,且能够抑制鱼类细胞的毒性,进而证明AcrV蛋白具有一定的免疫原性,这与本试验结论相符。
经生物信息学分析得出,本试验诱导的AcrV蛋白氨基酸数目为361个,分子质量为40 269.85 ku。在组成AcrV蛋白的22种氨基酸中,亮氨酸(Leu)所占比例最高,达到9.7%;AcrV蛋白的理论等电点为5.94,不稳定指数为25.29,脂肪指数为82.22,表明AcrV为相对稳定蛋白,有利于AcrV蛋白的稳定表达。同时,本研究预测AcrV蛋白为典型的疏水性蛋白,猜测该蛋白可能是Ⅲ型分泌系统分泌的效应蛋白,但不具有分泌信号,执行着重要而独特的细胞生物学功能。AcrV蛋白有较多高度保守的结构域,与LcrV家族成员共有的典型结构域相类似,推测AcrV基因可能与LcrV基因具有相似功能。王忠泽等[25]研究表明,LcrV蛋白具有双重功能,是一种毒力蛋白且具有调节生长和低钙反应毒力基因表达的作用,同时具有良好的免疫调节功能。另有报道称,杀鲑气单胞菌Ⅲ型分泌系统中的AcrV蛋白与鼠疫耶尔森氏菌中的LcrV蛋白具有多处相似性片段,且表现出高度的保守性,这些相似性片段在五聚体复合物的外部暴露[21],保守区域可以在AcrV蛋白中发挥与LcrV蛋白相同的免疫调节作用。由此可以推测,AcrV蛋白也是一种毒力蛋白,并发挥一定的调节生长和免疫的功能。此外,本研究也对AcrV蛋白的二级和三级结构进行了预测,表明AcrV蛋白属于全α型蛋白,其结构相对稳定,不易变形,适合重组蛋白的表达。
当前,人们逐渐认识到水产品质量安全以及水体环境污染等问题的重要性,细菌的流行与暴发也同样困扰着水产养殖人员。因此,研究细菌的毒力基因是揭示细菌致病机制的重要手段,也为开发新型疫苗并解决水产相关问题提供了新方向。虽然本试验证实了AcrV重组蛋白具有一定的保护效应,但目前对AcrV基因功能尚无透彻的研究,其是否可以作为基因工程疫苗的一种候选抗原仍需进一步探究,本试验结果为深入研究AcrV基因的功能、免疫调节作用机制以及基因工程亚单位疫苗等奠定了基础。

