AM真菌结构及鉴定方法的研究进展
杨帆 曹涵铭 陈园园 王金龙
摘要 丛枝菌根(AM)真菌是在自然界中广泛分布于土壤的有益微生物。AM真菌鉴定是菌根研究的基础,其对保护菌种多样性,促进AM真菌在农业生产上应用具有重要意义。本文总结了AM真菌的结构特征、国内外在其形态学和分子生物學的鉴定方法,旨在为AM真菌的多样性调查和更加精准地开展AM真菌鉴定工作提供参考。
关键词 丛枝菌根(AM)真菌;多样性;结构;鉴定方法
中图分类号 S154.3 文献标识码 A
文章编号 1007-5739(2019)16-0152-03 开放科学(资源服务)标识码(OSID)
Abstract Arbuscular mycorrhizal(AM) fungi are beneficial microorganisms that widely distribut in the soil in nature. Identification of AM fungi is the basis of mycorrhiza research,and it is of great significance to protect the diversity of strains and promote the application of AM fungi in agricultural production. This paper summarized the structural characteristics of AM fungi,and its morphological and molecular biology methods at home and abroad,in order to provide reference investigation for the diversity of AM fungi and more accurate identification of AM fungi.
Key words arbusular mycorrhizal fungi;diversity;structure;identification method
我国自然资源丰富,植物种类多样。丛枝菌根(AM)真菌能与包括被子植物、裸子植物、苔藓、地衣[1]以及已发现的90%的维管束植物形成共生体,并影响其生长发育。因此,AM真菌是一种宝贵的微生物资源,AM真菌的菌丝体在细胞内的形态是泡囊状和丛枝状,所以AM真菌又被称为泡囊-丛枝菌根,即VA菌根[2]。
丛枝菌根真菌是一种普遍存在于自然生态系统与农田生态系统中的真菌,能与大多数陆生植物根系形成互惠共生体系的微生物。AM真菌具有专性活体营养的特性,目前还不能进行分离提纯培养,其寄生对宿主没有特异性选择[3],只进行无性繁殖。
1 AM真菌的功能及结构
1.1 AM真菌的功能
菌根是土壤中的菌根真菌与寄主植物营养根系相结合形成的互惠共生体,和菌根共同形成的真菌称为菌根真菌。这种共生现象是寄主植物将自身光合同化的有机物或碳水化合物供给自身生长发育的同时还提供给菌根真菌生长;此外,菌根真菌的菌丝体交叉生长形成网络结构,大面积地接触寄主植物根系周围的土壤,有助于吸收土壤中更多的养分,增强了寄主植物根系对矿质营养和水分的吸收[4]。AM真菌的功能主要受以下3个因素的影响,分别为菌丝在土壤中的密度、活性及其分布状态[5]。
除了十字花科、蓼科、莎草科、苋科、石竹科等10余科植物外[6],丛枝菌根真菌几乎能和所有的绿肥作物、果树、蔬菜、经济作物形成互惠共生体[2]。研究初期关于陆地生态环境的特征表明,水生低等植物向陆生高等植物进化的过程,AM真菌的作用是必不可少的;在恶劣的生态环境中,菌根植物则是发展的重点,非菌根植物的存活率极低[6]。
AM真菌功能具有多样性,主要体现在以下8个方面:①植物根系土壤周围有很多不能被植物吸收的矿质元素,植物不能得到足够的营养,而AM真菌可以有效获取并利用土壤中移动性差的元素,帮助植物有效吸收利用;②土壤中的微生物存在很多传染性病原,单一的植株很难抵抗这些病原物,而AM真菌能有效抵抗病原微生物的传播,因而接种了AM真菌的植株抵抗土壤中传染性病原微生物的能力有所提高;③提高植物对非生物胁迫的抗性,如干旱、盐渍、重金属毒害等;④与根际微生物协同促进植物固氮、或加速土壤中氮磷化合物或有机污染物的形态转化;⑤AM真菌能提升生态系统净生产力的主要原因是自身合成球囊霉或相关蛋白;⑥AM真菌通过菌丝直接缠绕土壤以及菌丝分泌的其他物质对土壤的黏结,促进土壤水稳性团聚体的形成,参与了土壤演变过程;⑦作物群落的生物多样性、群落的稳定性的相关变化,归结于AM真菌与植物群落相互作用的程度,是否直接与群落产生作用;⑧不同群落的植物被地下的菌丝网络侵染,将会形成一个庞大的菌落,不再出现单一植株,同时通过菌丝网络传递植物间所需的营养成分[7]。因此,AM真菌可以作为植物的生物肥料、生物防护剂、生物农药、生物促进剂等[8-10],其在农田生态系统中的应用性很强并且有广阔的前景。
1.2 AM真菌的结构及作用
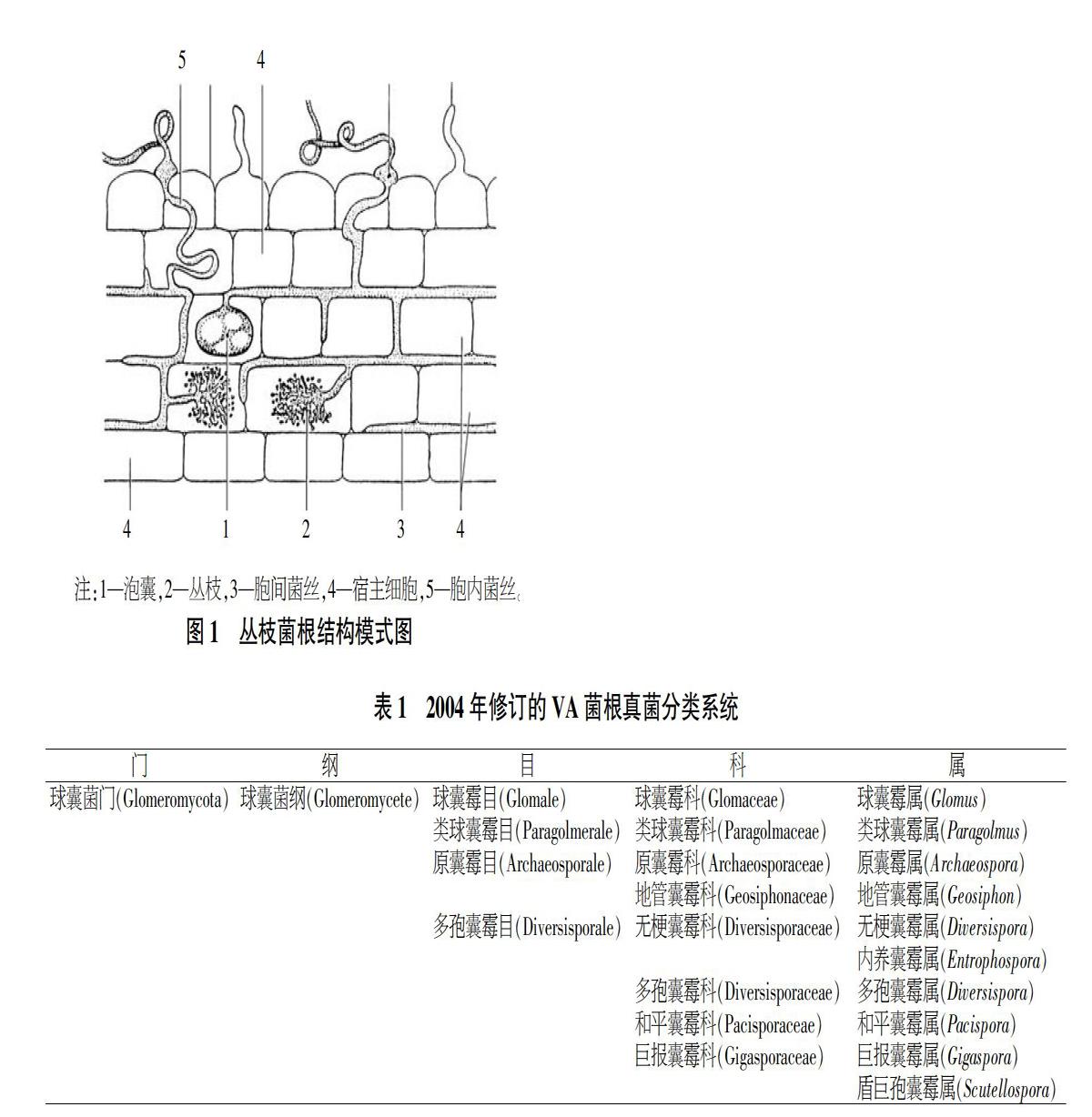
根据菌根菌丝与寄主植物根细胞的关系,科学家将其分为外生菌根、内生菌根和内外兼生菌根。外生菌根是指菌根菌丝只会侵入到幼嫩寄主植物根细胞的皮层,不会进入细胞侵染,在细胞的间隙形成一种哈蒂氏网,根外形成菌套;内生菌根是菌根菌丝会透过寄主植物根的细胞壁,进入到表皮或根部皮层细胞进行侵染,长在细胞间隙的菌丝[11]形成丛枝状的分枝,丛枝菌根是内生菌根中没有隔膜的一类[3];内外兼生菌丝则兼顾了内生菌根和外生菌根的形态特征以及生理特性。由图1可知,丛枝菌根包括泡囊、丛枝、胞间菌丝等结构[12]。
1.2.1 根外菌丝。菌根真菌的根外菌丝是分布在土壤基质中的真菌菌丝体,其菌丝体在寄主植物根外分枝伸展,发达时可在植株根际周边形成松散的菌丝网络系统。根据菌丝形态结构可分为2类,一类是厚壁菌丝,细胞壁厚且菌丝不分隔,多核,直径20~30 μm;另一类是薄壁菌丝,起源于厚壁菌丝的棱角状突起,直径2~7 μm,能穿透土壤中有机物颗粒吸收营养物质和水分[6]。
1.2.2 根内菌丝。根部细胞内部的菌丝称为根内菌丝,可分为胞内菌丝和胞间菌丝。胞内菌丝就是指菌丝从一个细胞直接进入另一个细胞体内沿着根系纵向生长的一类菌丝体。胞间菌丝指生长在细胞间隙的菌丝,在丛枝菌根真菌侵染植物根系时可以经常看到[3]。
1.2.3 侵入点。侵入点是丛枝菌根真菌菌丝穿透并侵入根内的位点。当菌丝与根表皮接触时,根表皮就会形成一个类似附着胞的结构,是菌丝进入根系内的通道。一般来说,每毫米根系侵入点的数量是1~25个,其数量主要取决于植物种类、真菌种类及土壤特性的差异。因此,单位根系长度侵入点的数量可作为评价丛枝菌根真菌侵染程度大小的指标之一[3]。
1.2.4 丛枝。丛枝是菌根菌丝侵入寄主植物根细胞后,连续快速分枝形成的一种枝状结构。一般来说,丛枝出现在菌根侵染初期阶段,维持2~3周后重新消亡或分枝。含有丛枝的细胞内有大量小液泡,其中有许多0.1~0.2 μm的聚磷酸盐。丛枝是养分吸收和交换的重要场所[13],丛枝的丰富度与产生速率,被作为体现菌根共生体中功能菌根的数量及真菌的代谢和功能潜力的标志[14]。
1.2.5 泡囊。泡囊多为圆形、椭圆形或方形囊状结构,由宿主皮层细胞或细胞内菌丝末端或中部膨大而成。不同的丛枝菌根真菌具有不同的泡囊形态。Glomus真菌的泡囊一般是椭圆形且无梗的,而Acaulospora、Entrophospora和Kuklo-spora真菌的泡囊与之不同,后者表面常有凹陷[15]。并非所有AM真菌都产生大量泡囊,Archaeospora、Intraspora、Paraglo-mus和Scutellospora极少形成泡囊。所以泡囊是AM真菌形态学鉴定指标之一。泡囊的功能一是贮藏养分,其内贮藏大量油状内含物,是贮藏器官;二是随受损组织进入土中起繁殖体的作用[6,11]。
1.2.6 孢子和孢子果。孢子和孢子果是丛枝菌根真菌繁殖的重要器官,着生在根外菌丝上,分布于土壤中,一般为圆形或椭圆形,内含储藏性脂肪和碳水化合物[13]。孢子和孢子果的大小、形状、颜色以及胞壁的结构是菌根分类学的重要依据之一。
2 AM真菌的分类
1885年德国植物生理学家森林学家Frank首次提出“菌根”。AM真菌的多样性主要表现在分子水平、形态学水平和生态学水平上[5]。国际丛枝菌根保藏中心做了大量工作,并对Morton和Benny的分类系统进行修正[16]。欧洲菌藏中心(BEG)已登记保藏了10科多属种菌株,并保藏了部分菌种的基因序列,为AM真菌的形态学鉴定提供了重要的检索对照依据[17]。目前,共有1个纲,4个目,8个科,10个属(表1)[18]。
据估计,AM真菌已经在世界存在逾4.6亿年,Schü?覻ler等[19-20]对AM真菌的18S rDNA基因进行分析后,结果显示,AM真菌与接合菌门、担子菌门以及子囊菌门有共同的起源[21],所以科学家将AM真菌归属为球囊菌门(Glomer-omycota),AM真菌属于球囊菌门、球囊菌纲,目前已分离鉴定了200余种[22]。
3 AM真菌的鉴定方法
3.1 形态学鉴定方法
AM真菌形态学的鉴定主要观察以下3个特征:孢子、孢子果以及孢子壁的各个形态,但孢子及孢子果主要依附于被侵染物根系周围的土壤中。
特定种类的染色剂如Melzer试剂、棉蓝试剂可与部分AM真菌孢子壁层发生特异性反应,真菌种类不同反应特征也不同,因而這种通过观察反应差异的形态学鉴定方法可作为AM真菌鉴定的辅助方法。通过湿筛倾析法从土壤中筛选出一些孢子,观察(体式显微镜)其生长发育基本特征、孢子聚集方式、孢子果内的排列方式,然后通过Olympus显微镜观察测定孢子的形态结构特征进行分类鉴定[23]。
3.2 分子生物学鉴定方法
AM真菌的分子生物学鉴定主要根据不同类的核糖体DNA排列顺序不同,得到特异引物来对AM真菌做到基因水平的精确分类。DNA提取一般采用CTAB法。由于PCR技术特异性强、灵敏度高、操作简单、速度快,可以较全面地建立AM真菌的DNA克隆文库。
rDNA具有高度保守性,根据这一特性可设计完成具有种间高度特异性的PCR引物[3]。高等级水平生物群体间的系统分析可利用18S、5.8S和28S rDNA基因组成的一个转录单元[24],该转录单元间隔区为内转录间隔区(ITS)。ITS的特点为在AM真菌种间表现多种变异,而在同种不同株间表现高度保守性,这一特性可为AM真菌的分类鉴定提供丰富的遗传信息[25]。18S rRNA基因克隆文库构建是目前研究AM真菌多样性较为理想的方法,该基因克隆库的构建可以准确地揭示土壤环境、植物根系的AM真菌多样性。目前常用检测AM真菌多样性的方法如下。
3.2.1 聚合酶链式反应(PCR)。聚合酶链式反应(PCR)是PCR技术依赖DNA聚合酶的酶促反应,在模板DNA、引物和4种脱氧核糖核苷酸存在的条件下进行,其特异性由根据rDNA设计的引物和模板DNA的特异性结合决定,因为rDNA在同源物种的进化上是高度保守的,而间隔区序列存在种间差异[3]。可从AM真菌孢子中提取DNA,用PCR扩增,根据DNA模板和引物结合的特异性,通过电泳扩增分离片段,比较不同AM真菌扩增产物的差异[26]。
3.2.2 随机扩增多态性(RAPD)。随机扩增多态性(RAPD)是利用一种随机合成的随机排列的单寡核苷酸引物,通过PCR反应扩增靶细胞DNA。不同菌株间的基因组可能存在重组、插入或缺失导致的基因序列的改变,扩增的产物通过电泳分析获得电泳图谱,进而分析DNA片段数量和长度的多态性。RAPD使用的是随机引物,不用提前知道目的基因及其相应的序列,但这可能导致生物个体某一特殊DNA片段得不到有效扩增[27];RAPD操作简便,试验周期短,能在较短时间内筛选大量样品;RAPD标记可以覆盖包括编码区和非编码区整个基因组,反映整个基因组的变化[3],是一项很有价值的分子标记技术。
3.2.3 变性梯度凝胶电泳(DGGE)。变性梯度凝胶电泳(DGGE)是对16S rDNA基因上不同序列的DNA解旋所需的不同变性剂的温度和浓度,可分离某一个不同碱基的双链DNA片段的分子电泳技术[28]。分子生物学鉴定中,能快速分离鉴定大量样品,既可以分析不同微生物群落的差异,也可以研究同一个微生物群落随时间和外部环境压力的变化过程[29],但是DGGE图谱只显示群落丰富度,不能确定具体AM真菌菌种。
3.2.4 限制性片段长度多态性(RFLP)。限制性片段长度多态性(RFLP)是一种利用放射性同位素标记或非放射性同位素标记的探针与转移在固相膜上的基因组DNA进行杂交,得到不同多态性的限制性消化片段以用来分析DNA[30]。根据被AM真菌侵染的寄主根系的ITS序列和18S rRNA基因片段设计特定引物,PCR和RFLP可用于鉴定AM真菌[30]。可分析编码特定基因的基因区域,也可用来鉴定种群内和种群间各个体的差异[31]。RFLP建立在PCR基础上,所以不用分离培养,而且该法可检测到环境中所有的菌,包括活菌(可培养的和不可培养的)和未降解的死菌[32]。在研究夏季洪水对AM真菌数量的影响时,用ITS-RFLP技术分析AM真菌孢子的基因组特征[33]。相关学者[34]用ITS-PCR/RFLP技术分析了AM真菌结构的多样性。RFLP是一种对DNA序列分析的简化,可进行亲缘关系较近的鉴定。
3.2.5 磷酸脂肪酸(AFLP)测定技术。磷酸脂肪酸(AFLP)测定技术是一项基于PCR和RFLP相结合的技术,这项技术根据磷脂脂肪酸分子的结构不同,选择扩增基因组DNA限制性酶切片段,可进行特异性分子标记。RFLA对内切酶要求高,用量少,没有复等位基因,灵敏度高,但操作要求严格,扩散时多发假阳性、凝胶背景杂乱等诸多问题,使该技术在一定程度上存在局限性[17]。
3.2.6 高通量测序技术。高通量测序技术是利用芯片进行测序,可以在数百万个点上同时阅读测序。此外,因为样品中某种DNA被测序的次数反映了样品中该DNA的丰富度,所以有精确的定量功能[35]。高通量测序技术能更准确地揭示微生物群落、多样性及生物地理学的变化[36],极大地降低了测序成本,同时也实现了大规模土壤微生物的直接测序[37]。
3.3 2种方法的优缺点
形态学鉴定有不一致性、局限性和偶然性[5],基本只能鉴定到种,更多的取决于鉴定者经验,容易丢失不产生孢子的种类。这需要鉴定者对已发现真菌以及新纪录种的形态特征有足够的了解[17]。同时,有些孢子形态又极其相似,很难客观全面地对AM真菌做出评价,低估了 AM真菌物种多样性,又因为AM真菌孢子易受环境影响,在特定季节或环境下,某些产生孢子多的AM真菌可能会被认为是优势种,但当环境发生变化时他们可能会停止产生孢子[36]。
虽然分子生物学可以克服这一局限,但也存在自身局限性。分子生物学方法鉴定在DNA提取时,易受微生物区系、真菌结构以及生育期的影响,导致检测结果不准确,而且检测样本来源于田间,非无菌培养,真菌DNA在扩增过程中易被污染[38]。目前,分子生物学方法鉴定更有科学性,但仍需不断完善。
4 參考文献
[1] 盖京萍,蒋家慧,刘培利.AM真菌资源及生态学研究进展[J].莱阳农学院学报,1998,15(2):135-140.
[2] 张萍萍.丛枝菌根真菌对不同共生效率的玉米自交系促生效果的调查[D].泰安:山东农业大学,2014.
[3] 董秀丽.丛枝菌根真菌的分离鉴定和生物学特性研究及分子探针的设计与应用[D].武汉:华中农业大学,2005.
[4] HARLEY J L,SMITH S E.Mycorrhizal symbiosis[M].London:Acadamic Press,1983.
[5] 盖京萍,冯固,李晓林.丛枝菌根真菌的生物多样性研究进展[J].土壤,2005(3):236-242.
[6] 李晓林,冯固.丛枝菌根生理生态[M].北京:华文出版社,2001.
[7] 冯固,张福锁,李晓林,等.丛枝菌根真菌在农业生产中的作用与调控[J].土壤学报,2010,47(5):995-1004.
[8] 吴胜强,夏仁学,张琼华.果树上的一种新型生物肥:丛枝菌根[J].北方园艺,2003,27(6):27-28.
[9] 刘润进,李敏.AM型生物肥料田间应用试验[J].莱阳农学院学报,2001,18(2):81-84.
[10] 刘润进,王洪娴,王森众,等.菌根生物技术在城郊生态农业上的应用[J].山东科学,2006(6):98-101.
[11] 刘润进,李晓林.丛枝菌根及其应用[M].北京:科学出版社,2000.
[12] 秦海滨.丛枝菌根真菌对温室黄瓜生长及抗病性的影响研究[D].北京:中国农业科学院,2008.
[13] 弓明钦,陈应龙,仲崇禄.菌根研究及其应用[M].北京:中国林业出版社,1997.
[14] DEKKERS T B M,WERFF P A V D.Mutualistic functioning of indigenous arbuscular mycorrhizae in spring barley and winter wheat after cessation of long-term phosphate fertilization[J].Mycorrhiza,2001,10(4):195-201.
[15] MORTON J B,REDECKER D.Two new families of Glomales,Archae-osporaceae and Paraglomaceae,with two new genera Archaeospora and Paraglomus,based on concordant molecular and morphological chara-cters[J].Mycologia,2001,93(1):181.
[16] MORTON J B,BENNY G L.Revised classification of arbuscular mycor-rhizal(Zygomycetes):A new order,glomales,two new sub-orders glomi-neae,gigasporineae,and two new families,Acaulosporaceae and Gigas-poraceae,with an emendation of glomaceae[J].Mycotaxon,1990,37:471-491.
[17] 杨春雪,李丽丽.丛枝菌根真菌鉴定方法的研究进展[J].贵州农业科学,2014,42(7):93-94.
[18] 盛敏.VA菌根真菌提高于秘密抗盐性机制与农田土壤微生物多样性研究[D].杨凌:西北农林科技大学,2008.
[19] SCH?譈?覻LER A,SCHWARZOTT D,WALKER C.A new fungal phylum,the Glomeromycota:Phylogeny and evolution[J].Mycological Research,2001,105:1413-1421.
[20] SCH?譈?覻LER A.Molecular phylogeny,taxonomy,and evolution of Geosi-phon phyriformis and arbuscular mycorrhizal fungi[J].Plant Soil,2002, 244:75-83.
[21] 王發园,林先贵,周建民.丛枝菌根真菌分类最新进展[J].微生物学杂志,2005,25(3):41-45.
[22] 马媛,吕杰,刘晓颖.AM真菌多样性及生物学功能研究进展[J].北方园艺,2014(14):203-206.
[23] 屈雁朋.AM真菌的筛选、鉴定和接种效应[D].杨凌:西北农林科技大学,2009.
[24] 孙广宇,彭友良,李振歧,等.核苷酸序列分析在真菌系统学研究中的应用[J].西北农林科技大学学报(自然科学版),2003,31(6):1887-1892.
[25] 陈剑山,郑服丛.ITS序列分析在真菌分类鉴定中的应用[J].安徽农业科学,2007,35(13):3785-3786.
[26] WYSS BONFANTE P.Amplification of genomic DNA of arbuscular-mycorrhizal(AM) fungi by PCR using short arbitrary primers[J].Mycol Res,1993,97:1351-1357.
[27] 张传博,苏晓庆.几种基于基因组DNA的真菌分类技术研究进展[J].贵州师范大学学报(自然科学版),2006,24(1):116.
[28] 王发园,朱正杰,张显伦,等.分子标记技术在丛枝菌根真菌研究中的应用现状[J].莱阳农学院学报,2002,19(2):120.
[29] MUYZER G.DGGE/TGGE a method for identifying genes from natural ecosystems.[J].Current Opinion in Microbiology,1999,2(3):317-322.
[30] REDECKER D,MORTON J B,BRUNS T D.Molecular phylogeny of the arbuscular mycorrhizal fungi Glomus sinuosum and Sclerocystis corem-ioides[J].Mycologia,2000,92(2):282-285.
[31] 王发园,刘润进.AM真菌分类学最新研究进展[J].菌物系统,2001,20(4):588-593.
[32] 贾俊涛,宋林生,李筠.T-RFLP技术及其在微生物群落结构研究中的应用[J].海洋科学,2004(3):64-68.
[33] ZHAO D,ZHAO Z.Biodiversity of arbuscular mycorrhizal fungi in the hot-dry valley of the Jinsha River,southwest China[J].Applied Soil Ecology,2007,37(1):118-128.
[34] SHARMAH D,JHA D K.Diversity of arbuscular mycorrhizal fungi in disturbed and undisturbed forests of Karbi Anglong Hills of Assam,India[J].Agricultural Research,2014,3(3):229-238.
[35] 王兴春,杨致荣,王敏,等.高通量测序技术及其应用[J].中国生物工程杂志,2012,32(1):110-111.
[36] 李玮.施肥对华北平原典型大田玉米菌根真菌群落特征及影响因子分析[D].北京:中国农业大学,2014.
[37] GOMEZ-ALVAREZ V,TEAL T K,SCHMIDT T M.Systematic artifacts in metagenomes form complex microbial communities[J].The ISME journal,2009,3(11):1311-1317.
[38] CLAPP I P,RODRIGUEZ A,DODD J C.Glomales rRNA gene diversity-all that glistens is not necessarily glomalean[J].Mycorrhizal,2002,12:269-270.

