底泥中三氯生残留对轮叶黑藻的生态毒性效应
张立娜,王芷茵,安 婧
(1.中国科学院沈阳应用生态研究所污染生态与环境工程重点实验室,沈阳 110016;2.中国科学院大学,北京 100049;3.东北大学资源与土木工程学院,沈阳 110016)
三氯生(2,4,4'-三氯-2'-羟基二苯醚,triclosan,TCS)是一种使用广泛的广谱杀菌剂。由于高效的杀菌性、不刺激皮肤、不会引起过敏及与日用化工原料有良好的配伍等特性,被广泛用于牙膏、香皂、除臭剂、漱口水等家庭日常用品及个人卫生用品中[1]。工业的发展及个人护理用品的广泛使用,使TCS的消耗量逐年上升,近30年来排放到环境中的TCS也不断增加。据统计,全球TCS年消耗量在7.5×105t以上[2]。随着人们对TCS等环境新型污染物的日益关注以及化学分析检测技术的飞速发展,TCS在世界多地的环境样品中被检出。近年来,我国多地的水体样品中也检出了TCS残留,且检出率和检出浓度显著高于其他国家。Sun等[3]在中国九龙江水中检测到TCS的残留浓度为 96.5 ng·L-1;Oliveira等[4]研究表明日本地表水中TCS残留浓度约为11 ng·L-1。由于TCS具有较好的稳定性和低挥发性,其辛醇比为4.8,因此,TCS在水体沉积物中吸附系数也较大,导致进入水体中的TCS可以进入到水体沉积物中并持续存在。Zhang等[5]发现,长江水体中TCS含量高达1.89 ng·L-1,底泥中含量达1.2 ng·g-1;Zhao等[6]发现,辽河、海河、黄河、珠江和东江等水体中TCS的质量浓度分别为1.39~2.6、0.156~39.1、0.43~3.72、1.89~5.2、11.7 ng·L-1,而底泥中质量浓度分别为 0.41~0.6、3、0.05~2.05、1.2~5.78、0.002~14.8 ng·g-1。而对于污染段来说,水体中TCS的质量浓度高达478 ng·L-1,底泥中质量浓度高达2723 ng·g-1。由于TCS具有类持久性、生物富集性、热稳定和难挥发性等特点,其类持久性主要表现在能持久存在于环境中,具有很长的半衰期,导致其可以在水体和底泥中持久存在。而底泥中TCS残留很容易被人类所忽视,其对水体动植物具有不容忽视的潜在生态风险。
底泥与水环境之间存在动态平衡,底泥在吸附的同时也会向水环境释放TCS,从而对水生动植物产生生态毒性效应。韩琦等[7]研究表明河流对来自陆上的有机污染物主要通过固相吸附及沉降作用而在底泥中富集,并且底泥污染物会在一定水力条件和底栖生物的扰动作用下,通过水-底泥的交换反应在液相和固相间迁移。在TCS水体暴露实验中,董玉瑛等[8]发现东北林蛙幼体蝌蚪暴露于TCS 1 h,15℃时LD50(半数致死量)为712.32µg·L-1;Hwang等[9]发现TCS对海胆胚胎的影响也很显著,可以导致胚胎发育异常,使囊胚细胞分化缓慢。水生植物的研究主要集中在TCS对微藻类的急性毒性效应。陈东等[10]研究发现在毫克每升水平上TCS对淡水绿藻有明显的毒性,可显著抑制其生长、降低叶绿素含量以及抗氧化酶活性;李义刚等[11]研究发现TCS对羊角月牙藻的半数效应浓度(96 h-EC50)为0.112 mg·L-1。然而,目前水环境中TCS对大型藻类的毒性效应,尤其是TCS低浓度长期暴露的毒性效应研究相对匮乏。此外,针对残留于底泥中的TCS对水生生物的生态毒性效应研究并不多见。
轮叶黑藻(Hydrilla verticillata)作为一种典型的沉水植物,在我国水环境中分布广泛。轮叶黑藻能净化水质并且吸收富集污染物质,且其整株浸于水中,根部插入底泥中,因而对水体污染物胁迫的响应较为敏感。李国新等[12]研究发现,轮叶黑藻叶片吸附Pb后,细胞内外离子的快速交换过程使细胞干瘪,发生明显的变形,细胞内膜系统的完整性遭到破坏;韩晓弟等[13]研究发现,在Pb2+胁迫下,轮叶黑藻叶片呈现不同程度的枯黄萎蔫现象,其程度随处理浓度的增加而加重。目前关于TCS胁迫轮叶黑藻产生的毒性效应研究很少。基于此,本实验以轮叶黑藻作为受试植物,研究了底泥环境低浓度TCS长期暴露下,轮叶黑藻对TCS的吸收以及其体内叶绿素、可溶性蛋白以及抗氧化酶系统对TCS胁迫的响应,以期为新型污染物的生态风险评估提供毒理学基础数据和理论依据。
1 材料与方法
1.1 实验仪器和供试材料
仪器:冷冻高速离心机(Centrifuge 5804 R),纯水仪(DW 100);超声波清洗器(KQ-500 DE),氮吹仪(DCY-24 Y),固相萃取装置(SPE-12 A),烘箱(101-2 ABS),分析天平(JA 2003),紫外可见分光光度计(VARIAN Cary 50),液相色谱-质谱联用仪(Maters 2695.ZQ 4000)。
供试材料:供试植物为轮叶黑藻,属水鳖科,单子叶多年生沉水植物。轮叶黑藻芽孢购自辽宁省安新县冀中水生植物种植公司,于实验室培养两周,选取10 cm左右长度的轮叶黑藻进行实验。实验用水为去离子水。营养液配制按照Hoagland′s培养液,轮叶黑藻采用10%Hoagland′s培养液。河流底泥采自辽宁省抚顺市大伙房水库(41.842°N,124.154°E),大伙房水库为饮用水源地保护区,底泥中未检测到TCS,含水率为33%。TCS购自阿拉丁生化科技股份有限公司(上海),纯度≥96%,所用其他试剂均为分析纯。将TCS溶于二甲基亚砜(DMSO)(DMSO=1 mL),配制母液(5 g·L-1)。
1.2 实验设计
采用水培实验,模拟河流环境,在无色玻璃水缸(长35 cm×宽20 cm×高25 cm)底部铺设一层4 cm厚的底泥,每缸中放8 L用去离子水配制的10%Hoagland′s培养液。水缸上面放置常规架灯提供光照,同时进行曝氧,实验装置如图1所示。选用株高10 cm左右,鲜质量约0.8 g的轮叶黑藻进行实验。每个缸中定植20株,平均栽植在底层底泥上,栽植深度为1.5 cm左右。
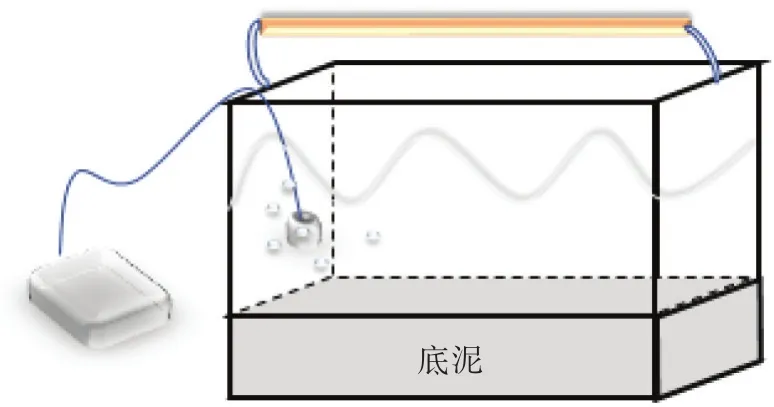
图1 实验装置简图Figure 1 Experimental device diagram
将所取底泥进行自然风干,并且去除里面的石头、草枝等杂物。将TCS溶液均匀地拌入底泥样品中,浓度分别为0.05、0.1 mg·kg-1和0.5 mg·kg-1,同时设置无TCS添加的空白对照组,平衡24 h,实验设置三个平行。
将各实验组放置于25℃恒温植物培养室中,光暗时间比为12 h∶12 h,照度约为3600 lx,实验进行28 d。分别在培养的第7、14、21 d和28 d采集植物样品按照相关分析测试方法进行前处理后保存待测。
1.3 分析方法
1.3.1 TCS在叶片中的残留
将采集的植物叶片样品冷冻干燥24 h,称取0.5 g,剪碎研磨,用10 mL乙腈提取,超声30 min,在5000 r·min-1下离心10 min,取上清液转移到40 mL棕色玻璃瓶中,重复以上步骤两次。用10%H2SO4调节pH至2~3左右后,利用固相萃取法进行浓缩富集。最后用氮吹仪将浓缩液吹干,用1 mL乙腈定容并过0.45µm滤膜后,置于棕色小玻璃瓶中,保存在-20℃冰箱中待测。用液相色谱-质谱联用仪测定样品中TCS含量[14-17],测试条件为:流动相为乙腈和水,采用梯度洗脱方式:0~8 min,乙腈由20%匀速增加到85%;保持1 min;9~10 min乙腈由85%降回到20%。流速为1.0 mL·min-1;进样体积为20µL;柱温为30 ℃;在负离子模式下进行扫描;紫外检测波长为282 nm。本实验所取标样浓度依次为 0.002、0.005、0.01、0.05、0.1、0.2、0.4µg·mL-1。标准曲线为y=-1 889.85+3.480 46x,R2=0.999 1。本实验方法的回收率在75%~85%。
1.3.2 生理生化指标的测定
叶绿素采用分光光度法[18],新鲜样品取0.2 g,加入少量石英砂和碳酸钙粉及2~3 mL提取剂95%乙醇并剪碎研磨至匀浆,过滤定容。以665、649 nm下的吸光值计算叶绿素含量,单位为mg·g-1。可溶性蛋白质量分数采用考马斯亮蓝G-250染色法[19],配制蛋白质标准溶液和考马斯亮蓝G-250溶液,称取0.2 g新鲜样品研磨匀浆,蒸馏水定容至10 mL,离心上机。以540 nm下的吸光值计算可溶性蛋白含量,以鲜质量计,单位为mg·g-1。测定抗氧化酶之前处理样品,称取0.5 g样品,用预冷后的蒸馏水研磨至匀浆,转入15 mL离心管,蒸馏水反复冲洗研钵,合并清洗液并定容,于4 ℃下12 000 r·min-1离心10 min。POD采用愈创木酚法[18,20],以470 nm下的吸光值计算酶活性,以鲜重计,单位为U·g-1·min-1;CAT采用紫外吸收法,以240 nm下的吸光值计算酶活性[18,20],以鲜质量计,单位为U·g-1·min-1;SOD采用氮蓝四唑法,以560 nm下的吸光值计算酶活性[18,20],以鲜质量计,单位为U·g-1。
1.4 数据分析
采用Microsoft Excel 2013软件对数据进行处理,SPSS 17.0统计分析软件对数据进行差异显著性检验(LSD法,α=0.05),用英文小写字母表示各处理组间的差异显著性(P<0.05),用Origin 8.0进行绘图。
2 结果与分析
2.1 轮叶黑藻叶片对底泥中TCS的吸收
TCS底泥暴露28 d内,轮叶黑藻叶片中TCS的残留情况如表1所示。由表可见,TCS暴露初期(7 d),各处理组中轮叶黑藻叶片中TCS浓度大小依次为:TCS0.1>TCS0.5>TCS0.05。暴露 14 d 时,轮叶黑藻叶片中TCS含量与暴露7 d时相比略有下降,这可能与TCS在进入植物体内初期的迁移和降解速率有关。随TCS暴露时间的延长,植株叶片中TCS含量逐渐升高,这可能与植株进入其生长旺盛期有关。0.5 mg·kg-1TCS暴露28 d时,轮叶黑藻叶片中TCS浓度最高,达到2.16 mg·kg-1。暴露浓度对轮叶黑藻吸收TCS的能力具有显著影响,由表1可见,0.05、0.1 mg·kg-1TCS处理组中轮叶黑藻对TCS吸收速率在暴露21 d后逐渐减缓,而0.5 mg·kg-1TCS暴露28 d时轮叶黑藻对TCS的吸收速率仍可达62%。在整个暴露周期中,不同浓度TCS处理组中植物叶片TCS含量均呈先下降再回升的趋势。但从整体看,与暴露初期植株体内TCS含量相比,TCS含量变化呈低浓度组趋于稳定、中浓度组降低、高浓度升高的变化规律。
2.2 TCS对轮叶黑藻叶绿素含量的影响
TCS底泥暴露对轮叶黑藻叶绿素含量的影响情况如图2所示。由图2A中可知,在28 d的暴露周期内,各处理组轮叶黑藻叶片中叶绿素含量与对照组相比显著降低,且随暴露时间延长,叶绿素含量受抑制的程度逐渐增加。0.5 mg·kg-1TCS暴露28 d时,植株叶片叶绿素含量的抑制率高达45.7%。
与叶片中叶绿素的变化情况相比,TCS对轮叶黑藻茎部叶绿素含量的抑制作用较弱。由图2B中可知,暴露7 d和14 d时,随着TCS暴露浓度的增加,植株茎部叶绿素含量逐渐降低。TCS暴露21 d后,茎部叶绿素含量有所回升,0.05~0.1 mg·kg-1TCS处理组中茎部叶绿素含量基本恢复至对照水平,但组间差异不显著,而0.5 mg·kg-1TCS处理组中轮叶黑藻茎部叶绿素含量仍然受到显著抑制。TCS暴露28 d后,茎部叶绿素含量抑制程度增加,组间差异显著。
2.3 TCS对轮叶黑藻可溶性蛋白的影响
TCS对轮叶黑藻可溶性蛋白含量的影响情况如图3所示。由图3A中可知,暴露初期,TCS对轮叶黑藻叶片中可溶性蛋白含量具有促进作用,其中0.05 mg·kg-1TCS处理组轮叶黑藻叶片中可溶性蛋白含量升高最为显著。随暴露时间延长,植株叶片中可溶性蛋白含量逐渐降低。暴露14 d时,0.05~0.1 mg·kg-1TCS处理组叶片中可溶性蛋白含量虽有所降低,但仍呈激活效应,而0.5 mg·kg-1TCS处理组叶片中可溶性蛋白含量受到显著抑制。暴露21 d后,各处理组轮叶黑藻叶片中可溶性蛋白含量均受到显著抑制,且处理组间差异显著。
与叶片中可溶性蛋白含量的变化情况相比,TCS对轮叶黑藻茎部可溶性蛋白含量的影响则呈现出明显的抑制效应(图3B)。TCS暴露7 d后,中高浓度处理组(0.1~0.5 mg·kg-1)轮叶黑藻茎部可溶性蛋白含量显著低于对照组和低浓度处理组(0.05 mg·kg-1)。随暴露时间延长,植株茎部可溶性蛋白含量有所回升,但仍呈抑制状态。暴露21 d后,0.05 mg·kg-1和0.1 mg·kg-1TCS处理组组间差异不显著,但0.5 mg·kg-1TCS处理组仍显著低于对照组。

表1 轮叶黑藻叶片中TCS浓度(mg·kg-1)Table 1 TCS concentration in leaves of Hydrilla verticillate(mg·kg-1)
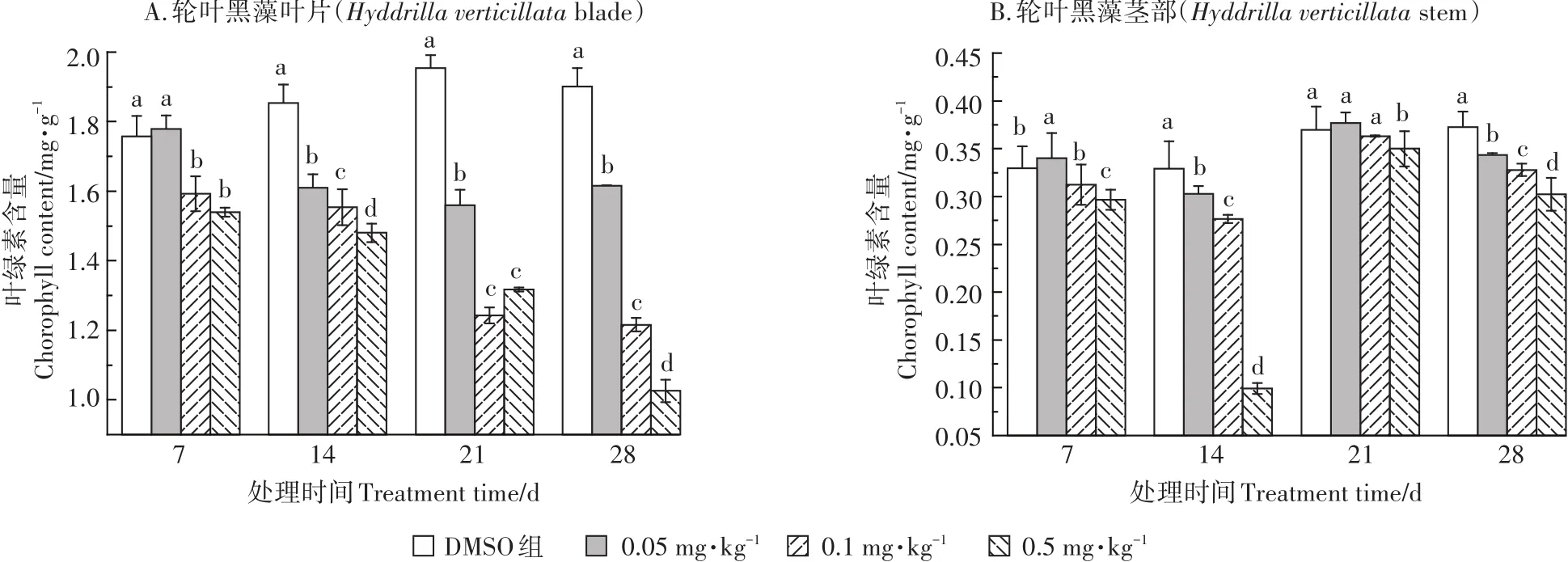
图2 TCS对轮叶黑藻叶片(A)和茎部(B)叶绿素含量的影响Figure 2 Effects of TCS on chlorophyll content of Hydrilla verticillata(A:blade;B:stem)
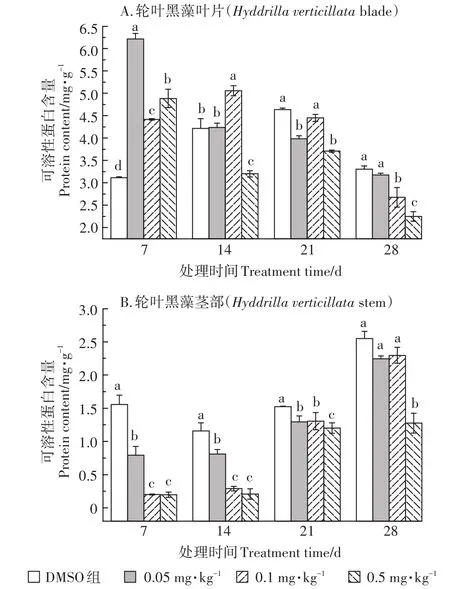
图3 TCS对轮叶黑藻叶片(A)和茎部(B)可溶性蛋白的影响Figure 3 Effects of TCS on soluble protein of Hydrilla verticillata(A:blade;B:stem)
2.4 TCS暴露对轮叶黑藻酶系统的影响
TCS暴露对轮叶黑藻叶片及茎部抗氧化酶活性的影响情况如图4和图5所示。由图4可知,暴露初期,三个处理组中叶片中CAT活性均呈激活效应。随TCS暴露浓度增加,CAT活性逐渐降低,组间差异显著。TCS暴露28 d时,各处理组中叶片CAT活性呈抑制状态。与CAT相似,0.05~0.5 mg·kg-1TCS暴露7~14 d时,植株叶片中SOD活性呈现激活状态,且随暴露浓度和时间的增加,激活效应增强,组间差异显著。0.05~0.1 mg·kg-1TCS暴露21 d时,处理组叶片中SOD活性呈激活状态,且组间差异显著,而0.5 mg·kg-1TCS处理组中SOD活性呈抑制状态。暴露末期(28 d),三个处理组叶片中SOD活性有所回升,呈轻微激活状态。与CAT和SOD活性变化趋势不同,叶片中POD活性受TCS胁迫则在整个实验周期内均呈现抑制状态。暴露21 d时,三个处理组中叶片POD活性显著降低,抑制率分别为84.9%、79.6%、87.1%。暴露28 d时,三个处理组中叶片POD活性有所回升,但仍处于抑制状态。
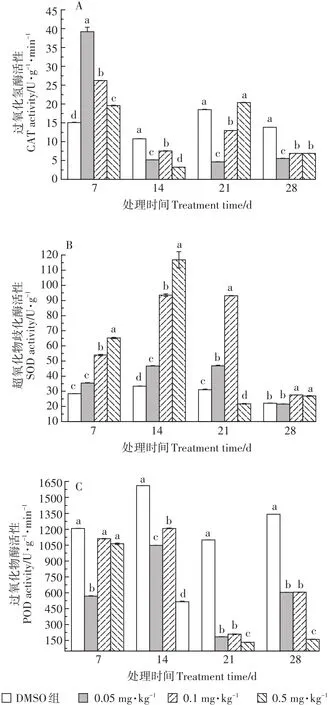
图4 TCS对轮叶黑藻叶片酶系统的影响Figure 4 Effects of TCS on antioxidant enzyme system of Hydrilla verticillate blade
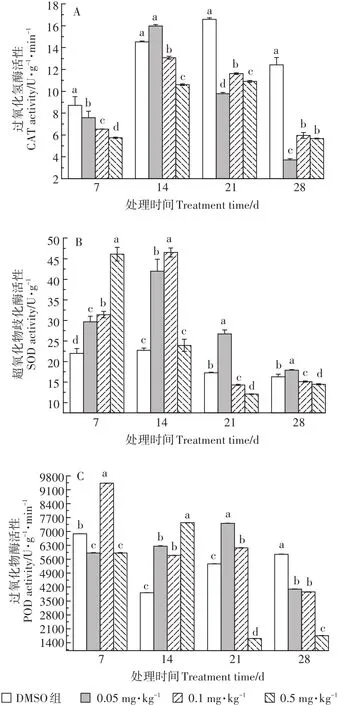
图5 TCS对轮叶黑藻茎部酶系统的影响Figure 5 Effects of TCS on antioxidant enzyme system of Hydrilla verticillata stem
TCS胁迫下,植株茎部抗氧化酶活性的变化情况与叶片中有所不同。由图5可知,暴露初期,三个处理组中茎部CAT活性均呈抑制状态,且随暴露浓度的增加,抑制程度增加,组间差异显著。暴露14 d时,茎部CAT活性呈现低浓度(0.05 mg·kg-1TCS)被促进,而中高浓度(0.1~0.5 mg·kg-1TCS)被抑制的趋势。随着暴露时间延长,CAT活性逐渐降低。TCS暴露28 d时,三个处理组茎部中CAT活性达到了最低值,其抑制率分别为72%、55.8%、59.8%。与CAT不同,暴露7~14 d时,三个处理组中茎部SOD活性均呈激活状态,且组间差异显著。随暴露时间延长,0.05 mg·kg-1TCS处理组中茎部SOD活性呈激活状态,而0.1~0.5 mg·kg-1TCS处理组中茎部SOD活性被显著抑制,且TCS浓度与茎部SOD活性抑制率之间具有一定的剂量-效应关系。POD与CAT和SOD活性变化趋势不同,7~14 d时,随暴露时间延长,诱导作用增加。TCS暴露21 d后,POD活性降低,而0.05~0.1 mg·kg-1TCS处理组中茎部POD活性仍呈诱导效应,但0.5 mg·kg-1TCS处理组中茎部POD被抑制。暴露末期,三个处理组中茎部POD活性均呈抑制状态。
3 讨论
TCS作为一种较为流行的广谱抗菌剂被广泛应用于各类洗护产品中,它会随人类活动如洗漱、淋浴、卫生消毒等进入水体与底泥,最终对生态系统以及人类健康产生一定的危害[21]。本实验结果显示,长期暴露于TCS环境下的沉水植物——轮叶黑藻体内有TCS的残留,而且植物体内TCS的含量呈现先降低后回升的趋势。在整个暴露周期内,与暴露初期植株体内TCS含量相比,TCS含量变化呈低浓度组趋于稳定、中浓度组降低、高浓度升高的变化规律。张蕾[22]研究沉水植物对有机氯农药的富集过程中也观察到有机氯污染物在植物体内先降低后升高的变化趋势。这可能是由于植株的富脂性表皮有利于吸附亲脂性的有机物的缘故。在暴露初期,轮叶黑藻叶片中累积TCS的量较多,可能是由于轮叶黑藻初期接触TCS毒性响应不明显,而叶片表面能大量吸附TCS的缘故。有研究表明表面活性剂可将土壤/底泥相有机污染物解吸出来转移到水相中[23]。但DMSO是否促进底泥中TCS的释放仍需进一步研究。随着暴露时间的延长,叶片中TCS含量降低,这与轮叶黑藻对进入其体内的TCS具有一定的迁移和降解性有一定的关系。张蕾[22]研究发现,有机氯农药在轮叶黑藻体内存在吸附-转运-降解的过程。随后,可能是由于轮叶黑藻叶片对水体中TCS的吸收作用大于其在叶片中的降解过程,使TCS在叶片中含量又出现升高现象。本实验中,TCS暴露28 d后,0.5 mg·kg-1TCS处理组中轮叶黑藻叶片中TCS浓度和累积速率最大。暴露前期,0.5 mg·kg-1的TCS显著抑制了植株的生长,致使0.5 mg·kg-1TCS处理组中叶片对TCS的累积效应低于低浓度组。暴露后期,轮叶黑藻适应TCS环境胁迫,低浓度处理组中叶片TCS浓度已接近饱和状态,而高浓度处理组中叶片后期持续累积TCS。这与Ahmed等[24]的研究结果相似,暴露一定时间后,随四环素和磺胺类抗生素暴露浓度增加在生菜、西红柿以及黄瓜体内累积量也随之增加。
叶绿素是植物进行光合作用的主要色素,其含量的高低反映植物的生长能力和代谢能力。在本实验中,TCS暴露7~28 d时,各处理组中叶片叶绿素含量显著降低,与叶片中叶绿素含量影响情况类似,7~14 d时,轮叶黑藻各处理组茎部中叶绿素含量与对照组相比呈现抑制效应。这可能是TCS暴露干扰了植株光合作用等关键代谢过程,从而影响它的生长[25]。TCS暴露也可能破坏细胞结构,使叶绿素的含量降低,也可能是TCS破坏了细胞膜系统脂质过氧化而导致叶绿素细胞器膜的受损,从而影响了叶绿素的合成[26]。虽然轮叶黑藻叶片中残留浓度在7~14 d呈下降趋势,但在这个时期植株生长仍然受到胁迫,且TCS在轮叶黑藻叶片中或者底泥微生物作用下可能降解代谢为更高毒性的甲基三氯生或者二噁英等代谢产物以致胁迫效应更大。有报道称TCS在其特定菌作用下可以生成甲基三氯生(MTCS)[27-28]。董玉瑛等[8]研究比较蝌蚪在避光和紫外下TCS的毒性作用,测得避光下 LD50值为 564.61 μg·L-1,紫外线照射下LD50值为 486.01 μg·L-1,后者毒性有较明显增加,这说明代谢产物毒性可能大于TCS母体本身。此外,实验发现TCS暴露7~14 d时,茎部叶绿素含量的降幅与TCS暴露浓度呈明显的剂量-效应关系。这与陈东等[10]研究结果类似,TCS对蛋白核小球藻的叶绿素含量的抑制程度与TCS暴露浓度呈正相关。TCS暴露对茎部叶绿素含量的变化较叶片影响较小,可能是由于轮叶黑藻的茎部没有形成层,只有初生结构,大部分TCS通过维管束结构传输到叶片中去的缘故。
可溶性蛋白作为重要的渗透调节物质和营养物质,能够提高细胞的保水能力。同时,可溶性蛋白也被认为能反映植株抗逆性的状态,它的含量的变化意味着植株处于较严峻的环境,但是环境严峻程度的持续增高,可能使可溶性蛋白含量产生不符合其生理规律的变化。在本实验中,暴露初期,处理组叶片中可溶性蛋白含量显著高于对照组,这可能是环境处于逆境时植株的抗逆性反馈所造成的。这与陈东等[10]的研究结果类似,TCS处理组使蛋白核小球藻可溶性蛋白含量增加。随着暴露时间延长,TCS处理组叶片中可溶性蛋白含量呈现抑制状态,且高浓度TCS处理组对可溶性蛋白的抑制程度显著大于低浓度TCS处理组,这可能是由于TCS的胁迫使轮叶黑藻叶片中R基因的激活受到影响,进而影响可溶性蛋白的合成,或者是由于高浓度TCS使合成的可溶性蛋白分解[10]。轮叶黑藻叶片中可溶性蛋白在暴露后期呈显著抑制状态,与叶片中TCS残留浓度在后期持续增加有关。有研究表明,当植物受有机物、重金属以及寒旱等胁迫时,植物体内的SP含量会下降[29]。与叶片中可溶性蛋白含量的变化情况相比,在整个暴露周期茎部可溶性蛋白始终处于抑制状态,这可能是由于植株的茎部直接接触底泥,同时TCS破坏茎部薄壁细胞,茎部的生长发育受到抑制。
在植物正常生长的情况下,生物体内活性氧与抗氧化系统之间具有动态平衡系统,但是植株生长的环境有污染胁迫时,会产生过多的活性氧,破坏了细胞内氧化与抗氧化平衡,损伤生理生化功能,导致一系列损伤。因此,在很多研究中,SOD、CAT和POD被用作污染物毒性的指标[30-32]。在本实验中,暴露前期(7~14 d),TCS处理组中轮叶黑藻各部位SOD活性均呈激活效应,但后期出现一定的抑制作用。SOD作为植株体内重要的氧自由基消除剂,它被认为是抗氧化防御系统的第一道防线,能够把O-2·转化成为 O2和H2O2,抑制羟基自由基等的形成,从而终止自由基连锁反应,来保护植物的氧化损伤[33]。轮叶黑藻被TCS污染胁迫后,可能导致体内产生大量的O-2·,致使SOD活性升高来维持平衡。同时根据植物残留来看后期TCS浓度增加,轮叶黑藻在高浓度TCS胁迫下,藻细胞结构遭到破坏,超过藻自身调节范围,从而导致SOD合成障碍,活性下降[25]。与SOD不同,暴露初期,三个处理组中叶片CAT活性均呈诱导效应,随暴露时间延长,CAT活性呈抑制状态。而在整个暴露周期内,轮叶黑藻茎部CAT活性均呈抑制状态。叶片中POD活性受TCS胁迫在整个暴露周期内均呈抑制状态,不同浓度TCS处理组中颈部POD活性随暴露时间延长呈现先增加后降低的趋势。TCS暴露28 d时,三个处理组中叶片POD活性均呈抑制效应。POD和CAT被认为是抗氧化系统的第二道防线,通过减少H2O2来提高细胞对氧化损伤的抵抗力。它们可以协同作用使SOD产生的H2O2转化成H2O和O2[34]。由于OD酶活在暴露初期有一定的促进现象,本实验中,POD和CAT在暴露初期为了维持抗氧化防御系统的平衡酶活性相对较高,但后期两者的酶活性也逐渐降低,整个抗氧化防御系统被破坏。
4 结论
(1)轮叶黑藻对底泥暴露的TCS具有吸收作用,植株叶片中TCS的残留浓度受暴露时间和暴露浓度的影响显著。
(2)TCS底泥暴露可显著抑制轮叶黑藻叶片中叶绿素含量,茎部中可溶性蛋白含量也被显著抑制,而轮叶黑藻叶片中可溶性蛋白含量呈先促进后抑制的趋势。叶绿素和可溶性蛋白均为典型的生理生化指标,说明TCS对轮叶黑藻有一定的生态毒性效应。
(3)TCS底泥暴露对轮叶黑藻体内CAT、SOD和POD活性具有显著影响,严重破坏了植株体内抗氧化防御系统的动态平衡,影响植株的正常生长发育。

