超声剪切波频散成像评估颈动脉黏弹性
罗向红,张健慧,邵思惠,闫 敏,吴 蓉,杜联芳,李朝军*
(1.上海交通大学附属第一人民医院超声心动图室,2.超声科,上海 200080;3.阜阳市肿瘤医院超声科,安徽 阜阳 236018)

图1 剪切波频散技术评估颈动脉黏弹性显示图 A.颈动脉剪切波弹性图,ROI内颜色由深蓝逐渐变为深红色,标示组织弹性模量为0~40 kPa; B.剪切波传播图,彩色曲线标示剪切波等时到达线,呈等间隔平行排列,剪切波传播速度快则间隔宽,传播速度慢则间隔窄; C.二维声像图; D.剪切波频散彩色图,剪切波频散值为0~100 (m/s)/kHz,由深蓝逐渐变为深红色
颈动脉是黏弹性组织,具有弹性和黏性两种特性[1],既往对其黏性特性及其生理意义研究较少[2]。超声剪切波频散技术通过产生脉冲辐射声能引起软组织震动,可获取不同频率脉冲波在组织中产生的剪切波传播速度。在黏弹性组织中,剪切波速度随激励波频率呈曲线变化,曲线斜率即剪切波频散,可间接评估组织黏性[3]。基础研究[4]表明,组织黏性与剪切波频散呈正相关,具有重要生理意义。脉搏波传播速度(pulse wave velocity, PWV)反映动脉环向弹性模量,是评价动脉弹性的“金标准”[5]。本研究采用超声剪切波频散技术检测颈动脉剪切波弹性和黏性模量指标,探讨其评估颈动脉黏弹性的可行性。
1 资料与方法
1.1 一般资料 招募2018年12月—2019年1月于上海交通大学附属第一人民医院住院的45例患者,男23例,女22例,年龄20~80岁,平均(48.9±9.7)岁。纳入标准:①既往无心脑血管事件病史;②接受超声检查,获得PWV和颈动脉剪切波黏弹性指标,且一般资料完整;③同意参加本研究并签署知情同意书。排除标准:①既往有四肢血管疾病;②罹患免疫性疾病或近期有活动性出血史,或伴恶性肿瘤、血液病及严重肝、肺、肾疾病。根据年龄将其分为≥50岁组(n=23)和<50岁组(n=22)。检查前24 h内禁止吸烟、饮酒或咖啡。收集患者身高、体质量,计算体质量指数(body mass index, BMI)。在平静状态下测量肱动脉收缩压(systolic blood pressure, SBP)和舒张压(diastolic blood pressure, DBP)3次,取均值。本研究经上海交通大学附属第一人民医院伦理委员会批准(批号:2017KY009),在中国临床试验注册中心官网注册(注册号:ChiCTR1800016590)。
1.2 仪器与方法
1.2.1 颈总动脉PWV评估 采用百胜MyLab Twice彩色多普勒超声诊断仪,LA523探头,频率4~13 MHz。内置超声射频技术QAS(quality arterial stiffness)分析软件。选取双侧颈总动脉窦部下缘1 cm处为ROI,获取双侧颈总动脉PWV,并计算两侧均值。
1.2.2 颈总动脉黏弹性指标检测 采用Canon Aplio i900实时剪切波弹性超声诊断仪,腹部探头,频率1~8 MHz(中心频率5 MHz)。双侧颈总动脉黏弹性ROI与上述PWV评估位置相同。启用黏弹性评估模式的四屏同步显示,显示器左上为剪切波弹性图,右上为剪切波传播图,左下为二维参考图,右下为剪切波频散图(图1)。同步记录心电图,嘱受检者屏气,存储10~20个心动周期的动态图像。依据心电图QRS波顶点,确定颈总动脉处于心脏收缩期。启动测量键,ROI为直径1 mm的圆形,于两侧颈总动脉浅壁和深壁(依据距离探头的远近)分别取5个ROI(每个ROI间隔1~2 mm),分析颈总动脉浅壁剪切波弹性模量值(shear wave elastic modulus values of the superficial walls, SWES)、深壁剪切波弹性模量值(shear wave elastic modulus values of the deep walls, SWED)、浅壁剪切波频散值(shear wave dispersion values of superficial walls, SWDS)和深壁剪切波频散值(shear wave dispersion values of deep walls, SWDD),计算双侧颈动脉浅、深壁各ROI的平均值,并计算双侧颈动脉浅壁和深壁的平均剪切波弹性模量值(SWE)和平均剪切波频散值(SWD)用于相关性分析。
1.3 统计学分析 采用SPSS 13.0统计分析软件。符合正态分布的计量资料以±s表示,2组间比较采用两独立样本t检验;为消除BMI、SBP和DBP对颈动脉黏弹性参数的影响,对颈动脉黏弹性参数进行基于BMI、SBP和DBP的校正,然后再次比较。采用配对t检验比较颈动脉浅壁与深壁间黏弹性指标。以χ2检验比较2组间性别构成差异。采用Pearson相关分析观察黏弹性指标(SWE和SWD)与血压、PWV的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 <50岁组SBP和DBP均低于≥50岁组,身高高于≥50岁组(P均<0.05),2组间性别、体质量和BMI差异均无统计学意义(P均>0.05),见表1。
2.2 颈总动脉黏弹性指标 与<50岁组比较,≥50岁组颈总动脉PWV增高,经BMI、SBP和DBP校正后,2组间PWV差异仍有统计学意义(P<0.001),见表2。<50岁组颈总动脉SWES、SWED、SWDS和SWDD均大于≥50岁组(P均<0.05),经BMI、SBP和DBP校正后,差异亦有统计学意义(P均<0.05),见表2。所有受检者中,颈总动脉SWES为(19.41±19.04)kPa,SWED为(7.95±4.49)kPa,差异有统计学意义(t=2.269,P=0.035);SWDS为(13.33±3.48)(m/s)/kHz,SWDD为(12.56±3.74)(m/s)/kHz,差异无统计学意义(t=1.982,P=0.075)。
2.3 相关性分析 颈总动脉SWE与年龄、SBP、DBP和PWV呈负相关(r=-0.282、-0.374、-0.321、-0.256,P均<0.05)。≥50岁组中,SWE仅与SBP呈负相关(r=-0.357,P=0.046);颈总动脉SWD在≥50岁组中与PWV呈负相关(r=-0.393,P=0.038),在<50岁组中与SBP呈正相关(r=0.366,P=0.048)。

图2 Voigt剪切波黏弹性理论模型示意图
3 讨论
人体内血液通过动脉树输送基于两个主要机制:传导运输,促进向微循环运输血液;缓冲脉动,缓冲脉动波从大动脉传播到小血管。大动脉的顺应性好,主
表1 ≥50岁组与<50岁组受检者一般资料比较(±s)

表1 ≥50岁组与<50岁组受检者一般资料比较(±s)
组别男/女(例)年龄(岁)身高(cm)体质量(kg)BMI(kg/m2)SBP(mmHg)DBP(mmHg)≥50岁组(n=23)12/1165.9±9.5162.91±7.1268.32±17.3125.82±7.42139.62±11.1187.89±7.22<50岁组(n=22)11/1131.1±9.8167.48±7.8566.68±15.4723.47±4.09125.68±9.1279.67±6.13χ2值/t0.02313.673-2.3010.3481.4445.1024.607P值0.879<0.0010.0250.7290.154<0.001<0.001
表2 ≥50岁组与<50岁组颈动脉PWV和黏弹性指标比较(±s)

表2 ≥50岁组与<50岁组颈动脉PWV和黏弹性指标比较(±s)
组别PWV(m/s)SWES(kPa)SWED(kPa)SWDS[(m/s)/kHz]SWDD[(m/s)/kHz]≥50岁组(n=23)8.67±2.1313.82±14.546.75±4.6012.45±3.9011.52±3.12<50岁组(n=22)5.47±0.7025.26±23.749.21±4.3914.26±3.0413.68±4.38t值2.901-2.132-2.021-2.015-2.121P值<0.0010.0340.0450.0480.038BMI校正后P值<0.0010.0320.0280.0240.022SBP校正后P值<0.0010.0220.0060.0020.002DBP校正后P值<0.0010.0200.0070.0020.002

图3 脉冲波频率与组织剪切波关系示意图
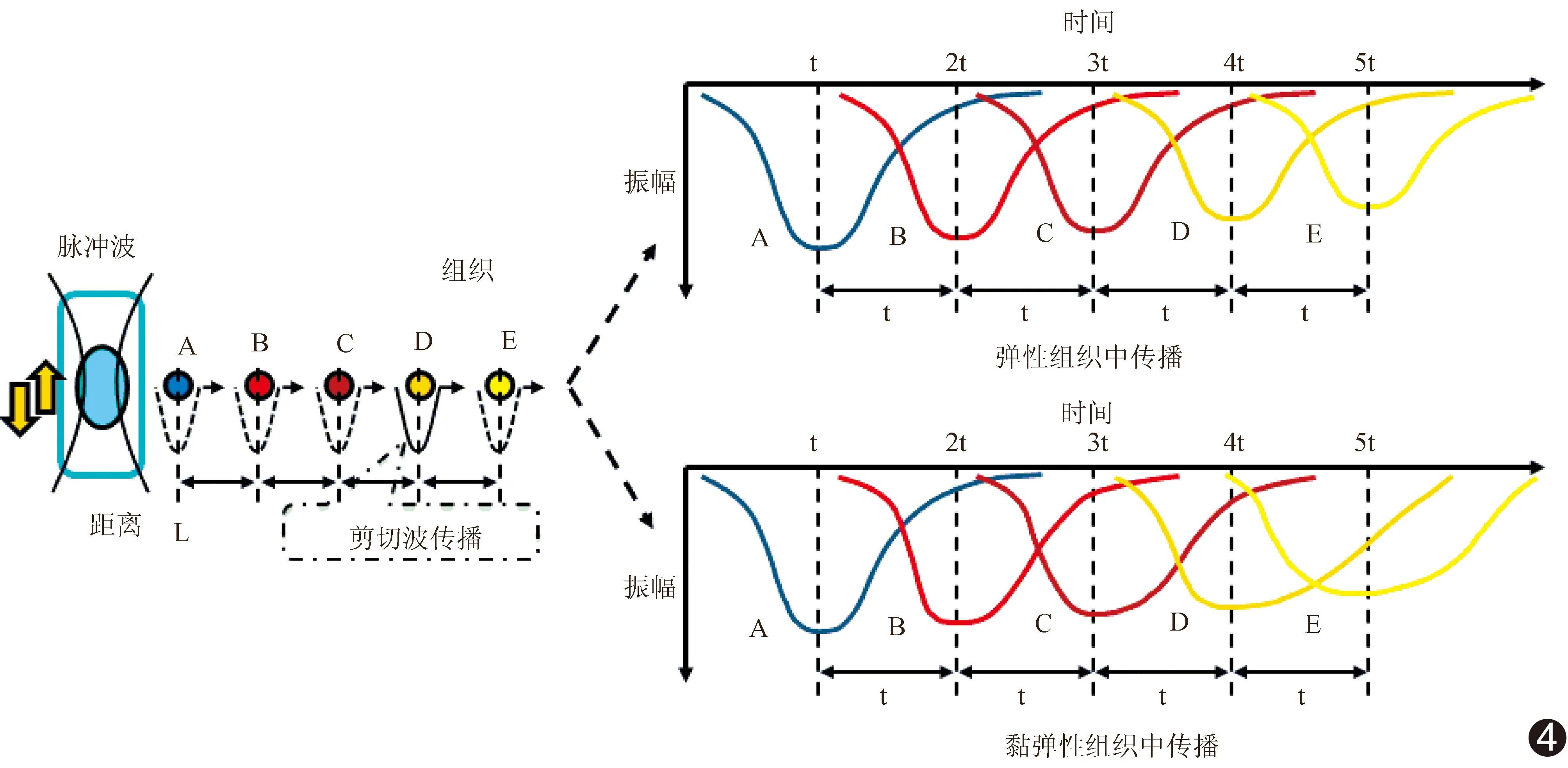
图4 剪切波弹性模量测量示意图

图5 剪切波频散检测示意图
要表现为弹性或黏弹性膨胀,而较小动脉则更加刚性,动脉壁以黏弹性的特性行机械舒缩[6];但单纯以刚性或弹性管道理论均不能完全正确地反映血管的“黏弹性”问题。本研究采用剪切波频散技术评估颈总动脉的黏弹性,结果表明,高龄者(≥50岁)颈总动脉壁浅、深壁SWE和SWD均较低龄者(<50岁)减低,且与年龄、血压和PWV密切相关,提示高龄者颈总动脉黏弹性减弱,可能存在动脉硬化。
3.1 颈总动脉的黏弹性 颈动脉壁主要由胶原纤维、弹性纤维和少量平滑肌细胞组成,生物力学特征主要表现为弹性,其次是黏性[7]。应力-应变关系是鉴别组织弹性或黏弹性的主要力学特性[8]。弹性组织的应力-应变关系呈线性,二者比值是定值即弹性模量,是反映组织软硬度的重要指标[8]。黏性材料的应力-应变关系呈非线性,二者比值是非定值,表现为应力松弛和蠕变[8]。应力松弛是指应变一定时,应力随时间延长而减小,动脉壁扩张程度一定时,动脉壁张力会随时间延长而减小。蠕变是指应力一定时,应变会随时间延长而增大;换言之,动脉壁张力一定时,即血压恒定,血管壁应变随时间延长而增大,表现为动脉管径增大和延长[9]。因此,动脉黏弹性可以理解为是动脉的储备功能和重构能力。本研究中高龄受检者颈总动脉浅、深壁黏弹性指标低于低龄者,提示高龄者颈动脉黏弹性特性减弱,动脉储备功能减低和适应性减弱,可能与动脉壁的胶原纤维、弹性纤维和平滑肌细胞的含量、比例和空间构型改变有关[10]。弹性纤维主要表现为弹性特性,并使胶原组织在载荷作用下具有一定延伸能力。胶原纤维具有一定强度和刚度,主要表现为黏性特性,存在应变滞后和应力松弛现象。老年人颈动脉应力松弛慢于青年人,而蠕变程度同样低于青年人[10];对应组织学,老年人颈动脉中层平滑肌细胞增生活跃、排列紊乱,致部分弹力层断裂、崩解,弹力纤维含量降低而胶原纤维增生、排列紊乱。老年人颈总动脉最大应力、最大应变、弹性限度应变大[11],颈总动脉壁肌细胞排列紊乱、肌细胞增生活跃,中层部分弹力膜断裂,而青年组颈动脉弹力膜完好,肌细胞排列整齐,提示颈动脉黏弹性改变可能与年龄或动脉硬化有关。
3.2 剪切波频散技术与黏弹性 剪切波速度是评估组织软硬度的有效参数[12]。在弹性组织中,剪切波速度不随激励波频率的变化而变化(图2)。在黏弹性组织中,剪切波速度随激励波频率呈曲线变化,曲线斜率称为剪切波频散(图2)。剪切波频散与组织黏弹性密切相关,可反映材料的黏弹性。Widman等[13]采用剪切波弹性成像检测5条离体猪动脉的剪切波模量,结果发现其可有效评估动脉的剪切模量,且提示使用相速度分析剪切模量需要大于1 500 Hz的剪切波带宽和较高的脉冲重复频率。相似研究[14]采用快速剪切波成像获取动脉壁瞬时剪切波及波频散,结果发现动脉壁硬度与其几何形态相关;将此技术用于健康志愿者,发现在心脏收缩期颈动脉弹性模量为(130±15)kPa,舒张期为(80±10) kPa;这与本研究结果相似,但正常值范围存在一定的差异,分析原因可能为动脉为薄壁组织,频散可能源自组织黏弹性和组织有限厚度[14]。另外也有研究[15]认为,对于血管类薄壁组织,因壁厚度有限导致不能直接根据群速度测量得到弹性模量,较为认可的方法是Lamb波模型。剪切波频散技术容易在已有剪切波弹性技术的基础上实现,方法较多,如快速剪切波成像技术[16]和慢速剪切波成像技术[17]。本研究采用的超声剪切波弹性技术是采用不同频率的超声激励波使组织震动,通过脉冲回波技术探测出剪切波速度,根据Voigt模型[17]定量组织的弹性系数和黏性系数(图3)。本研究2组颈总动脉SWEs均大于SWED,但黏性指标SWD不存在此差异,原因可能是超声剪切波弹性技术存在压力依赖性,颈动脉浅壁受到探头压力的影响较深壁更明显[18]。
目前大多数商用超声剪切波技术是基于弹性组织,假设人体组织为弹性体[19-20]。在弹性组织中,剪切波的振幅随传播距离的增加而减弱,而波形不变(图4)。在黏弹性组织中,剪切波的波形和振幅随传播距离均发生改变(图4)。因此,应用已有的剪切波弹性技术评估黏弹性组织会存在一定误差,或不能真实地反映人体组织的黏弹性。Voigt模型由一个弹簧单元E和一个阻尼单元(黏壶)η并联组成(图5)。在均质介质中,Voigt的黏弹性模型能够很好地评估组织黏弹性,应用较为广泛[20]。Kumar等[21]基于Voigt模型,应用超声剪切波频散技术评估28例女性患者乳腺可疑肿块的黏弹性,并与病理组织学对照,发现15个良性肿块的剪切波黏度系数[(2.83±1.47)Pa·s]明显小于恶性肿块的剪切波黏度系数[(8.22±3.36)Pa·s],表明剪切波频散技术可用于区别乳腺肿块的良恶性,同样提示剪切波频散技术有望成为无创评估组织黏弹性的有效手段,但是在评估动脉等薄壁组织时,不同的技术的检测结果差异较大,需要谨慎选择。
本研究的局限性:样本量较少,且未观察心脑血管疾病患者颈动脉壁黏弹性变化;采用凸阵探头检测颈动脉,测量精度欠佳。
综上所述,本研究发现高龄者(≥50岁)颈总动脉壁黏弹性指标值均减低。超声剪切波频散技术可无创、定量评估动脉壁黏弹性,有望为临床研究动脉疾病提供新的视角和手段,但不同技术的研究结果存在差异,需谨慎甄别。

