基于超声-CT图像的心脏影像融合数据处理方法
陈思楷,周 青,周燕翔,宋宏宁,邓 倾,杨远婷,陈金玲
(武汉大学人民医院超声影像科,湖北 武汉 430060)
近年来,经食管三维超声心动图(three-dimensional transesophageal echocardiography, 3D-TEE)迅速发展,显示心脏瓣膜优于CT[1-3],超声三维重建心脏瓣膜结构具有较高空间分辨率和准确率,且无辐射损害,已用于临床[4-6],并具备与其他模态3D图像融合的基础。不同模态医学影像图像之间具有互补性,将其融合可获得更丰富的临床信息[7-8]。多模态影像融合有利于发挥不同成像方式的优点,是心脏3D打印技术发展中的重要技术,但关于图像融合的方法学及准确率评估尚不统一。本研究采用动物实验探讨超声左心瓣膜与CT心腔图像融合的方法学,与心脏标本对照确定融合配准指标,继而通过临床研究验证图像融合方法的可行性和融合配准指标的可靠性。
1 材料与方法
1.1 动物实验 雄性比格犬6只,月龄5.12~6.73个月,平均(6.03±0.62)个月;体质量9.57~10.78 kg,平均(10.21±0.33)kg。实验动物由北京玛斯生物技术有限公司提供,许可证号:SCXK(京)2016-0001。
1.1.1 图像采集 经静脉注射3%戊巴比妥钠30 mg/kg体质量对实验犬进行麻醉,以2 ml/h维持麻醉,气管插管后以呼吸机辅助通气。
CT扫描:采用GE Revolution Xtream 256排CT扫描仪,将已麻醉的实验犬左侧卧位保定于扫描床。采用高压注射器以1 ml/s流率注射10 ml碘普罗胺(300 mgI/ml)。采用心电门控监测心律,选取1个完整R-R间期,当主动脉根部对比剂CT值达250 HU时触发扫描。增强扫描参数:管电压100 kV,管电流200~500 mA,噪声指数12,扫描层厚和重建层厚均为0.625 mm。
3D-TEE检查:采用GE Vivid E9超声仪,食管三维容积探头6VT-D,频率3.5~7.0 MHz。CT扫描结束后,于左侧第6肋间开胸,行心包悬吊后将探头置于实验犬心包腔中,直接接触心脏表面采集4D图像。调整探头,待清晰显示左心瓣膜二维灰阶图像后,使用“4D ZOOM”功能将左心瓣膜置于取样框中,于心尖五腔心切面采集主动脉瓣图像,于右房室沟三尖瓣环旁切面采集二尖瓣图像和主动脉瓣图像,储存连续5个心动周期二尖瓣及主动脉瓣容积图像。
1.1.2 图像后处理 CT图像处理:采用GE ADW 4.6工作站,导出75% R-R间期实验犬DICOM格式数据。以Mimics innovationsuite 19.0软件对CT数据行阈值分割(设定阈值为625~3 000 HU),去除左心房、左心室和主动脉根部以外的图像后,将上述3部分分割并单独存储,获取CT左心血池容积图像。然后将左心房、左心室及主动脉根部血池容积图像外扩2 mm,删除原血池容积图像,获得模拟左心腔壁结构图像,经光滑降噪处理后以STL(stereo lithography)格式保存(图1)。
3D-TEE图像处理:采用EchoPac工作站,为保持与CT图像处于同一时相,从75% R-R间期实验犬心脏数据中选取二尖瓣开放时相和主动脉瓣闭合时相容积图像进行后处理。以Mimics innovationsuite 19.0软件对超声心脏数据进行阈值分割(二尖瓣设定为70~240,主动脉瓣设定为50~220),去除心脏瓣膜周边组织和噪声图像,手动填充部分回声失落区域,获得超声二尖瓣及主动脉瓣容积图像,经光滑降噪处理后以STL格式保存(图1)。
1.1.3 图像配准融合 时间配准:CT增强和3D-TEE均选取75% R-R间期图像。空间配准:采用以心脏瓣环结构为配准点的内部特征法,标记主动脉瓣环和二尖瓣环上移动幅度较小的点为配准点,将两种不同模态的心脏影像相融合。二尖瓣环配准点包括前瓣瓣环中点、后瓣瓣环中点、前外侧联合点(anterior lateral combination, ALC)及后内侧联合点(posterior interior combination, PIC);主动脉瓣环包括左冠窦、右冠窦及无冠窦中点,并通过上述配准点确定瓣环平面。于融合图像上测量图像配准指标,即二尖瓣ALC、PIC到心尖部的最大径(D-ALC、D-PIC),主动脉瓣闭合口(aortic valve closure, AVC)到心尖部的最大径(D-AVC)和二尖瓣环平面与主动脉瓣环平面夹角(angle between the plane of mitral annulus and aortic annulus, AMA)。将测量数据归为动物融合组。

图1 Mimics innovationsuite 19.0软件中实验犬超声和CT 3D DICOM图像后处理 A~C.对超声主动脉瓣(A)、二尖瓣(B)及CT左心腔室结构(C)的阈值分割; D~F.图像分割后3D重建对应左心结构STL格式数字模型

图2 3-Matic 11.0软件将超声心脏瓣膜STL文件和CT心腔STL文件依照配准点相融合,最终获得超声-CT心脏影像融合左心数字模型 A.超声瓣膜和CT心腔结构; B.瓣膜与心腔结构融合; C.融合心脏影像

图3 于心脏标本示中测量图像配准指标示意图 A.从犬心脏上游离下二尖瓣及主动脉瓣瓣膜标本,示ALC和PIC位置,于游离前心脏标本中测量距离,游离后标本测量AMA; B.心脏瓣膜示意图,示ALC、PIC和AMA; C.心脏标本示主动脉瓣口位置(升主动脉方向观)
将CT左心STL文件和超声瓣膜STL文件导入3-Matic 11.0软件,保证图像配准时CT容积图像固定,移动超声瓣膜图像与CT心腔图像相融合。隐藏左心室图像,调整二尖瓣及主动脉瓣容积图像的空间位置和开口方向,先将瓣环平面大致匹配,然后逐个将每个配准点相重合,反复微调使超声瓣膜图像与CT心腔中瓣环位置重合,删除重复容积图像信息,对拼接融合处行局部光滑处理,最终获得超声-CT影像融合3D心脏容积图像(图2)。
1.1.4 测量心脏标本 经静脉快速注射10%氯化钾溶液10 ml,使犬心脏停搏于舒张期,之后取出心脏,置于10%甲醛固定液中固定。24 h后将心脏标本取出置于操作台,使用电子游标卡尺测量D-ALC、D-PIC和D-AVC(图3)。游离心脏瓣膜,仅保留二尖瓣及主动脉瓣瓣叶根部外缘约2 mm的纤维结缔组织,视为瓣环结构,然后将二尖瓣和主动脉瓣从心脏标本上游离,使用测角器测量AMA(图3)。将测量数据归为动物标本组。
1.2 临床研究
1.2.1 一般资料 选取2018年1—9月我院拟接受心房颤动(简称房颤)介入治疗的41例房颤患者,男23例,女18例,年龄39~68岁,平均(51.2±12.6)岁。排除其他心律失常、心肌病、先天性心脏病或冠心病等心脏疾病患者。
1.2.2 仪器与方法 所用CT和3D-TEE检查仪器与动物实验相同。
CT检查:嘱患者仰卧,扫描范围从气管分杈水平至膈肌下约5 cm,经右肘前静脉注射非离子型对比剂优维显(370 mgI/ml),流率4~5 ml/s,剂量1.0~1.2 ml/kg体质量,总量60~80 ml。在回顾性心电门控下屏气扫描,管电压120 kV,管电流300~650 mA,螺距0.984,扫描层厚5 mm,重建层厚0.625 mm。
表1 动物融合组与动物标本组测量图像配准指标的比较(±s,n=6)

表1 动物融合组与动物标本组测量图像配准指标的比较(±s,n=6)
组别D-ALC(mm)D-PIC(mm)D-AVC(mm)AMA(°)动物融合组43.89±0.6442.07±1.1243.48±1.09117.03±4.33动物标本组45.33±0.5243.44±1.4944.58±2.02115.80±5.29t值-0.897-1.866-1.4211.267P值0.2310.1210.2150.261
表2 临床CT组与临床融合组测量图像配准指标的比较(±s,n=41)
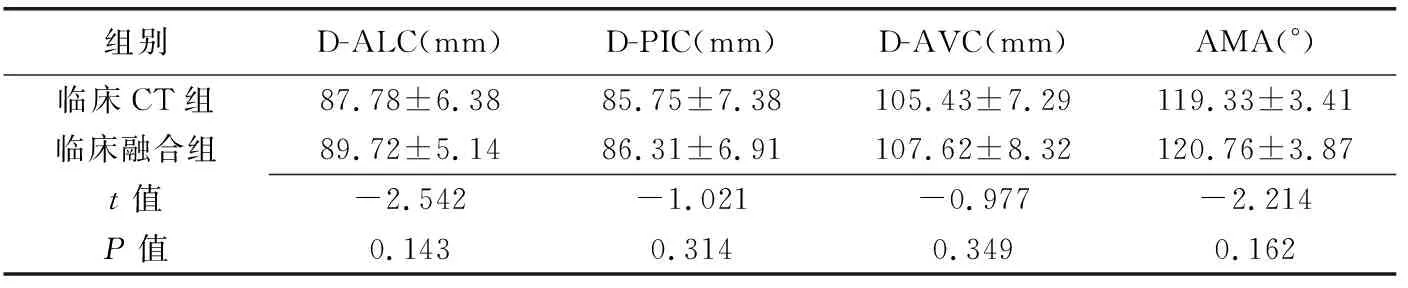
表2 临床CT组与临床融合组测量图像配准指标的比较(±s,n=41)
组别D-ALC(mm)D-PIC(mm)D-AVC(mm)AMA(°)临床CT组87.78±6.3885.75±7.38105.43±7.29119.33±3.41临床融合组89.72±5.1486.31±6.91107.62±8.32120.76±3.87t值-2.542-1.021-0.977-2.214P值0.1430.3140.3490.162

图4 临床实验中临床融合组与临床CT组各参数测量值的一致性分析 A.D-ALC; B.D-PIC; C.D-AVC; D.AMA
3D-TEE检查:于食管中段获取清晰心脏二维灰阶图像后,使用“4D ZOOM”功能在主动脉根部长轴切面(食管超声探头探测角度120°)及左心矢状切面(食管超声探头探测角度90°)将主动脉瓣及二尖瓣置入取样框,调节3D增益获取最优图像效果,Single Beat下存储连续5个心动周期二尖瓣及主动脉瓣容积图像。
1.2.3 图像后处理 图像处理方法和测量指标同动物实验。将数据分为2组,1组为心脏CT增强图像直接测量图像配准指标的临床CT组,另1组为超声-CT图像融合后测量图像配准指标的临床融合组。
1.3 统计学分析 采用SPSS 24.0统计分析软件。计量资料以±s表示,2组间测量数据差异的比较采用配对t检验,一致性采用Bland-Altman分析。P<0.05为差异有统计学意义。
2 结果
2.1 动物实验 对6只实验犬均成功行超声与CT心脏影像融合后处理,动物融合组D-ALC、D-PIC和D-AVC测量值与动物标本组差异无统计学意义(P均>0.05,表1),2组差值均小于动物标本组测量值的5%;2组间AMA差异无统计学意义(P=0.077,表1),且组间差值均小于5°。
2.2 临床研究 对41例患者均成功实现超声-CT心脏影像融合数字模型,临床融合组与临床CT组间D-ALC、D-PIC、D-AVC和AMA测量值差异均无统计学意义(P均>0.05,表2)。比较融合图像和CT图像中的测量值,D-ALC、D-PIC和D-AVC差值百分比在5%以内者均占87.80%(36/41),AMA差值在5°以内者占92.68%(38/41),见图4。
3 讨论
笔者前期超声DICOM数据3D重建结果[9-10]显示,多模态影像融合中,最关键的是图像融合配准的准确性。图像配准包括时间配准和空间配准。时间配准中,超声图像和CT增强图像的R-R间期不一定相等,75% R-R间期的CT增强图像中,左心室处于舒张末期,二尖瓣开放,主动脉瓣关闭,可根据此时CT心电门控上的心电时相选取超声瓣膜容积图像中对应时相,以保证2种不同模态的心脏影像能够在时间上达到配准。空间配准中,本研究首先确定二尖瓣环以及主动脉瓣环上的配准点,使用3-Matic软件配准超声瓣膜时,不仅2个瓣膜瓣环平面需要重合,配准点也需尽可能重合,将重建的心脏瓣膜在3-Matic软件中移动、旋转,可使CT和超声图像中配准点相重合,然后微调瓣环平面夹角,最终得到多模态左心融合数字模型。
本研究的动物实验中,融合图像与心脏标本配准指标中AMA差异无统计学意义,且差值较小(均<5°)。Zheng等[11-12]尝试将X线与CT图像融合、超声与CT椎骨图像融合,最终认为图像融合后测量误差在5°以内可以接受。二尖瓣环与主动脉瓣环之间通过一个共同的坚韧纤维相延续,以固定主动脉和二尖瓣,并在心室的附着处增厚,形成左纤维三角。二尖瓣平面与主动脉瓣平面夹角在心脏运动中变化幅度较小,因此瓣环平面差值<5°提示瓣膜图像融合配准成功。心脏标本中D-ALC、D-PIC和D-AVC较融合图像中测量值略大,但差异无统计学意义,且测量差值均<5%,提示两者相关性好。两组间产生测量误差的原因可能是游标卡尺的测深尺在标本左心室中测量时部分尖端伸入心肌软组织内所致。瓣环平面融合准确时,这3个距离测量指标反映心脏瓣膜与心脏整体结构之间的空间位置,因此心脏瓣环与心尖部最大径差值<5%时,可以认为心脏瓣膜的融合是准确的。
本研究临床试验结果与动物实验结果相似,临床融合组与临床CT组间D-ALC、D-PIC、D-AVC和AMA测量值差异均无统计学意义(P均>0.05),且前三者差值均在5%以内者占87.80%(36/41),92.68%(38/41)的AMA差值在5°以内,提示通过影像融合技术可获得更多解剖学信息,其误差在可接受范围内,心脏多模态融合影像能够满足临床需求。
综上所述,采用本研究中的图像处理方法流程及图像处理软件,可将超声心脏瓣膜图像与CT心脏腔室图像相融合,获取较准确的多模态3D心脏影像,弥补传统CT对于心脏瓣膜结构显示的不足,为获取更有临床价值的3D打印模型提供方法和数据源。

