辣木叶毛霉固态发酵过程中主要营养成分及其抗氧化活性的动态变化研究
张云娟,田 洋,周 学,赵丹丹,李凌飞*
(1.云南农业大学食品科学技术学院,云南 昆明 650201; 2. 云南省农业科学院农业经济与信息研究所,云南 昆明 650205)
【研究意义】辣木(MoringaoleiferaLam)又称鼓槌树、奇迹之树,为辣木科辣木属植物。辣木全身都是宝,其根、茎、叶、花、种子、树皮、树胶均可食用或药用。辣木含有丰富的营养物质,近年来,辣木以高蛋白、高钙、高纤维、高维生素、低脂肪的健康特性以及降血糖、降血压、降血脂、抗氧化、抗病毒、消炎抑菌等保健功效而成为健康食品界的新宠,被誉为新时代健康食物[1]。同时,作为“新资源食品”的辣木叶,也在2012年被中国绿色发展中心认定为“国家首推绿色食品”。固态发酵作为一种高效且经济的发酵技术,已在食品加工中被广泛利用[2]。由于在发酵过程中,微生物可以产生一系列复杂的酶系,能够促进一些生物活性成分的产生。因此,通过微生物发酵改善口感、提高原料的营养价值或产品的生物活性已成为当前研究的热点。【前人研究进展】研究表明,一些食品原料经微生物发酵后其生物活性大大提高。管瑛等[3]人研究了米根霉和少孢根霉对豆渣固态发酵过程中主要营养成分及其抗氧化特性的影响,结果表明发酵提高了豆渣的营养成分及抗氧化活性。赵丹[4]等人研究了真菌固态发酵紫米过程中营养成分的变化,结果表明真菌发酵的紫米具有更高的营养价值,具有潜在的作为缓解高血压辅助疗法的功能食品的能力。近年来,关于辣木发酵物营养成分及其功能活性的研究报道较少。研究表明,辣木发酵后的提取物可以降低高脂饮食诱导的小鼠肥胖症状并改善葡萄糖耐受量[5]。Zhang等[6]研究了短小芽孢杆菌发酵辣木叶过程中营养成分及其抗氧化活性的变化,表明短小芽孢杆菌发酵能提高辣木叶粉中可溶性蛋白的含量、总酚含量以及抗氧化活性。【本研究切入点】鲁氏毛霉(Mucorroxianus)为毛霉科鲁氏毛霉属真菌,它能产生大量蛋白酶,具有较强的分解蛋白的能力。蛋白质分解可产生多肽、小分子短肽及氨基酸。辣木叶中含有丰富的蛋白质。目前,利用毛霉发酵辣木叶的研究尚未见报道。【拟解决的关键问题】本研究以辣木叶为原料,通过鲁氏毛霉进行固态发酵,检测发酵过程中发酵物的可溶性蛋白、游离氨基酸、可溶性多糖、多酚等主要营养成分的含量变化,测定蛋白酶、纤维素酶和糖化酶的活力,探讨发酵物的抗氧化能力,为利用辣木叶开发相关功能性食品提供理论参考。
1 材料与方法
1.1 供试材料
辣木叶粉购于德宏天佑科技有限公司,过100目筛。
菌种:鲁氏毛霉(Mucorrouxianus)由云南农业大学食品科学技术学院食品微生物实验室保存。
实验试剂:马铃薯葡萄糖琼脂(PDA)培养基、马铃薯葡萄糖肉汤(PDB)培养基、没食子酸、福林酚、酪氨酸、酪蛋白、羧甲基纤维素钠、可溶性淀粉、DPPH、ABTS、过硫酸钾购自北京索莱宝科技有限公司;牛血清白蛋白V5购自上海伯奥生物科技有限公司;考马斯亮蓝G250、谷氨酸、葡聚糖、蒽酮、茚三酮、氯化亚锡购于上海源叶生物科技有限公司;3, 5-二硝基水杨酸、硫酸、磷酸、无水乙醇、三氯乙酸、碳酸钠、碳酸氢钠购于重庆川东化工(集团)有限公司;磷酸氢二钾、磷酸二氢钾购于西陇化工股份有限公司。
1.2 实验方法
1.2.1 种子液制备 挑取少量鲁氏毛霉接种于PDA培养基上,28 ℃恒温培养3 d进行菌种活化。然后挑取活化的毛霉菌丝接种于PDB液体培养基中,28 ℃ 150 rpm恒温摇瓶培养3 d,获得含大量鲁氏毛霉孢子的种子液备用。
1.2.2 固体发酵实验 将上述种子培养液按接种量5 %添加于灭菌后的辣木叶粉中,用无菌水调节辣木叶粉的湿度为60 %,28 ℃恒温发酵15 d。实验设置4个重复样本。在发酵期间,每天轻轻抖动培养瓶,使菌丝和辣木叶粉充分混合均匀。分别于发酵前、发酵3、6、9、12、15 d取样,经真空冷冻干燥后,进行主要营养成分、酶活力和抗氧化能力检测。
1.3 主要营养成分测定
1.3.1 可溶性蛋白含量测定 采用考马斯亮蓝染色法[7]测定样品中可溶性蛋白的含量。以牛血清蛋白(BSA)作为标准品,以BSA含量为横坐标(X),以吸光度为纵坐标(Y),获得标准曲线方程为Y=0.7443X+0.0055(R2=0.9993)。取1 mL样品溶液至试管中,加入4 mL考马斯亮蓝G250染液,摇匀,室温放置3 min,以0 mL试管为空白,在595 nm测定吸光度。根据标准曲线方程计算样品中可溶性蛋白的含量。
1.3.2 游离氨基酸总量 采用茚三酮比色法[8]测定样品中游离氨基酸的总量。以谷氨酸作为标准品,以谷氨酸含量为横坐标(X),以吸光度为纵坐标(Y),获得标准曲线方程为Y=2.701X-0.0664(R2=0.9945)。取1 mL样品溶液至试管中,加入0.5 mL pH 8.0磷酸缓冲液,再加入0.5 mL 2 %茚三酮溶液。沸水中加热15 min。冷却后加水定容至25 mL。在570 nm处测定吸光度。根据标准曲线方程计算样品中游离氨基酸的总量。
1.3.3 可溶性多糖含量 采用蒽酮-硫酸法[9]测辣木中可溶性多糖的含量。以葡聚糖作为标准品,以葡聚糖含量为横坐标(X),以吸光度为纵坐标(Y),获得标准曲线方程为Y=9.4202X-0.0131(R2=0.9979)。取样品溶液100 μl,加蒸馏水定容至1 mL,加入2 g/L蒽酮硫酸溶液4 mL,沸水浴10 min。冷却后于625 nm处测定吸光度。根据标准曲线方程计算样品中可溶性多糖的总量。
1.3.4 多酚含量 参照姚文华等报道的福林酚法[10]测辣木中多酚的含量。以没食子酸作为标准品,以其质量浓度为横坐标(X),吸光度为纵坐标(Y),得到标准曲线方程为Y=0.0011X+0.0013(R2=0.9995)。取10 mg/mL醇溶样品,加水稀释100倍。取1 mL稀释液,加入2 mL 2 %的NaHCO3溶液,1 mL福林酚溶液,于765 nm处测定吸光度。根据标准曲线方程计算样品中多酚的总量。
1.4 酶活力计算
1.4.1 蛋白酶的活力 参照GB/T 23527-2009蛋白酶制剂方法[11]测定样品中的蛋白酶活力。以酪氨酸作为标准品,以其质量浓度为横坐标(X),吸光度为纵坐标(Y),得到标准曲线方程为Y=0.0085X+0.0141(R2=0.9991)。辣木叶水提液1 mL,加入酪蛋白1 mL,40 ℃保温10 min;加入0.4 M三氯乙酸2 mL终止反应,继续保温20 min,离心后往上清液中加0.4 M Na2CO3溶液5 mL,福林试剂1 mL,40 ℃保温发色20 min,于660 nm处进行测定吸光度。根据标准曲线方程计算样品中蛋白酶活力。
1.4.2 纤维素酶的活力 参照王琳等人的方法[12]测定样品中的纤维素酶活力。以葡萄糖为标准品,以其质量浓度为横坐标(X),吸光度为纵坐标(Y),获得标准曲线方程为Y=0.0582X+0.0067(R2=0.9998)。辣木叶水提液1 mL,0.5 %羧甲基纤维素钠溶液3 mL,50 ℃水浴糖化10 min。加入3, 5-二硝基水杨酸显色液5 mL,沸水浴10 min;快速冷却至室温后,于550 nm处测定吸光度。根据标准曲线方程计算样品中蛋白酶活力。
1.4.3 糖化酶的活力 采用3, 5-二硝基水杨酸法测定样品中的糖化酶活力[13]。方法同1.4.2 纤维素酶活力测定的方法,不同之处只在于将底物0.5 %羧甲基纤维素钠溶液换为可溶性淀粉溶液。
1.5 抗氧化能力测定
1.5.1 DPPH自由基清除能力 根据Ullah等[14]的方法进行DPPH自由基清除能力的测定。将1 mL样品加入到1 mL 0.2 mM DPPH溶液中,同时用乙醇代替样品作为对照,于室温下避光静置30 min,于517 nm 处测定吸光度。
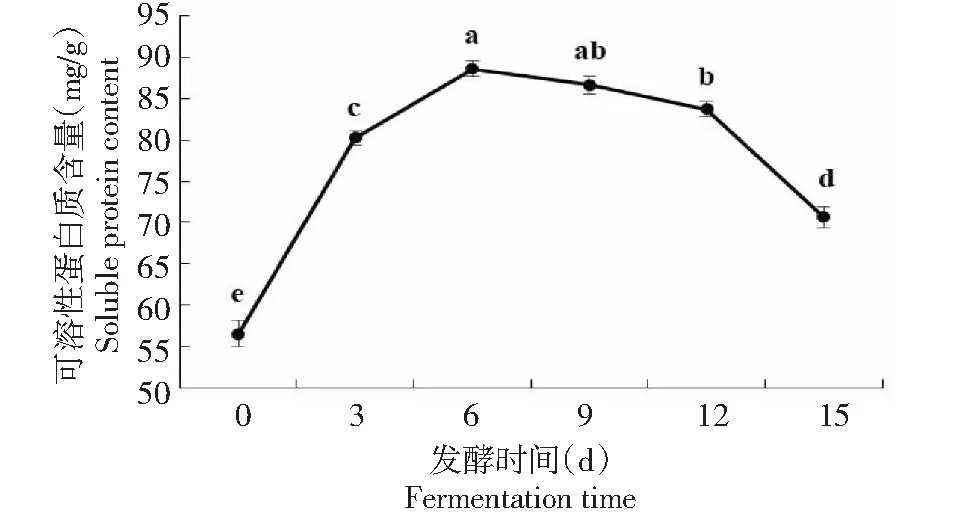
图中字母相同表示无统计学差异,下同The same letter in figure above indicated no statistical difference. The same as below图1 毛霉发酵辣木叶过程中可溶性蛋白质含量变化Fig.1 Changes of soluble protein content in the process of fermenting Moringa leaves by Mucor
DPPH自由基清除率(%)=[(A对照-A样品)/A对照]×100
式中,A样品为待测样品的吸光度;A对照为对照的吸光度。
1.5.2 ABTS·+自由基清除能力 参照孙丹等的方法[15]进行ABTS·+自由基清除能力的测定。将7 mM ABTS溶液和2.45 mM过硫酸钾等体积混合,室温避光放置12 h,生成ABTS·+母液。使用前将母液稀释,使其在734 nm处吸光度为0.70±0.02,即为ABTS·+工作液。将20 μl待测样品(以无水乙醇代替样品作为对照)加入2 mL ABTS·+工作液中,混匀后避光静置5 min,于734 nm处测定吸光度。ABTS·+自由基清除率计算公式同上述DPPH自由基清除率公式。
1.6 数据统计
通过SPSS 19.0软件对数据统计分析。对不同时间点的各组数据采用单因素方差分析 (One Way ANOVA) 方法进行统计分析,各组均值之间的两两比较采用Duncan多重比较法。
2 结果与分析
2.1 辣木叶毛霉固态发酵过程中主要营养成分的变化
2.1.1 不同发酵时间辣木叶中可溶性蛋白质的变化 由图1可知,在发酵过程中,辣木叶中的可溶性蛋白质含量呈现先升高后降低的趋势。经发酵的辣木叶中可溶性蛋白质含量均显著高于未发酵的(P<0.05)。发酵前辣木叶中可溶性蛋白质含量仅为56.5 mg/g;发酵6 d时,其含量达到最高(88.6 mg/g),之后逐渐降低,发酵15 d时,含量为70.6 mg/g。
2.1.2 不同发酵时间辣木叶中游离氨基酸总量的变化 由图2可知,在毛霉发酵过程中,辣木叶中的游离氨基酸总量持续增加。发酵前辣木叶中游离氨基酸总量仅为22.28 %,之后一直显著增加(P<0.05),发酵12 d时其含量增加到34.27 %,之后增加趋于平缓。

图2 毛霉发酵辣木叶过程中游离氨基酸总量的变化Fig.2 Changes of total free amino acids in the process of fermenting Moringa leaves by Mucor
2.1.3 不同发酵时间辣木叶中可溶性多糖含量的变化 由图3可知,在发酵过程中,辣木叶中可溶性多糖的含量总体呈现先增加后降低的趋势。在初始发酵的3 d内,辣木叶中的可溶性多糖含量无显著的变化;6 d时急剧上升至最高,为52.13 mg/g;之后逐渐降低,15 d时降至41.05 mg/g。
2.1.4 不同发酵时间辣木叶中多酚含量的变化 由图4可知,辣木叶中多酚含量丰富。经毛霉发酵后,可显著增加辣木叶中多酚的含量(P<0.05)。发酵9 d时,多酚含量为发酵前的2.83倍;12 d时略有下降,但无统计学差异;15 d时多酚含量为531.63 mg没食子酸当量/100 g,是发酵前的2.25倍。
2.2 辣木叶毛霉固态发酵过程中相关酶活力的变化
2.2.1 不同发酵时间辣木叶中蛋白酶活力的变化 蛋白酶能催化蛋白质和多肽水解。由图5可知,发酵前,辣木叶中蛋白酶活力为10.43 U/g,3 d后蛋白酶活力急剧上升至58.67 U/g;随后6和9 d时蛋白酶活力趋于稳定,未表现出显著性差异;12和15 d时该酶活力分别降低至28.23和24.63 U/g。

图4 毛霉发酵辣木叶过程多酚含量的变化Fig.4 Changes of polyphenol content in the process of fermenting Moringa leaves by Mucor

图5 毛霉发酵辣木叶过程中蛋白酶活力的变化Fig.5 Changes of protease activity in the process of fermenting Moringa leaves by Mucor
2.2.2 不同发酵时间辣木叶中纤维素酶活力的变化 纤维素酶能降解纤维素生成葡萄糖。由图6可知,毛霉发酵辣木叶过程中,纤维素酶活力呈现先上升后下降的趋势。发酵前,辣木叶中纤维素酶活力仅为5.24 U/g,发酵起始阶段其活力缓慢上升;发酵9 d时纤维素酶活力达到最高(155.49 U/g),是发酵前的29.67倍;12和15 d时该酶活力分别降至134.37和94.07 U/g。
2.2.3 不同发酵时间辣木叶中糖化酶活力的变化 由图7可知,发酵前,辣木叶中蛋白酶活力为11 U/g,3 d后蛋白酶活力急剧上升至40.15 U/g;随后糖化酶活力逐渐降低,发酵15 d时该酶活力与发酵前无统计学差异。

图6 毛霉发酵辣木叶过程中纤维素酶活力的变化Fig.6 Changes of cellulase activity in the process of fermenting Moringa leaves by Mucor

图7 毛霉发酵辣木叶过程中糖化酶活力的变化Fig.7 Changes of saccharifying enzyme activity in the process of fermenting Moringa leaves by Mucor

图8 毛霉发酵辣木叶过程中DPPH自由基清除能力的变化Fig.8 Changes of DPPH free radical scavenging ability in the process of fermenting Moringa leaves by Mucor
2.3 辣木叶毛霉固态发酵过程中抗氧化活性的变化
2.3.1 不同发酵时间辣木叶中DPPH自由基清除能力的变化 DPPH是一种常用于体外抗氧化活性评价的稳定的氮中心自由基。如图8所示,毛霉发酵辣木叶过程中,在前9 d,辣木叶的DPPH自由基清除活性随着发酵时间的延长显著增加(P<0.05),9 d时达到76.46 %,是发酵前的1.67倍。12和15 d时DPPH自由基清除能力略有下降,但与9 d时相比,无统计学差异。
2.3.2 不同发酵时间辣木叶中ABTS·+自由基清除能力的变化 本研究同时采用了ABTS·+自由基清除能力来评价辣木叶经毛霉发酵后的抗氧化活性。如图9所示,辣木叶发酵过程中ABTS·+自由基清除能力与上述DPPH自由基清除能力趋势相同,即辣木叶的ABTS·+自由基清除活性随着发酵时间的延长显著增加(P<0.05),9 d后增加趋于平缓。发酵结束时ABTS·+自由基清除能力是发酵前的1.9倍。
3 讨 论
3.1 毛霉发酵辣木叶过程中主要营养成分的变化
在毛霉发酵过程中,辣木叶中可溶性蛋白的含量呈现先升高后降低的趋势,而游离氨基酸总量则随发酵时间的延长而增加。此结果与管瑛等人[3]的研究结果一致,他们采用米根霉和少根根霉对豆渣进行发酵,也发现发酵过程中可溶性蛋白质呈现先增加后减少的趋势。分析原因主要是因为发酵菌株鲁氏毛霉产生蛋白酶,辣木叶中的蛋白质被蛋白酶逐渐分解成小分子蛋白质和多肽,增加了蛋白质的溶解性,所以可溶性蛋白质的含量会增加。随着发酵时间的延长,辣木叶中的蛋白质继续被降解成氨基酸,由于考马斯亮蓝法主要测定的是大分子的可溶性蛋白质,无法测定到其中的氨基酸,因此造成发酵后期可溶性蛋白质下降,而游离氨基酸总量随发酵时间的延长而增加。

图9 毛霉发酵辣木叶过程中ABTS·+自由基清除能力的变化Fig.9 Changes of ABTS·+ radical scavenging ability the process of fermenting Moringa leaves by Mucor
本研究中,辣木叶的可溶性多糖含量呈现先增加后降低的趋势。辣木叶中富含纤维素,毛霉发酵辣木过程中,毛霉产生了纤维素酶,可将辣木中非水溶性的碳水化合物纤维素分解为水溶性的多糖,从而使辣木叶中的多糖含量得到提高。有研究表明,用木霉和酵母菌发酵普洱茶,其多糖含量随发酵时间的延长而增加[16]。本研究中,发酵6 d后辣木叶中的多糖含量逐渐降低,这可能是由于毛霉继续生长,将多糖作为碳源消耗掉。
在发酵过程中,辣木叶中的多酚含量也呈现先增加后降低的趋势。这与唐仕荣等[17]对大蒜进行发酵加工的结果一致。多酚分为游离性多酚和结合态多酚,结合态多酚通常共价作用与细胞壁成分如纤维素、半纤维素、木质素、蛋白质等结合在一起。在本研究中,发酵前期,在纤维素酶、蛋白酶等酶的作用下,辣木叶中的结合态多酚被分解释放,导致发酵产物中多酚含量增加。发酵后期,可能由于多酚的氧化或被分解,导致发酵产物中多酚含量减少。
3.2 毛霉发酵辣木叶过程中相关酶的酶活变化
而毛霉在自然界中分布很广,能产生蛋白酶,具有分解大豆蛋白的能力,因此常用来制作腐乳、豆豉等。鲁氏毛霉还能产生丰富纤维素酶,具有很强的分解纤维素的能力。在本研究中,辣木叶中的蛋白酶、纤维素酶、糖化酶的活力在发酵过程中均呈现先升高后降低的趋势。这与豆渣发酵过程中这3种酶的酶活变化趋势一致[3]。原因可能是,辣木叶具有高蛋白、高纤维的特点;发酵前期,毛霉生长迅速,产生大量蛋白酶、纤维素酶和糖化酶以分解辣木叶中的蛋白质和纤维素;而发酵后期,随着底物的减少,相关酶的活力逐渐降低。
3.3 毛霉发酵辣木叶过程中抗氧化活性的变化
抗氧化是抗氧化自由基的简称。自由基对人体危害极大,它们可以在体内肆意掠夺其它物质的电子,使自己形成稳定的物质,从而破坏蛋白质、DNA、RNA等,使体内细胞、组织、器官功能降低,从而导致衰老、心血管疾病、肿瘤等各种疾病的发生[18]。因此,寻找外源性的自由基清除剂(即抗氧化剂)成为当前研究的热点。研究表明,一些植物成分或微生物发酵产物具有较强的清除体内自由基的作用及抗氧化作用[19-20]。
DPPH自由基是一种以氮为中心的稳定的自由基。通过对样品中DPPH自由基的清除能力的检测可以反映其抗氧化能力的强弱。ABTS,即2,2'-联氨-双 (3-乙基苯并噻唑啉-6-磺酸) 二胺盐,当氧化作用发生时会被氧化成绿色的ABTS+。样品中ABTS·+的产生被抑制则说明该样品具有抗氧化物存在。本研究通过DPPH、ABTS 2种自由基清除能力来评价辣木毛霉发酵物的抗氧化能力。本研究的结果表明,DPPH自由基清除能力和ABTS·+自由基清除能力均随发酵时间的延长而增加,但9 d之后增加趋于平缓。一些研究结果与本研究相似,韩雪等人[21]以植物乳杆菌发酵红枣浆,发酵后DPPH自由基清除能力增加了139.3 %。管瑛等人[3]利用米根霉、少孢根霉发酵豆渣,在发酵0~18 h内,随着发酵时间的延长,豆渣的ABTS·+清除活性显著上升,18 h后发酵豆渣的ABTS·+清除活性趋于稳定。毛霉发酵辣木叶的过程中,发酵产物的种类和含量不断发生变化,因此捕获自由基的能力即抗氧化能力也随之发生变化。
4 结 论
本研究以辣木叶粉为原料,以鲁氏毛霉为发酵菌株,进行辣木叶粉固态发酵。结果表明,毛霉发酵后辣木叶中可溶性蛋白、可溶性多糖、多酚的含量及蛋白酶、纤维素酶、糖化酶的活力均呈现先增加后减少的趋势。游离氨基酸总量、DPPH和ABTS·+清除能力均随发酵时间的延长显著增加,9 d后增加趋于平缓。本研究结果表明毛霉发酵辣木叶后提高了辣木叶的营养价值和抗氧化能力。本研究为利用辣木叶开发功能性食品或配料提供理论参考。

