东海鼠尾藻岩藻黄质含量的高效液相色谱法测定
高捷 沃联群 王银羽 李成平


[摘要] 目的 建立东海鼠尾藻岩藻黄质含量测定的高效液相色谱法。 方法 选用美国赛分Welch C18色谱柱(4.6 mm×250.0 mm,5 μm),进样量20 μL,流動相用乙酸乙酯和90%甲醇水溶液梯度洗脱,流速为1.0 mL/min,波长为450 nm,柱温:室温。 结果 方法的线性范围为2.7~43.2 μg/mL(r = 0.9997),检出限(3S/N)为0.027 μg/mL,定量限(10S/N)为0.086 μg/mL。回收率在99.6%~105.0%之间,RSD为1.78%(n = 9)。 结论 该方法简便灵敏,其结果准确可靠,可用于岩藻黄质的质量控制。
[关键词] 高效液相色谱法;岩藻黄质;鼠尾藻
[中图分类号] R917.101 [文献标识码] A [文章编号] 1673-7210(2019)07(a)-0039-04
High performance liquid chromatography determination of fucoxanthin content in Sargassum thunbergii of the East China Sea
GAO Jie1 WO Lianqun1 WANG Yinyu2 LI Chengping2,3
1.Zhejiang Pharmaceutical College, Zhejiang Province, Ningbo 315100, China; 2.College of Pharmaceutical Science, Zhejiang University of Technology, Zhejiang Province, Hangzhou 310032, China; 3.College of Biology and Environment Engineering, Zhejiang Shuren University, Zhejiang Province, Hangzhou 310015, China
[Abstract] Objective To establish an high performance liquid chromatography method for the determination of fucoxanthin content in Sargassum thunbergii of the East China Sea. Methods The samples (20 L) were separated on a Sepax Welch C18 column (4.6 mm×250.0 mm, 5 μm) with a gradient elution of ethyl acetate and 90% aqueous methanol at a flow rate of 1.0 mL/min and detected at 450 nm. The column temperature was kept at room temperature. Results A good linearity was obtained in the test range of 2.7-43.2 μg/mL (r = 0.9997). The limit of detection (3S/N) was 0.027 μg/mL and the limit of quantitation (10S/N) was 0.086 μg/mL. The average recoveries of fucoxanthin were between 99.6% and 105.0%, with a RSD of 1.78% (n = 9). Conclusion The method is simple, sensitive, accurate, and can be used for the quality control of fucoxanthin.
[Key words] High performance liquid chromatography; Fucoxanthin; Sargassum thunbergii
岩藻黄质化学名为3′-(乙酰氧基)-6′,7′-二脱氢-5,6-环氧-5,5′,6,6′,7,8-六氢-3,5′-二羟基-8-氧代-β,β-胡萝卜素,分子式:C42H58O6,研究表明岩藻黄质具有抗肿瘤、抗氧化、抗炎、降血糖、降血脂及减肥等多种生物活性[1-9]。岩藻黄质己成为当前海洋药物探索与开发的热点之一。
现国内与国外关于岩藻黄质的研究大多取材于海带、裙带菜和羊栖菜等[10-14],以鼠尾藻为材料提取岩藻黄质的研究最近才有报道[15-16]。海带、裙带菜等大型藻类生长速率慢,岩藻黄质含量低,需要较长时间和相对高的成本才能获得足够提取量。东海富生鼠尾藻[Sargassum thunbergii(Mert.)O′Kuntze],属于褐藻门、圆子纲、墨角藻目、马尾藻科、马尾藻属,富含岩藻黄质[15,17-18]。为了配合笔者所在团队进行的“东海鼠尾藻中岩藻黄质的提取工艺研究和抗更年期肥胖活性评价”项目研究,本试验参照文献[19-20]建立了东海鼠尾藻中岩藻黄质含量测定的高效液相色谱法。经方法学试验,该方法简便灵敏、可行,可用于本品的质量控制。
1 仪器与试药
高效液相色谱系统(P230Ⅱ高压恒流泵、UV230Ⅱ紫外-可见检测器、LU230Ⅱ低压梯度混合器,大连依利特分析仪器有限公司);快速溶剂萃取仪(Dionex ASE 200);旋转蒸发仪(RE-3000,上海亚荣生化仪器厂);电子天平(AB 204-N,瑞士梅特勒-托利多公司);高速离心机(Biofuge Primo R,上海科峻仪器公司)等。
甲醇(分析纯,天津四友);乙醇(分析纯,天津四友);甲醇(色谱纯,美国天地);乙醇(色谱纯,美国天地);乙酸乙酯(色谱纯,美国天地);鼠尾藻试验样品(产地:溫州);岩藻黄质对照品(BOC Sciences批号:20131010)。
2 方法与结果
2.1 色谱条件
色谱分离柱:C18柱(4.6 mm×250.0 mm,5 μm),美国赛分Welch;流动相A:水-甲醇(1∶9,V/V);流动相B:乙酸乙酯;线性梯度洗脱:B在20 min内由0增至100%;流速1.0 mL/min;柱温:室温;波长450 nm,进样量20 μL。在该色谱条件下,样品及对照色谱图见图1。
2.2 线性关系
精密称取岩藻黄质对照品10.8 mg,于10 mL容量瓶中,用无水乙醇超声溶解并定容至刻度,摇匀,得到浓度为1.08 mg/mL岩藻黄质对照品储备液,于4℃下避光低温贮存。
精密吸取一定量的对照品储备液并用流动相逐步稀释至2.7、5.4、10.8、21.6、43.2 μg/mL的对照品系列工作液,按“2.1”色谱条件,分别进样,以峰面积为纵坐标对溶液质量浓度进行线性回归,得回归方程为:A = 78.167C + 106.94,R = 0.9997。说明岩藻黄质在2.7~43.2 μg/mL浓度范围内与峰面积呈良好的线性关系。检出限(3S/N)为0.027 μg/mL,定量限(10S/N)为0.086 μg/mL。
2.3 精密度试验
精密吸取对照品溶液(10.8 μg/mL),按“2.1”色谱条件测定,重复进样5次,测定岩藻黄质峰面积,分别为954.47、965.13、945.30、952.54、957.73;计算得RSD为0.76%,表明仪器性能良好,该方法精密度较高。
2.4 重现性试验
精密称取同一批鼠尾藻6份,每份5 g,制成样品溶液,分别依次按“2.1”色谱条件测定。测得岩藻黄质的峰面积,得出鼠尾藻样品中岩藻黄质提取率分别为6.764、6.794、6.808、6.736、7.108、6.972 μg/g,计算得RSD为2.11%,表明该方法提取重现性良好。
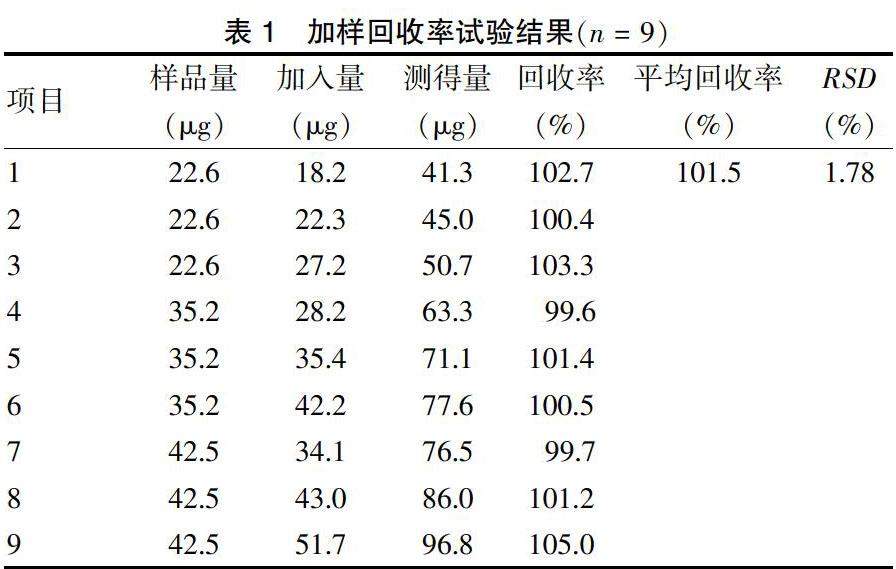
2.5 加样回收率
按“2.1”色谱条件,精密称取已测知含量的岩藻黄质样品共9份,各置于100 mL容量瓶中,加该样品量的80%、100%、120%的岩藻黄质对照品,用流动相溶解后稀释到刻度,进样20 μL,依法测定,分别记录色谱图。实验结果见表1。
2.6 样品含量测定
取一定量的鼠尾藻,洗净、干燥、粉碎后,过60目筛,放在-20℃冰箱里避光备用。精确称取一定量的鼠尾藻粉末置于烧杯中,加入95%乙醇,摇匀,封口,置于60℃的超声波清洗器中,超声提取30 min,取出,放置室温下冷却。将提取液过滤,在旋转蒸发仪中40℃的条件下旋蒸浓缩至10 mL。取样1 mL置于离心管中,在高速离心机中离心5 min,取上清液,过0.45 μm膜的滤液作样品溶液。另取岩藻黄质对照品,加流动相制成10.8 μg/mL的溶液作对照溶液,按“2.1”色谱条件,分别进样20 μL,按外标法计算岩藻黄质提取率为3.72 μg/g。
2.7 分离专属性
吸取43.2 μg/mL的岩藻黄质1 mL,共5份,分别经100℃加热3 h,0.1 mol/L酸或碱、3%过氧化氢60℃恒温处理2 h,阳光直射0.5 h。取样测定,记录色谱图。结果表明,岩藻黄质对酸、碱、氧化剂、高温及光照均不稳定,尤其酸呈现100%的破坏率。在“2.1”色谱条件下,岩藻黄质峰与酸、碱、高温、氧化及光照降解产物均能很好地分离(图2)。
3 讨论
3.1 液相色谱梯度洗脱的优点
在岩藻黄质提取工艺研究中,岩藻黄质含量测定较多采用分光光度法[12-14,16]。而海带等海藻类是自养生物,除了含有岩藻黄质之外,还具有维持光合作用所必需的叶绿素等。叶绿素在400~500 nm范围内有较强吸收。使用有机试剂萃取时,岩藻黄质将与叶绿素一并萃取出来。用分光光度法测定时,叶绿素对岩藻黄质的分析产生干扰[19]。
岩藻黄质含量测定的高效液相色谱法较多采用流动相等度洗脱[15,20],本研究根据参考文献[19]改进,对流动相所用的比例进行系列试验,结果表明加入乙酸乙酯,选用梯度洗脱,岩藻黄质的峰形得到较大改善,峰高变高,半峰宽减小,峰形较为对称,水-甲醇=10∶90时峰形为最佳。相对于参考文献[19]采用乙腈/水流动相更经济和环保。
3.2 不同条件对岩藻黄质的影响
本研究在对岩藻黄质的破坏性实验中发现,岩藻黄质其实很不稳定,非常容易分解,且对酸、碱、氧化剂、高温及光照均不稳定,其贮存条件对环境的要求很苛刻,在实验中要注意避光和低温操作。
实验表明,用高效液相色谱法对东海鼠尾藻中的岩藻黄质含量进行测定,快速、简便、灵敏,重现性好,可用于鼠尾藻中岩藻黄质含量的质量控制。
[参考文献]
[1] Heo SJ,Yoon WJ,Kim KN,et al. Evaluation of anti-inflammatory effect of fucoxanthin isolated from brown algae in lipopolysaccharide-stimulated RAW 264.7 macrophages [J]. Food Chem Toxicol,2010,48(8/9):2045-2051.
[2] Nazikussabah Z,Dan S,Lars OD. Inhibition of α-glucosidase activity by selected edible seaweeds and fucoxanthin [J]. Food Chem,2019,270(1):481-486.
[3] Fung A,Hamid N,Lu J. Fucoxanthin content and antioxidant properties of Undariapinnatifida [J]. Food Chem,2013, 136(2):1055-1062.
[4] Tanaka T,Shnimizu M,Moriwaki H. Cancer chemoprevention by carotenoids [J]. Molecules,2012,17(3):3202-3242.
[5] Bharathiraja K,Hari BL,Vijayaprakash S,et al. Fucoxanthin,a marine carotenoid protects cadmium-induced oxidative renal dysfunction in rats [J]. Biomed Prev Nutr,2013,3(3):201-207.
[6] Myoung NW,Seonm J,Young CS. Anti-obese property of fucoxanthin is partly mediated by alteringlipidregulating enzymes and uncoupling proteins of visceraladipose tissue in mice [J]. Mol Nutr Food Res,2009,53(12):1603-1611.
[7] 陳文佳,邵秀芝,赵祥忠,等.岩藻黄素的分离纯化及生物活性的研究进展[J].食品工业,2011(10):78-81.
[8] Kelman D,Posner EK,Rmid KJ,et al. Antioxidant activity of Hawaiian marine algae [J]. Mar Drugs,2012,10(2):403-416.
[9] Lixun H,Weimei C,Feng T,et al. Neuroprotective role of fucoxanthin against cerebral ischemic/reperfusion injury through activation of Nrf2/HO-1 signaling [J]. Biom Pharm,2018,106:1484-1489.
[10] Myond KR,Md SU,Byung SC. Extraction of Fucoxanthin and Polyphenol from Undariapinnatifida Using Supercritical Carbon Dioxide with Co-solvent [J]. Biotechnol Bioprocess Eng,2008,13(6):724-729.
[11] Billakanti JM,Catchpole OJ,Fenton TA,et al. Enzyme-assisted extraction of fucoxanthin and lipids containingpolyunsaturated fatty acids from Undariapinnatifidausingdimethyl ether and ethanol [J]. Process Biochemistry,2013,48(12):1999-2008.
[12] 尹宗美,王丹,石佳,等.羊栖菜藻渣中岩藻黄质制备技术及工艺优化[J].食品研究与开发,2017,38(15):134-138.
[13] 唐晨,陆未,齐晓玲.海带中岩藻黄素的提取及其活性研究[J].南通职业大学学报,2017,31(4):93-97.
[14] 李斌,吴永沛,刘翼翔,等.海带渣中岩藻黄素的酶法提取工艺研究[J].食品工业科技,2014,35(21):192-196.
[15] 王乐,李丽,牟海津.鼠尾藻岩藻黄素超声辅助提取及其纯化工艺优化[J].食品工业科技,2018,39(8):141-146.
[16] 李红艳,王璇璇,李晓,等.鼠尾藻中岩藻黄素的提取工艺研究[J].海洋科学,2018,42(2):72-77.
[17] 严小军,范晓,娄清香,等.海藻中类胡萝卜素的提取及含量测定[J].海洋科学集刊,2001(43):108-114.
[18] 李艳梅,刘清华.含岩藻黄素提取物的组合物[P].国际专利:WO2010081259,2010-7-22.
[19] 宫平,陈菲,惠伯棣.海带中岩藻黄质的C18-HPLC-PDA检测[J].食品工业科技,2012,33(1):342-343.
[20] 张怡评,谢全灵,洪专,等.昆布中岩藻黄质含量的HPLC测定[J].中国中医药科技,2013,20(4):374-375.

