宫颈癌术后调强放射治疗同步化学药物治疗骨髓抑制的相关因素探究
方敏捷 高艳 史亚滨 李子煌 周亚燕 杨东 闫茂生 李先明
[摘要] 目的 分析宫颈癌术后调强放射治疗(IMRT)同步化学药物治疗出现骨髓抑制的相关因素。 方法 方便选择该院2012年6月—2015年6月收治的接受IMRT同步化疗的110例宫颈癌患者,对其临床资料进行回顾性分析,对骨髓抑制的相关因素进行探究。 结果 单因素分析结果显示,3、4度骨髓抑制与盆腔骨髓平均剂量、V40、V50等因素密切相关(P<0.05);多因素分析结果发现,导致3、4度骨髓抑制的独立危险因素包括盆腔骨髓平均剂量、V40和V50。 结论 宫颈癌术后调强放射治疗同步化疗出现严重骨髓抑制的独立危险因素主要为盆腔骨髓平均剂量和骨髓剂量体积,对盆腔骨髓放疗照射的剂量和体积进行严格控制,能让骨髓抑制减少,保证治疗工作顺利完成。
[关键词] 宫颈癌;调强放射治疗;化学药物治疗;骨髓抑制
[中图分类号] R737.33 [文献标识码] A [文章编号] 1674-0742(2019)07(c)-0007-04
Study on the Related Factors of Postoperative Intensity-modulated Radiotherapy for Cervical Cancer in the Treatment of Myelosuppression
FANG Min-jie, GAO Yan, SHI Ya-bin, LI Zi-huang, ZHOU Ya-yan, YANG Dong, YAN Mao-sheng, LI Xian-ming
The First Affiliated Hospital of South University of Science and Technology/Jinan University Second Clinical Medical College/Department of Tumor Radiotherapy, Shenzhen People's Hospital,Shenzhen, Guangdong Province,518020 China
[Abstract] Objective To analyze the factors related to myelosuppression in patients with cervical cancer after intensity-modulated radiation therapy (IMRT). Methods A total of 110 patients with cervical cancer who underwent IMRT synchronized chemotherapy from June 2012 to June 2015 were convenient selected and retrospectively analyzed. The relevant factors of myelosuppression were explored. Results The results of univariate analysis showed that 3, 4 degree myelosuppression was closely related to the average dose of pelvic bone marrow, V40, V50 and other factors (P<0.05). Multivariate analysis found that independent risk factors leading to 3 and 4 degrees of myelosuppression included average dose of pelvic bone marrow, V40 and V50. Conclusion The independent risk factors for severe myelosuppression in patients with cervical cancer after intensity-modulated radiation therapy are mainly pelvic bone marrow mean dose and bone marrow dose volume. The dose and volume of pelvic bone marrow radiotherapy irradiation are strictly controlled, which can reduce bone marrow suppression and ensure the treatment successfully completed.
[Key words] Cervical cancer; Intensity-modulated radiation therapy; Chemical drug therapy; Myelosuppression
宮颈癌作为临床中发生率较高的一种女性恶性肿瘤,其发病率仅比乳腺癌低。临床研究发现,通过同步放化疗能让宫颈癌的远处转移率和局部复发率显著降低,让患者的生存率显著提高[1]。同步化疗的效果虽然比较理想,但是其不良反应发生率也较高,而最显著的不良反应则为骨髓抑制[2]。3~4度骨髓抑制可能终止或者中断放疗,进而对疗效造成影响。与常规放疗同步化疗相比较,调强放疗的不良反应发生率虽然更低,然而依然需要加以重视,最显著的则为骨髓抑制[3]。该研究方便选取该院于2012年6月—2015年6月收治的IMRT同步化疗患者110例主要分析了宫颈癌术后调强放射治疗(IMRT)同步化学药物治疗出现骨髓抑制的相关因素,希望能为骨髓抑制的防治提供指导。现报道如下。
1 资料与方法
1.1 一般资料
方便选择该院收治的接受IMRT同步化疗的110例宫颈癌患者,患者年龄27~72岁,平均年龄为(50.6±3.7)岁;经病理学检查确诊为鳞癌;FIGO分期:Ⅰ期 83 例,Ⅱ期 27例。
纳入标准:①所有患者均行宫颈癌根治术,术中无肉眼残存,术后病理确诊为宫颈癌;②肾功能和肝功能无异常;血小板≥80×109/L,中性粒细胞计数≥1.5×109/L,白细胞计数≥3.5×109/L;③体力状况(ECOG 评分)为0~2 分;④具有有下列不良预后因素之一:宫颈局部肿瘤体积巨大(≥4 mm)、宫旁浸润、切缘阳性、淋巴结转移、脉管瘤栓、宫颈深肌层浸润深度≥外1/3等;⑤于确诊8周内行调强放疗辅助治疗;⑥术前未行新辅助化疗;⑦患者知情同意,均签署《知情同意书》。
排除标准:①严重实质性脏器功能不全;②有腹主动脉转移;③凝血功能障碍;④放疗禁忌证患者。
1.2 方法
①放疗:调强放疗。放疗前均行常规检查,明确盆腔手术情况及是否存在远处转移。利用CT技术进行模拟定位,定位前嘱患者饮用800 mL水充盈膀胱,口服20 mL 60%复方泛影葡胺造影剂显影小肠。患者取仰卧位,伸直下肢,双手互握肘关节并上举至头顶,伸直双腿,用真空袋进行固定。再通过静脉注射造影剂,CT模拟机自第二腰椎向下至闭孔下缘5 cm处对盆腔进行CT定位扫描,层厚为5 mm,将采集的图像上传至放疗计划工作站。逐层勾画临床靶区CTV(髂总、髂内外、闭孔、髂前淋巴结引流区及阴道上1/3及残端、宫旁组织)及危及器官(膀胱、直肠、小肠、股骨头、骨质边缘)。计划靶区PTV在临床靶区三维方向边缘外放6 mm,参照RTOG勾画指南对危及器官进行勾画。危及器官限量标准:小肠:V50<5% Dmax≤50 Gy ,直肠:V50<40%,膀胱V50<40%。对腰骶骨、坐骨、耻骨、髂骨、双侧股骨头、近端股骨进行勾画,并限量为V10<90%。所有放疗利用直线加速器对靶区进行照射,6MV加速器X线,选用调强放疗方式,处方剂量95%PTV 45~50 GY/25~27次,1次/d,5次/周。治疗完成后由上级医师评估危及器官剂量容积、剂量分布情况。
②同步化疗:选择洛铂及顺铂3周方案;洛铂(国药准字H20080359)3周方案为:于放疗开始后第1天静脉滴注洛铂,30 mg/m2,3周为1个疗程。顺铂(国药准字H20040813)3周方案为:于放疗开始后第1、2、3天静脉滴注顺铂,80 mg/m2,分3 d滴完;3周为1个疗程。
1.3 临床观察指标
选择常见不良反应事件(CTCAE)3.0版该评价标准来对骨髓抑制进行判断[4]。
1.4 统计方法
选择SPSS 21.0统计学软件来统计和分析该实验相关数据,计量资料采用(x±s)表示,行t检验,计数资料采用[n(%)]表示,行χ2检验,选择Logistic回归分析开展多因素分析,P<0.05为差异有统计学意义。
2 结果
2.1 单因素分析
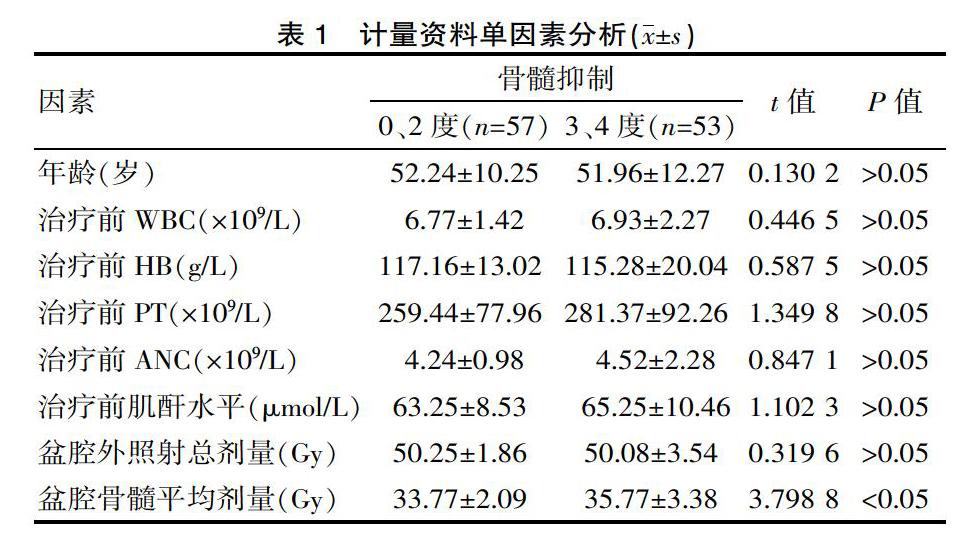
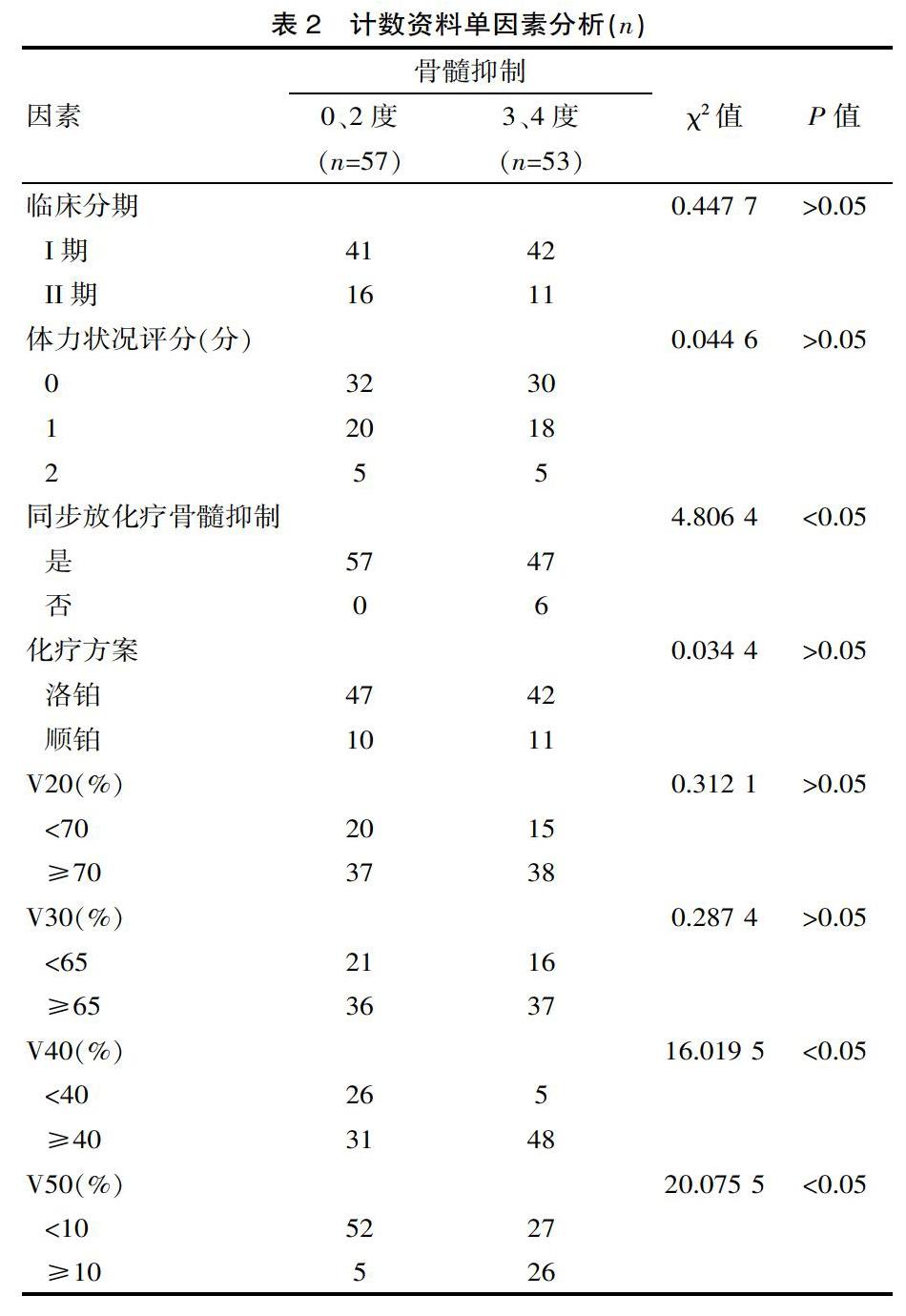
全部110例患者中,99例发生骨髓抑制,发生率为90.0%(99/110);其中53例为3、4度骨髓抑制。单因素分析结果显示,盆腔骨髓平均剂量与骨髓抑制的发生密切相关(P<0.05),调强放疗盆腔外照射总量、治疗前肌酐水平、同步放化疗前白细胞计数(WBC)、血小板(PT)、血红蛋白(HB)、中性粒细胞水平(ANC)与骨髓抑制的发生无相关性(P>0.05),见表1。同步放化疗前是否发生骨髓抑制、V40、V50与骨髓抑制的发生密切相关(P<0.05),V30、化療周期、化疗方案、体力状况评分、临床分期与骨髓抑制的发生无相关性(P>0.05),见表2。
2.2 多因素分析
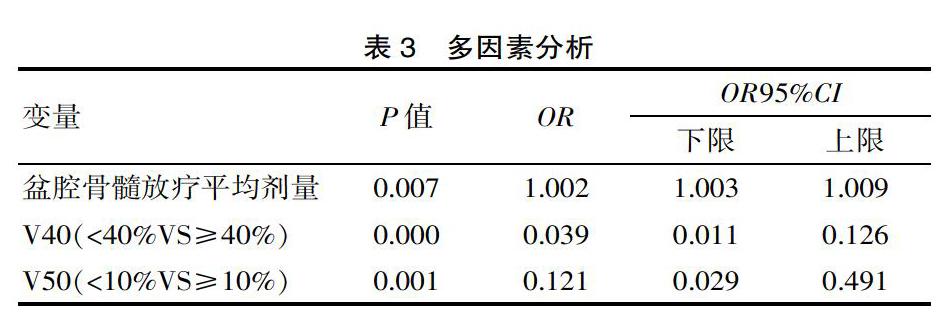
多因素分析结果发现,导致3、4度骨髓抑制的独立危险因素包括盆腔骨髓平均剂量、V40和V50,见表3。
3 讨论
宫颈癌患者在接受放射治疗时,盆腔放疗会在一定程度上影响骨髓造血功能,进而导致一些毒副反应,在开展同步放化疗时,因为同步进行化学药物治疗,所以对骨髓造血功能的影响更加显著[5]。对该研究结果进行分析可知,全部110例患者中,99例发生骨髓抑制,发生率为90.0%(99/110);其中53例为3、4度骨髓抑制。因为在顺铂剂量方面存在差异,所以该研究结果与临床相关研究报道的3、4度骨髓抑制发生率不同[6]。该研究选择的化疗方案洛铂及顺铂3周方案,而在3、4度骨髓抑制发生率方面,两者比较差异无统计学意义(P>0.05);出现这种情况可能时因为选择顺铂3周方案的人数较少。
成年人群中,存在造血活性的骨髓大约有一半处于脊柱下段和骨盆。化学药物治疗和放射治疗均会引起骨髓抑制[7]。如果患者仅采用盆腔放疗,其他部位的骨髓通过代偿而增加造血功能,因此不容易出现重度骨髓抑制[8-10]。同步化疗则会出现额外骨髓损伤,进而让患者发生较为显著的骨髓抑制。骨髓接受剂量如果为30~50 Gy,所需恢复时间则较长,骨髓损伤有时为不可逆[11-13]。采用铂类化疗和高剂量放疗,会在较短时间内发生急性骨髓抑制,部分患者可能需要几个月才能让骨髓造血功能恢复正常,甚至不能恢复,进而引起骨髓损伤,中断放疗,对治疗效果造成影响[14]。在对宫颈癌进行治疗时,与常规放疗相比较,IMRT能让骨髓接受到的高剂量辐射量减少[15]。选择IMRT技术能让骨髓损伤有效减轻,让同步化疗耐受性提高,让远处转移的发生风险降低[16]。所以在治疗宫颈癌患者时,让骨髓照射量减少具有非常重要的作用。
IMRT作为一种精确放射治疗,可以在降低周围正常组织受照剂量的同时,让靶区剂量增加,进而让治疗增益比提高[17]。患者在采用IMRT同步化疗时,盆腔骨髓接受V10,V20与血液学毒性密切相关。有临床研究发现,宫颈癌患者在接受IMRT同步放化疗时,骨髓平均剂量、接受剂量>40 Gy的骨髓体积与血液学毒性密切相关[18]。对该研究的盆腔骨髓剂量学参数进行分析可知,3、4度骨髓抑制的发生风险会随盆腔骨髓放疗平均剂量的增加而逐渐提高。对于接受同步放化疗的宫颈癌患者来讲,V40<40%、V50<10%为3、4度骨髓抑制的保护性界限,能让3、4度骨髓抑制显著减少。
对于接受同步放化疗的宫颈癌患者来讲,应通过有效的措施来对骨髓抑制进行防治:首先应对患者进行严格挑选,避免过度治疗;治疗前则应认真评估患者的骨髓功能。其次应科学选择化疗剂量和化疗方案,并对患者的肾功能进行严密监测,对药物肾毒性加以关注。最后则应对放疗计划进行优化,对骨髓剂量进行严格限制;同步放化疗时应对血象变化进行密切观察[19]。
综上所述,宫颈癌术后调强放射治疗同步化疗出现严重骨髓抑制的独立危险因素主要为盆腔骨髓平均剂量和骨髓剂量体积,对盆腔骨髓放疗照射的剂量和体积进行严格控制,能让骨髓抑制减少,保证治疗工作顺利完成。
[参考文献]
[1] 温列东,黄维,伍万春,等.宫颈癌骨髓限量调强放疗对急性骨髓抑制的影响[J].中国医学物理学杂志,2018,35(4):399-403.
[2] 谭燕,张菊.宫颈癌同步放化疗中骨髓抑制的防治进展[J].肿瘤学杂志,2018,24(1):62-66.
[3] 崔彦莉,王晓贞.宫颈癌调强放疗不良反应物理性影响因素分析[J].河北医科大学学报,2017,38(11):1340-1344.
[4] 李松,王运贤.宫颈癌化疗后骨髓抑制与免疫水平和生存质量的相关性研究[J].中國地方病防治杂志,2017,32(9):1048-1049.
[5] 唐滟,袁亚维,彭培清,等.调强放疗同步两种方案化疗治疗宫颈癌近期疗效及不良反应对比分析[J].现代肿瘤医学,2016,24(22):3611-3615.
[6] 吴建华,梁国华,凌志琴,等.同步放化疗致中晚期宫颈癌患者骨髓抑制发生的危险因素分析[J].实用癌症杂志,2016, 31(5):817-819.
[7] Johan Blakkisrud,Ayca Lndalen,Jostein Dahle,et al.Myelosup pression in non–hodgkin lymphoma patients treated with 177 Lu-lilotomab satetraxetan can be predicted by a model with red marrow absorbed dose as the only parameter[J]. Physica Medica,2018(52).
[8] 朱安娜,关明飞,马银萍,等.TP和FP方案在Ⅰ_(b1)-Ⅱ_(a2) 期宫颈癌术后化疗中毒性反应的对比研究[J].现代肿瘤医学,2016,24(12):1962-1965.
[9] 张旭,高嵩,韩铮波,等.宫颈癌全盆腔放疗3种外照射技术对骨髓抑制的影响[J].中国医学物理学杂志,2016,33(1):59-62.
[10] 唐滟,袁亚维.宫颈癌调强放射治疗同步化学药物治疗疗效及毒副反应分析[J].中国现代医学杂志,2015,25(36):68-72.
[11] Jiahong Han,Jing Xia,Lianxue Zhang,et al.Effects and mechanisms of ginsenoside re and its secondary metabolite ginsenoside rk 3 on myelosuppression[J]. Journal of Ginseng Research,2018.
[12] 黄维,李英,鲁文力,等.宫颈癌同步放化疗时患者临床因素及骨盆剂量体积参数与急性期骨髓抑制的关系[J].第三军医大学学报,2016,38(5):506-510.
[13] 权丽丽.紫杉醇联合顺铂辅助治疗中晚期宫颈癌近期疗效与安全性的Meta分析[J].中国药房,2015,26(24):3389-3392.
[14] 李岚,张凯恋,张芬,等.调强放疗同期顺铂治疗中晚期宫颈癌临床疗效和毒副反应观察[J].临床医药实践,2015,24(8):563-566.
[15] 肖锋,李云海,王洪林,等.宫颈癌术后保护骨髓的调强放疗剂量学研究[J].中国癌症杂志,2013,23(3):200-206.
[16] Ying Le,Huiqun Li,Chengyao Wan,Yuan Long,et al. Rhabd omyolysis during myelosuppression in a patient with central nervous system leukemia: A case report[J]. Medicine,2018, 97(45)e13091.
[17] 任俊丽,范立,李莉莉.宫颈癌调强适形放射治疗与常规放射治疗的临床疗效分析[J].中国医疗前沿,2012,7(7):12-13,38.
[18] 马建萍,赵仁,何剑莉,等.106例宫颈癌放疗所致放射性损伤的临床分析[J].宁夏医学杂志,2012,34(3):260-261.
[19] ZHU Ying-Li,WANG Lin-Yuan,WANG Jing-Xia,et al.Protective effects of paeoniflorin and albiflorin on chemotherapy-induced myelosuppression in mice[J].Chinese Journal of Natural Medicines,2016,14(8):599-606.
(收稿日期:2019-04-22)

