基于EST-SSR标记的茅苍术种质资源遗传多样性分析
韩 凤,刘春雷,罗 川,刘 杰,胡开治,肖 忠,林茂祥*
(1.重庆市药物种植研究所,重庆市 南川区 408435;2.重庆市中药良种选育与评价工程技术中心,重庆市 南川区 408435)
茅苍术[Atractylodeslancea(Thunb.)DC.]为菊科多年生草本植物,以干燥根茎入药,具有悠久的药用历史,为传统大宗药材之一,具有祛风散寒、燥湿健脾、明目等作用[1]。主产于江苏、浙江、山东、江西、广东、安徽、湖北、四川等地区[2-3]。随着茅苍术种植范围不断扩大,经过长期的互相引种、交流,大田中茅苍术表现出栽培类型多样性。从形态可以看出,同一居群内植株分支的有无、叶片宽窄、分裂程度以及叶柄有无,甚至同一植株的叶片有无分裂,都难以作为区分变异类型、品系、变种、或者种的标准。由此造成类型的混杂、退化严重,也导致产量和质量参差不齐,这些都为茅苍术的育种带来了很大困难。
目前,RAPD、ISSR、叶绿体DNA等[4-9]分子标记应用于苍术植物研究已有报道,这些研究为揭示苍术属间亲缘关系及科学分类提供了非常有价值的参考,但它们的研究对象主要是不同产地、不同居群的茅苍术,至今尚未有专门针对引种栽培后茅苍术的遗传多样性研究的报道。EST-SSR 作为一种新型分子标记技术,其多态性可能与基因功能直接相关,而且具有良好通用性。与AFLP、RAPD和ISSR等传统分子标记技术相比,具有重复性好、多态性高、共显性、多等位性等优势[10],使得 EST-SSR 标记在实际应用中更具价值[11]。遗传多样性是生物多样性的基础和重要组成部分,EST-SSR 标记为物种遗传多样性的分析研究提供一条更有效的途径。利用EST-SSR标记在遗传图谱构建[12]、亲缘关系和遗传多样性[13,14]、引物通用性及辅助选种育种等[15-17]方面的应用已取得显著进展。植物在长期演化、适应环境中,形态上出现各种各样的性状,较多反映在叶片的结构上[18],叶片形态学研究是种质资源表型变异研究的重点,已被应用在植物种质资源研究中[19-21]。鉴于此,为了进一步了解茅苍术种内遗传变异状况,了解不同叶形茅苍术的遗传差异,笔者在重庆酉阳茅苍术主产区选取大田栽培中不同叶形47份茅苍术样品作为供试材料,采用EST-SSR分子标记技术研究其遗传多样性,旨在为茅苍术种内类型的界定提供更多的实验基础,也为茅苍术新品种的培育和种质资源开发利用提供理论依据。
1 材料与方法
1.1 材料
供试茅苍术引种自湖北英山的人工栽培种,将其根茎作为种茎栽培于重庆市酉阳茅苍术试验基地中。同一生长期采集植株茎干距离地面15 cm的叶片(裂叶不采集),叶形根据叶片长宽比、叶片质地等划分为5类(见图1),分别为长椭圆形(A)、披针形(B)、卵圆形(C)、椭圆形(D)、倒卵形(E),样株间距离不小于20 m,分别采集每一样株的新鲜幼嫩叶片,用硅胶快速干燥后常温密封保存、待用。样品采集信息见表1。

图1 叶片类型Fig.1 Leaves type

表1 供试茅苍术材料Table 1 A. lancea accessions used in this study
1.2 方法
1.2.1 茅苍术样品总DNA的提取与检测
每份茅苍术样品取0.1 g嫩叶,用植物基因组DNA试剂盒(Tiangen)提取总DNA,溶于200 μL灭菌超纯水中,-20℃保存、备用。再用0.8%琼脂糖凝胶电泳检测DNA的完整性,用岛津紫外分光光度计(UV-1800)检测DNA的纯度和浓度,将DNA用TE稀释至终浓度为50 ng·μl-1,放入-20℃冰箱保存。
1.2.2 引物筛选及SSR- PCR扩增
实验所用引物来自Shakeel A[22]基于苍术转录组测序所开发的SSR引物,随机挑选30对引物,由上海生工公司合成。DL2000 DNA Marker、核酸染料、琼脂糖(上海生工公司),2×Taq PCR Master Mi×、d NTP、Taq DNA 聚合酶(北京赛百盛有限公司),其余试剂均为分析纯。 PCR 扩增反应体系(25 μL):模板DNA 1.0 μL(约50 ng·μl-1),1.0 μL引物(10 μmol·L-1),2.5 μL PCR缓冲液(10×),Mg2+2 μL(25 mmol·L-1),d NTPs 2 μL(2.5 mmol·L-1),Taq DNA 聚合酶1.0U。SSR-PCR 反应在梯度 PCR仪(BIO-RAD,美国)上进行。PCR反应扩增程序为:预变性94℃ 5 min,变性94℃ 45 s ,退火温度58.5℃ 45 s,延伸72℃ 45 s,共35个循环;最终延伸72℃ 8 min;4℃保存,采用8%变性聚丙烯酰胺凝胶电泳分离扩增产物,PCR 扩增产物拍照保存。
1.2.3 数据处理
假设电泳图谱中每一个条带均代表了SSR 引物与茅苍术模板 DNA 互补结合的位点,同一引物在相同迁移率位置谱带模糊或缺失的记为“0”,清晰可辨的记为“1”。统计所有 EST-SSR 引物扩增的结果,建立“0”、 “1”原始矩阵。用 NT-SY2.10 软件计算47份样品间的遗传距离(GS),按非加权配对算术平均法(UPGMA)对47份样品进行聚类分析。多态信息含量PIC值利用Botstein等[23]提供的方法。
2 结果与分析
2.1 EST-SSR引物扩增多态性分析
从30对引物中筛选出5对EST-SSR 引物对47份供试材料的总DNA进行扩增,共扩增出36条重复性好、扩增谱带清晰的条带,其中多态性的条带36条,占100%(见表2);其中引物MPC08的扩增结果见图2。每条引物扩增出的条带数目从4至9不等,平均为7.2条,扩增条带片段大小分布在70~270 bp。PIC值用于反应引物区分样品的能力,与基因型数目和出现频率有关,PIC越高,物种遗传差异越大,遗传多样性越高,同时也就证明此物种的遗传背景越复杂[24]。当PIC>0.5时,该基因座为高度多态性[23],本研究中,不同引物的PIC值变幅为0.6760~0.7877,平均为0.7539;其中MPC04的PIC值最高达0.7877,MPC22最低为0.6760,说明所筛5对引物多态性较高,不同叶形茅苍术具有较高的遗传多态性。茅苍术经引种栽培后,叶片形状变异反映了它对生态环境的适应,这种变异也具有一定的遗传基础,是外部形态上的一种表现形式。所以,茅苍术种内丰富的遗传多样性既与遗传因素有关,也与生态环境改变的影响密不可分,即是遗传基因和环境共同作用的结果。

表2 分析所用的EST-SSR引物及扩增结果Table 2 EST-SSR primers used in this study and the amplified results
2.2 遗传多样性与聚类分析
用NTSYS-pc2.10e分析软件计算的Jaccard遗传距离,47个茅苍术遗传距离系数在0~0.9123之间,其中,C2与B3的遗传距离系数最大为1.01,表明两者之间的遗传相似度最小;D10、D5、D9之间和B3、C7、B1之间的遗传距离系数均为0。47份供试材料的聚类分析结果显示(图3),当遗传相似系数为 0.630 时,所有供试样品被聚为一类;相似系数为0.666时,89.36%的供试样品可聚为一类;在遗传相似系数0.700处可以将所有供试材料分为5类。根据聚类结果,对不同叶形进行了亲缘关系的系谱追溯,81.25%的D型叶和所有的E型叶均归为一类,50%C型和70%B型样品为一个大类,D7、A1、C2聚为一类,B7单独聚为一类,5个A型叶在4个分支分支中皆有分布。EST-SSR聚类结果较好反映供试材料的亲缘关系及不同叶形茅苍术的遗传距离,但并不是相同或者相近特征的茅苍术样品就聚为一类,说明茅苍术的形态特征和分子表达并不一致,也表明茅苍术的叶形性状与遗传背景不具有明显的相关性。这可能是因为形态标记和分子标记属于不同性质的位点,且两种标记方法存在一定的局限性,不可能全面反映种质资源的形态和遗传特性。因此,实验中叶形分类与分子标记聚类结果并不完全一致,但却真实地反映了茅苍术种质资源的形态与遗传特性。

图2 引物MPC08的扩增结果Fig.2 DNA fragments amplified by EST-SSR primer MPC08
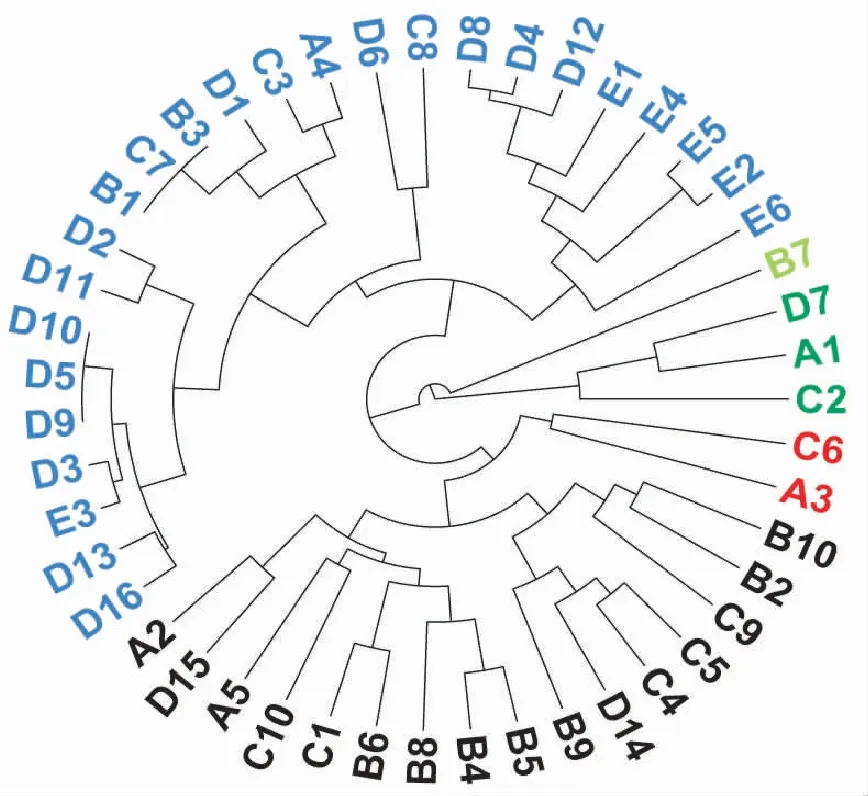
图3 基于EST-SSR标记的47份茅苍术聚类图Fig.3 Dendrogram of Atractylodeslancea by EST-SSR analysis
3 结论与讨论
植物种间存在变异,种内的变异也较大,而种内的变异不可忽视[25]。本研究茅苍术样品栽培和田间管理条件一致,但植株的表型性状在种内变异类型之间仍存在较大的差异,主要表现在叶片形态变化,如叶片大小、是否分裂、厚薄、颜色、叶缘锯齿,有无叶柄,植株高矮不一、有无分枝等外部形态特征的差异,这为茅苍术新品种培育和改良提供了丰富的原始材料。不同叶形茅苍术具有丰富多样性,个体间(A1和D6)遗传变异较大,可能是所选择的代表茅苍术植株有限,仅限于酉阳黑水镇茅苍术种植基地,给出较为肯定的结论尚需进一步研究。同时,叶片是植物生长发育的重要器官,很多生理生化反应在叶片中完成,叶片的形态指标大部分属于数量性状的变异,也受多基因互作的影响[26]。对于茅苍术不同叶形性状差异受哪些基因决定和调控的需在今后工作中进一步深入研究。
遗传多样性最直接的表现形式是遗传变异水平的高低[27]。实验结果表明,不同叶形茅苍术在DNA水平上表现遗传距离较大,多态性百分率为100%、多态性信息含量平均为0.7539,表明茅苍术具有丰富的遗传多样性。这一研究结果与前人的研究结果基本一致,许梦云等[5]用ISSR分析验证得到茅苍术较高的多态性,说明茅苍术的变异水平亦较高;朱晓琴等[28]通过对4个居群的等位酶分析,发现苍术居群内遗传变异大于居群间;桑小花等[29]、黄驰等[30]的研究表明茅苍术在生理形态和同工酶表现为多态性。可能由于茅苍术为虫媒花植物,以异花授粉为主,自交不亲和,以及成片连续分布的特点,使基因较易流动;生产中茅苍术既可有性繁殖,又能无性繁殖,从而造成种内丰富的变异,为茅苍术的多样性表现提供了理论基础。由于茅苍术在长期适应环境的过程中,不断发生遗传变化,这种变化是茅苍术内在遗传与生态环境相互作用的结果。该研究采用EST-SSR 标记进行茅苍术遗传多样性分析,进一步丰富了茅苍术 DNA 遗传标记方法,对于深入了解茅苍术种内遗传关系以及辅助育种等提供参考和依据。

