胡杨杂种叶片组培技术研究
马 艳,王静飞,刘 婷,沈泰景
(金陵科技学院 园艺园林学院,江苏 南京 210038)
胡杨(Populuseuphratica)为杨柳科胡杨属落叶乔木,具有喜光、喜温暖、耐寒冷、抗干旱、耐盐碱及抗风等特性。胡杨对维护沙漠地区绿色生态及促进当地经济和社会发展起着重要作用。胡杨主要以种子繁殖和根蘖繁殖为主,人工扦插生根困难或不能够生根[1],嫁接繁殖数量较为有限,且质量不稳定[2],这严重制约了胡杨优质人工林发展。胡杨杂种(胡杨与密叶杨(P.talassicaKom.)杂种F1代)具有耐水湿、抗盐碱、耐瘠薄、抗寒、抗旱、秋季叶色呈现出金黄色,同时又具有优良的材质材性、生长快速及干型通直的特性。
近年来杨树组织培养的研究得以迅速发展,杨树组培技术也日趋成熟。Cheema利用40年生的缘毛杨(P.ciliateWall.)大树上幼嫩叶片,诱导的愈伤组织通过悬浮培养得到了再生植株[3]。杨树再生体系以叶片、叶柄、茎段、花药等器官和组织进行愈伤组织诱导,所获得的再生苗具有基因背景一致、苗龄及生长势统一、扩繁迅速简便以及方便进行基因转化等优点[4-5]。为了弥补传统育种手段的不足,利用分子生物学手段创建的杨树组织培养及再生体系为杨树种质资源的保存、繁殖及遗传改良提供了便利条件[6]。
目前,利用胡杨杂种叶片建立再生体系的研究未见报道,本研究以胡杨杂种叶片为外植体,利用植物组织培养的方法,通过叶片诱导愈伤组织、愈伤组织诱导不定芽、不定芽诱导不定根,从而建立胡杨杂种叶片组培技术体系,为后续胡杨遗传转化研究奠定基础。
1 材料与方法
1.1 试验材料
选取生长健壮,无病虫害的胡杨杂种幼嫩叶片作为组培外植体。所选试验材料取自胡杨杂种F1代幼苗。
1.2 研究方法
1.2.1 外植体的脱菌
将胡杨杂种幼嫩叶片,表面去污后用流水冲洗30 min,置于超净工作台后,放入装有75%酒精的培养皿中消毒30 s,取出叶片后再将其放入装有0.1%HgCl2的培养皿中进行脱菌,脱菌后用无菌水清洗3遍。脱菌时间设置6个梯度,依次为3、4、5、6、7和8 min。
1.2.2 叶片诱导愈伤组织
将脱菌后的叶片去除叶缘,以主叶脉为中心将其切成0.5×0.5 cm2大小的叶盘,叶盘正面朝上,放置在WPM基本培养基内,培养基里面分别加入以下6种不同浓度及配比的生长调节因子:(1)0.1 mg·L-16-BA+0.1 mg·L-1NAA;(2)0.2 mg·L-16-BA+0.2 mg·L-1NAA;(3)0.3 mg·L-16-BA+0.3 mg·L-1NAA;(4)0.5 mg·L-16-BA+0.4 mg·L-1NAA;(5)0.4 mg·L-16-BA+0.4 mg·L-1NAA;(6)0.5 mg·L-16-BA+0.5 mg·L-1NAA。每种处理下接种20瓶,每瓶放有4个外植体。接种后每5 d观察一次,记录愈伤生长状态,30 d后统计愈伤组织诱导率。
1.2.3 愈伤组织诱导不定芽
将呈现出嫩绿色且质地紧实的愈伤组织切成1-1.5 cm的小团块,放入WPM培养基中,培养基设有6种不同浓度及配比的生长调节因子:(1)0.5 mg·L-16-BA+0.05 mg·L-1NAA;(2)0.5 mg·L-16-BA+0.1 mg·L-1NAA;(3)0.5 mg·L-16-BA+0.2 mg·L-1NAA;(4)0.5 mg·L-16-BA+0.3 mg·L-1NAA;(5)0.5 mg·L-16-BA+0.4 mg·L-1NAA;(6)0.5 mg·L-16-BA+0.5 mg·L-1NAA。同一处理接种20瓶,每瓶放置4个外植体。接种后每5 d观察不定芽生长情况,20 d后统计不定芽诱导率及不定芽的平均长度。
1.2.4 不定芽诱导不定根
选取生长健壮,长度1.5-2.0 cm的不定芽,将其接种到生根培养基中,以1/2WPM为基本培养基,培养基设有6种不同浓度及配比的生长调节因子:(1)1.0 mg·L-1IBA+0.02 mg·L-1NAA+0.2 mg·L-1GA3;(2)1.0 mg·L-1IBA+0.04 mg·L-1NAA+0.2 mg·L-1GA3;(3)1.0 mg·L-1IBA+0.06 mg·L-1NAA+0.2 mg·L-1GA3;(4)2.0 mg·L-1IBA+0.02 mg·L-1NAA+0.2 mg·L-1GA3;(5)2.0 mg·L-1IBA+0.04 mg·L-1NAA+0.2 mg·L-1GA3;(6)2.0 mg·L-1IBA+0.06 mg·L-1NAA+0.2 mg·L-1GA3。每种处理下接种20瓶,每瓶放有4个不定芽,每5 d观察不定根生长情况,20 d后统计不定根诱导率,根数和根长。
1.2.5 培养条件
本研究参照王蒂主编的《植物组织培养》教材,将培养室的温度设定为26±2℃,光照强度为2000-3000 lx,光照时间为12 h/d,湿度控制在60%[7]。
1.2.6 炼苗和育苗
生根培养30 d后选取根系发达的胡杨杂种组培苗,洗净根部培养基,将其移栽到花盆营养基质中,供试基质按照草炭土:珍珠岩为3:1的比例加入,温室温度控制在20-28℃条件下,光照强度约为3500 lx。移植后喷施清水以保持基质湿润,待植株缓苗10 d后,每2周增施1次液体复合肥,培养2个月后,胡杨杂种幼苗株高可达25 cm,待植株长有10-15枚叶片时即可将其移栽至田间。
1.2.7 数据分析
按照如下公式计算相应参数:
外植体成活率=成活的外植体数目/(接种的外植体总数-受污染外植体数目)×100%;
愈伤诱导率=诱导愈伤数目/接种叶片数目×100%;
不定芽诱导率=诱导不定芽数目/接种愈伤块数目×100%;
生根率=诱导不定根数目/接种不定芽数目×100%;
本试验数据采用Spss软件进行方差分析。
2 结果与分析
2.1 不同处理时间对外植体脱菌效果的影响
由图1可知,采用0.1% HgCl2进行脱菌,时间为5 min时的脱菌效果最好,此时的成活率可达100%,污染率为0%。随着脱菌时间的延长,外植体成活率逐渐降低,污染率为0,这可能与HgCl2溶液对叶片的毒害作用有关,脱菌时间越长,毒害作用越大,从而影响细胞活性,导致外植体死亡。
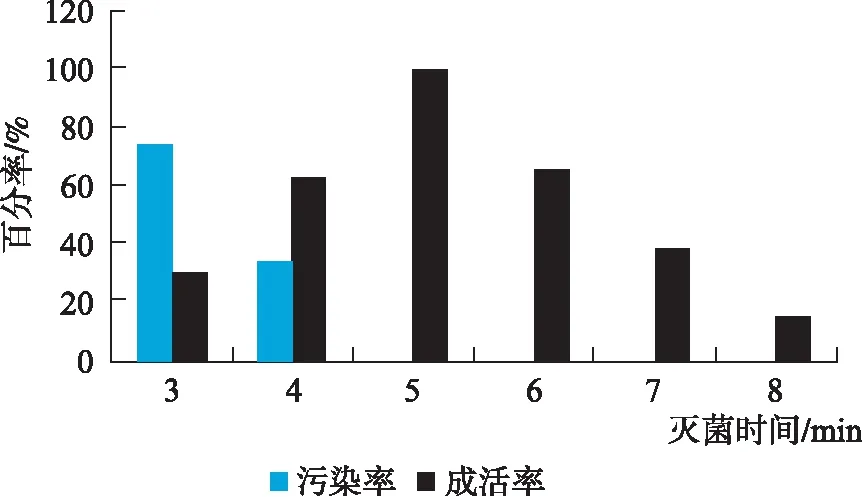
图1 不同脱菌时间下外植体污染率及成活率Fig.1 Contamination rate and survival rate of explants with different sterilization time
2.2 不同生长调节因子对叶片愈伤组织的诱导影响
由图2可知,不同生长调节因子对胡杨杂种叶片诱导愈伤组织差异显著。在6组处理中,处理(5)0.4 mg·L-16-BA+0.4 mg·L-1NAA的愈伤组织诱导率高达100%,诱导出的愈伤组织如图3所示,其呈现出结构致密的绿色瘤状组织。
当6-BA浓度为0.5 mg·L-1时,随着NAA浓度的上升,愈伤诱导率逐渐增加,当NAA浓度低于0.3 mg·L-1时,愈伤的诱导率均低于40%,所诱导的愈伤组织松散、体积小,呈黄绿泛白状态。当NAA浓度和6-BA浓度为0.4 mg·L-1时,愈伤诱导率可达100%(表1)。
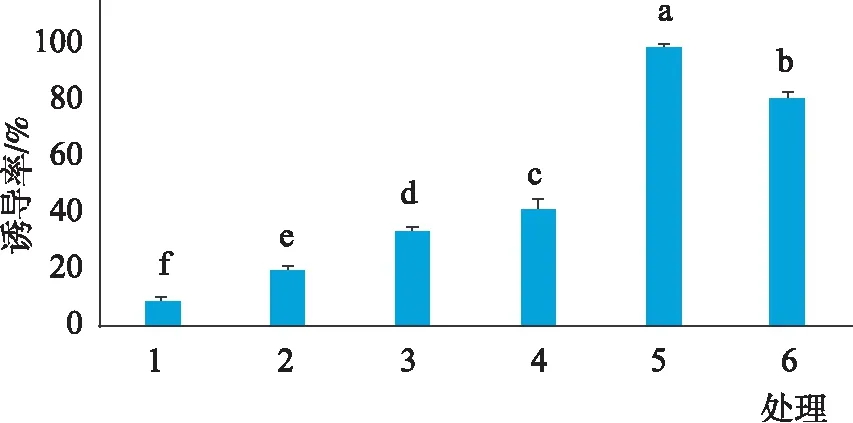
图2 不同生长调节因子的愈伤诱导率Fig.2 Induction rate of callus with different growth regulators

图3 处理5下生长30 d的愈伤组织Fig.3 Callus growing for 30 d under treatment 5
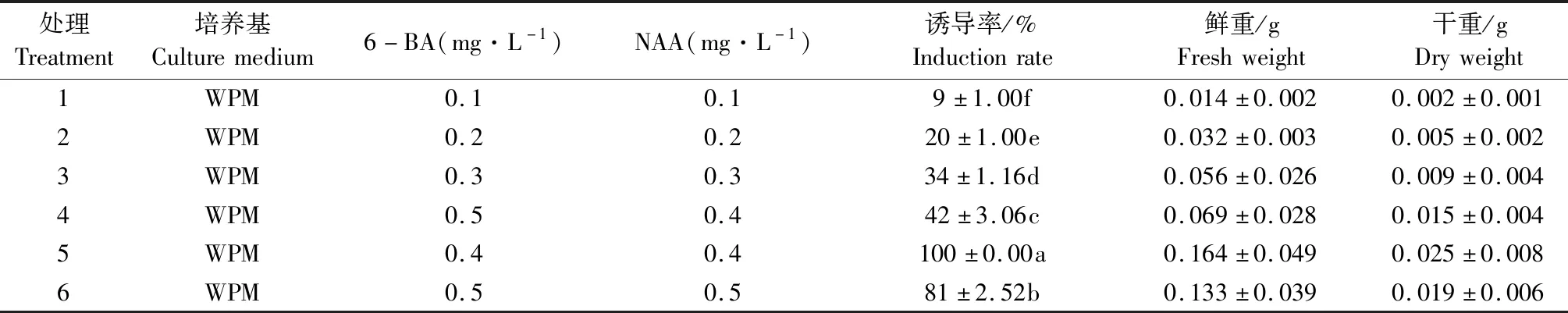
表1 不同生长调节因子对愈伤诱导率的方差分析Table 1 Variance analysis of callus induction rate under different growth regulators
2.3 不同生长调节因子对不定芽的诱导影响
由图4和图5可知,不同生长调节因子浓度及配比组合对愈伤组织诱导不定芽的诱导率及不定芽平均长度的影响较为显著,说明植物生长调节剂的种类和浓度对胡杨杂种不定芽诱导影响很大。在6组处理中,处理(3)0.5 mg·L-16-BA+0.2 mg·L-1NAA的诱导率高达100%,不定芽平均长度也最长,达到4cm。此处理下的不定芽茎部粗壮,叶片大而绿,长势较好(图6)。
当6-BA浓度为0.5 mg·L-1时,NAA浓度为0.05 mg·L-1时无法诱导出不定芽,随着NAA浓度提高,不定芽的诱导率明显提升,当NAA浓度为0.2 mg·L-1时,不定芽诱导率可达100%,而NAA浓度高于0.2 mg·L-1时,诱导率明显降低(表2)。不定芽分化培养过程中,不仅需要足够量的细胞分裂素,同时还需要一定浓度的生长素,二者有机结合才能获得更高的不定芽分化率。
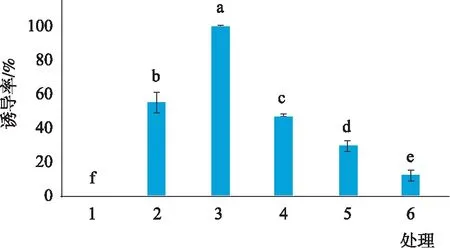
图4 不同生长调节因子对不定芽的诱导率Fig.4 Induction rate of adventitious buds with different growth regulators
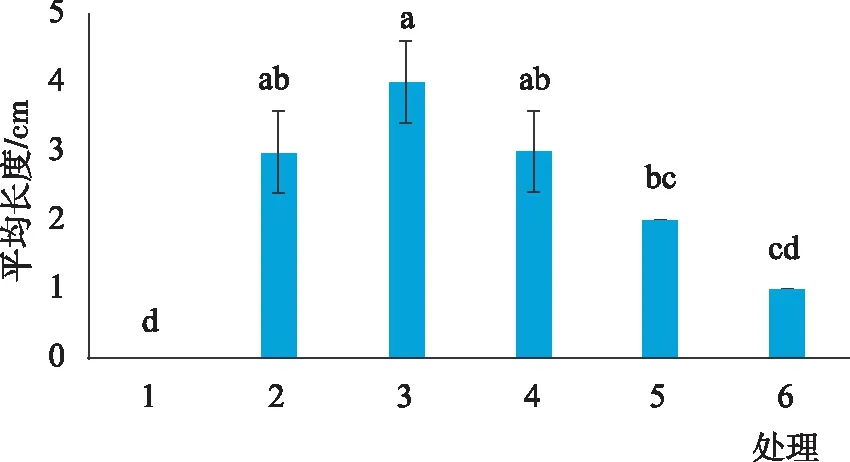
图5 不同生长调节因子诱导下不定芽平均长度Fig.5 Average length of adventitious buds induced by different growth regulators
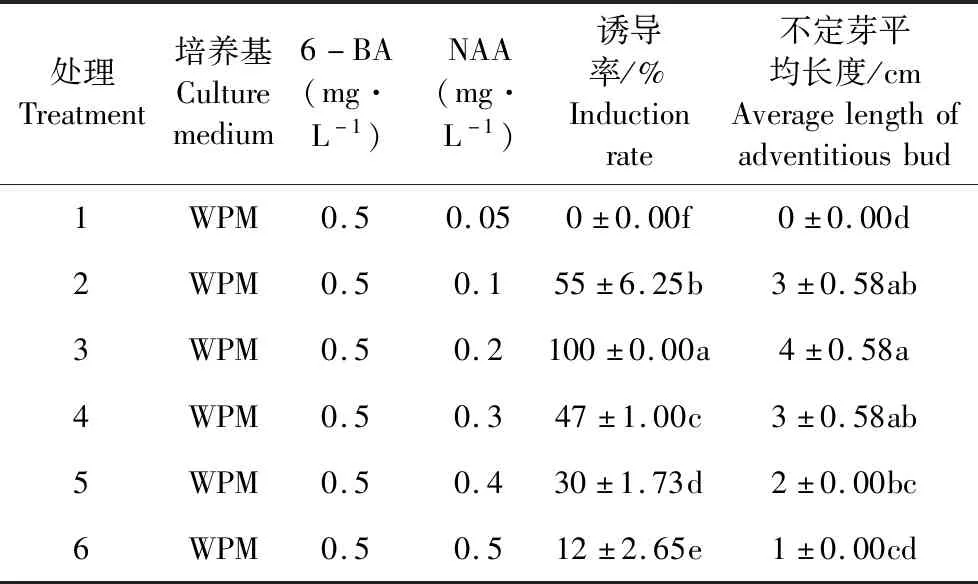
表2 不同生长调节因子对不定芽诱导率和不定芽长度的方差分析Table 2 Variance analysis of induction rate and bud length of adventitious budswith different growth regulators
2.4 不同生长调节因子对不定根的诱导影响
由图7、8和9可知,不同激素浓度组合对不定芽诱导不定根的诱导率以及根数、平均根长均存在显著差异。在6组处理中,处理(4)2.0 mg·L-16-BA+ 0.02 mg·L-1NAA+0.2 mg·L-1GA3的生根率最高,可达100%,根数达到20根,根长为9 cm,此浓度及激素组合下长出的不定根状态如图10和11所示。当6-BA浓度为1.0 mg·L-1时,不定根的诱导率很低,随着NAA浓度的提升,诱导率呈上升趋势;当6-BA浓度为2.0 mg·L-1时,随着NAA浓度的提高,诱导率则呈现出明显下降的趋势(图7)。植物不定根的发生始于根原基的分化,不定根根原基的诱导与生长素IAA和6-BA水平的高低有关,生长素对不定根的形成具有重要作用,其能够调节细胞分裂周期以实现细胞的有序分裂,与根原基发端密切相关。
在生根培养过程中,长出的根系是以茎下端膨大组织为中心,向四周辐射生长,根系长度长、数量多、密度大(图10)。处理4培养30 d时主根的平均长度为9 cm,生根率为100%。
2.5 炼苗移载
将培养30 d的组培苗从培养基中取出,流水洗净根部残留的培养基,将其栽植到营养土、珍珠岩体积比为3∶1基质的花盆中(图12),放置在温室中培养,其幼苗的成活率可达100%。

图6 处理3下的不定芽生长状态Fig.6 Growth state of adventitious buds under treatment 3
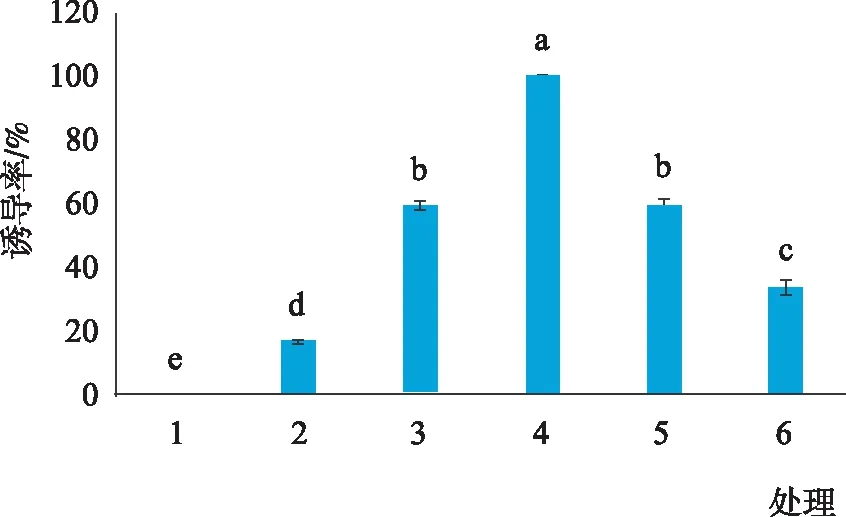
图7 不同生长调控因子处理下的不定根诱导率Fig.7 Induction rate of adventitious roots treated with different growth regulators
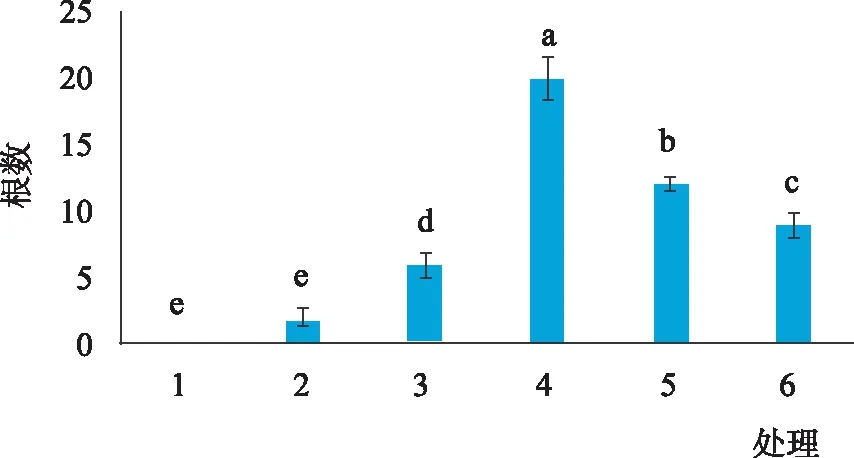
图8 不同生长调控因子诱导的不定根根数Fig.8 Number of adventitious roots with different growth regulators
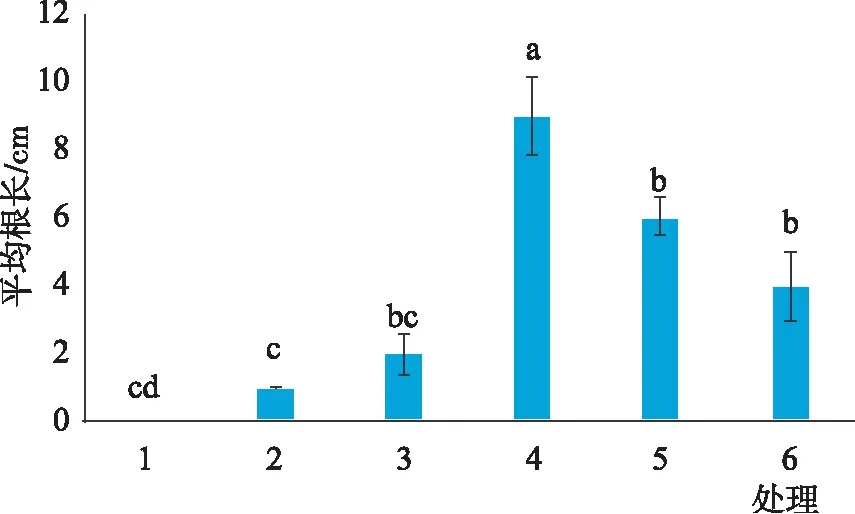
图9 不同生长调控因子诱导的不定根平均长度Fig.9 Average length of adventitious roots with different growth regulators
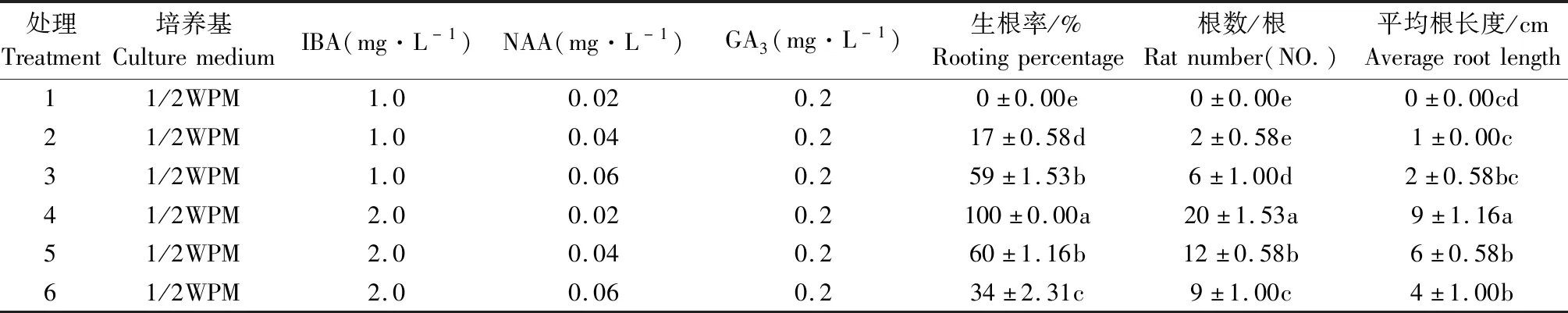
表3 不同生长调节因子对不定根诱导率和根数、平均根长的方差分析Table 3 Variance analysis of induction rate, number of roots and average root length of adventitious roots with different growth regulators
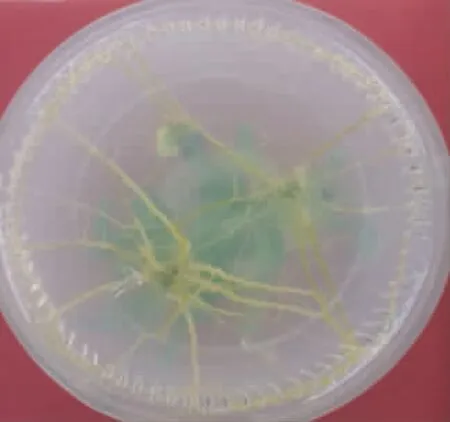
图10 处理4下生长30 d的不定根Fig.10 Adventitious roots grown for 30 d under treatment 4

图11 处理4下生长30 d的组培苗Fig.11 Tissue culture seedlings grown for 30 d under treatment 4

图12 移栽后胡杨杂种植株生长状况Fig.12 Growth status of Populus euphratica hybrid plants after transplanting
3 讨论
随着植物生物技术和基因工程的发展,杨树组织培养技术和遗传转化研究越来越多[8]。然而胡杨的叶片再生体系和遗传转化存在着诸多难题[9],组织培养作为一种快速的繁殖技术,其能够在短期内大量繁殖出生长状态相对一致的优质苗木,对推进胡杨规模化育种进程具有重要意义。
植物生长调节剂是影响外植体材料形态发生的最关键因素,植物愈伤组织不定芽的分化直接取决于培养基的种类、植物生长调节剂的种类和浓度[10]。本研究采用WPM培养基作为胡杨杂种叶片诱导愈伤组织的基本培养基,生长调节剂组合为0.4 mg·L-16-BA和0.4 mg·L-1NAA。愈伤组织诱导出不定芽的生长调节剂组合为0.5 mg·L-16-BA和0.2 mg·L-1NAA。研究发现对于大多数植物,当细胞分裂素浓度和生长素浓度的比值相当时,有利于愈伤组织的诱导形成,而细胞分裂素浓度大于生长素浓度时,则有利于不定芽的诱导形成[11]。本研究结果也正符合上述的细胞分裂素浓度和生长素浓度的比值规律,当细胞分裂素浓度(0.4 mg·L-16-BA)/生长素浓度(0.4 mg·L-1NAA)=1,叶片诱导形成愈伤组织;当细胞分裂素浓度(0.5 mg·L-16-BA)/生长素浓度(0.2 mg·L-1NAA)=2.5,不定芽诱导生长效果最佳。张艳萍等进行胡杨叶片愈伤诱导与器官发生试验研究中,诱导愈伤组织所用的培养基为MS,激素组合为0.5 mg·L-16-BA和0.5 mg·L-1NAA[12],虽然诱导出愈伤组织但最终并没有形成不定芽。然而,以中林2001杨、南林95杨、南抗杨3个杨树品种叶片为材料,进行愈伤组织诱导研究时,6-BA与NAA的浓度比值达到1:5-1:4时的诱导率最高[13]。在京2杨诱导不定芽形成过程中,6-BA/NAA的比值为5时,其不定芽生长状况表现最好[14]。本研究所用的培养基种类及生长调节剂的配比浓度与上述研究均存在有一定差异,所得试验结果也不尽相同。造成这种差异的可能原因是由于不同材料组织中这些激素的内在水平存在着差异,因而对于某一具体的形态发生过程来讲,它们所要求的外源激素的水平也会有所不同[15],另一种可能原因是由于不同品种在启动愈伤组织形成及分化时,控制其形成和分化的基因型不同,最终导致这种差异的出现[16]。
本研究中不定芽进行生根培养所采用的培养基为1/2WPM,生长调节剂的浓度及配比为2.0 mg·L-1IBA+0.02 mg·L-1NAA+0.2 mg·L-1GA3,此组合下的生根率可达100%。研究发现影响植物组培苗能否生根的因素主要有植物材料、培养基类型、植物生长调节剂和其他因子等[17]。其他人进行杨树组培苗生根培养大多采用1/2MS培养基,同时,加入不同的植物生长调节剂NAA、IAA和IBA,加入适量的GA3有利于根的生长及壮苗[18]。在青杨、甜叶杨和山新杨的生根培养过程中,使用的是1/2MS培养基,加入0.3 mg·L-1的IBA[19-21]。本研究所用的培养基及生长调节剂配比和浓度与前人的研究结果差异较大,这可能与不同品种的杨树及研究所选用的外植体有关,反映了不同杨柳科树种之间不定芽诱导生根存在着明显差异。
4 结论
(1)利用胡杨杂种叶片为组培外植体,采用0.1%HgCl2脱菌5 min,污染率为0,成活率为100%。(2)以WPM为基本培养基添加0.4 mg·L-16-BA和0.4 mg·L-1NAA可以使叶片诱导出愈伤组织;添加0.5 mg·L-16-BA和0.2 mg·L-1NAA可以诱导出不定芽。(3)以1/2WPM为基本培养基,添加2.0 mg·L-1IBA,0.02 mg·L-1NAA及0.2 mg·L-1GA3,生根效果最佳。上述3种培养基均需加入30 g·L-1蔗糖,30 g·L-1琼脂,pH调至5.8。(4)将培养30 d组培苗栽植至营养土和珍珠岩体积比为3∶1的基质中,温室培养下幼苗成活率可达100%。

