骨骼系统中糖代谢机制的运动干预研究
陈泷
华东师范大学体育与健康学院/青少年健康评价与运动干预教育部重点实验室,上海 200241
骨骼系统是机体重要的调节性组织,成骨细胞的骨形成和破骨细胞的骨吸收构成骨重塑过程,维持骨骼的内稳态。但对于糖尿病患者,其系统性的糖代谢紊乱会打破该平衡,引起骨质疏松甚至骨折的风险。骨骼细胞中自分泌、旁分泌和内分泌等多种反馈机制均有成骨细胞和破骨细胞的参与。最新研究[1]发现,葡萄糖代谢在成骨细胞和破骨细胞中具有重要的可塑性代谢和功能性调节作用。运动增加骨骼的力学性能,而这种提高通常归因于运动产生的动态负荷,可直接调节机体的糖代谢过程,刺激细胞葡萄糖代谢机制,这种糖代谢变化在肝脏、骨骼肌、脂肪、脑和胰等代偿性尤为明显的组织中更加显著[2]。但关于骨骼细胞中糖代谢调节过程的讨论相对较少,尤其是2型糖尿病中骨代谢紊乱现象以及骨骼质量下降等研究鲜有报道,深入了解骨骼细胞中的糖代谢过程,对于运动改善骨骼健康问题具有重要意义。本文以期通过葡萄糖代谢领域分析骨骼能量调节水平,为运动改善骨骼健康提高新的视角。
1 细胞葡萄糖代谢
糖代谢是哺乳动物细胞重要的能量来源和碳源,葡萄糖吸收入血后,通过葡萄糖转运体(glucose transporters, GLUTs)进行浓度差转运,进入细胞后,葡萄糖受己糖激酶磷酸化变为葡萄糖-6-磷酸(glucose-6-phosphate, G6P),作为糖原储备、ATP或合成代谢中产物;糖酵解产生2分子丙酮酸、ATP和烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NADH)。除糖酵解外,G6P还通过戊糖磷酸途径(pentose phosphate pathway, PPP)产生核酸5-磷酸核糖以及还原性生物合成反应所必需的烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)、谷胱甘肽(glutathione, GSH)和硫氧化还原蛋白(thioredoxin, TRX)等氧化还原稳态因子[3];另外,G6P形成的6-磷酸果糖(fructose-6-phosphate, F6P)进入用于蛋白质糖基化的尿苷二磷酸-N-乙酰葡糖胺(uridine diphosphate n-acetylglucosamine, UDPGlcNAc)的氨基己糖合成途径(hexosamine biosynthetic pathway, HBP)[1]。总而言之,糖酵解被认为是糖代谢的主要过程,葡萄糖生产ATP过程与氧气关联较低,其丙酮酸可以转化为乳酸或进入TCA循环(tricarboxylic acid cycle, TCA Cycle)中进一步氧化,以支持脂质和氨基酸生物合成、氧化还原和基因表达的表观遗传调节。因此,葡萄糖不仅是重要的能量来源,还是支持细胞稳态和功能所必需的中间代谢物的关键提供者。
从目前研究角度来看,关于运动介导的糖代谢主要停留在软组织中,包括肝脏、心脏[4]、骨骼肌[5]等,发现在肌组织中较低的TCA循环不会影响耐力水平,却能够增加吸氧峰值和柠檬酸合成酶活性,在运动后恢复期,葡萄糖摄取对胰岛素的敏感性增加,并重建糖原储存[2, 6]。关于骨骼系统中的糖代谢机制,根据肌骨系统共结合的特性,推测认为骨骼中的糖代谢过程也具有相同的表征。
2 成骨细胞中的糖代谢
骨外植体或分离成骨细胞的早期研究表明,葡萄糖被认为是成骨细胞谱系中重要的营养素,葡萄糖转运蛋白家族成员在骨祖细胞中进行表达。大鼠骨衍生成骨细胞PyMS细胞表达GLUT1和GLUT3,小鼠颅骨前成骨细胞的原代培养物中检测出GLUT4[1]。大量研究认识到在成骨细胞的糖酵解过程中,骨骼不仅会消耗大量的葡萄糖,同时产生乳酸,而TCA循环在有氧过程中只是起到次要作用。分离出的颅骨成骨细胞培养物发生糖酵解时,葡萄糖利用水平与肝细胞大致相当,但氧消耗率却低得多;研究[7]认为,成骨细胞消耗的葡萄糖中有80%转化为乳酸,并与柠檬酸盐共同促进骨转换和骨矿盐溶解水平。
成骨细胞中的糖代谢可影响全身性糖稳态水平[8]。缺氧诱导因子1α(hypoxia inducible factor 1α, HIF1α)几乎可在所有类型的细胞中进行表达,HIF1α是感应O2变化的中枢环节,也是成骨级联反应的关键性因子,成骨细胞敲除HIF1α基因,会引起骨骼变细;而HIF1α高表达会出现致密和丰富的长骨[9]。缺氧信号诱导的成骨细胞谱系中的过量糖酵解增加了骨骼中葡萄糖使用,从而降低了全身性糖代谢水平,这些发现对治疗骨骼和代谢紊乱的发展产生影响[8]。即使存在足够的O2,成骨细胞也会将糖代谢为乳酸,在成骨细胞系MC3T3-E1和UAMS-32细胞中,利用乳酸代谢途径关键分子的抑制剂和特异性小干扰RNA(small interfering RNA, siRNA)处理细胞,研究发现成骨细胞中的相关因子表达会根据乳酸浓度的变化而变化,由此认为乳酸在骨骼微环境中具有重要的调节功能[10],且成骨细胞系中的糖酵解直接受到各种骨合成代谢信号的刺激。
2.1 PTH对成骨细胞糖酵解的调节
甲状旁腺素(parathyroid hormone, PTH)可刺激葡萄糖产生乳酸。研究[11]认为,增加乳酸产量是造成更多活性骨吸收的主要原因。PTH是一类氨基酸序列为1~34的钙磷调节性激素,由甲状旁腺合成并分泌,PTH或其N末端片段能够有效促进骨形成,刺激成骨细胞分化,抑制成骨细胞凋亡,改善成骨细胞中糖酵解[12]。PTH-cAMP信号传导可以直接或间接诱导次级信号来刺激糖酵解,在颅骨外植体中,PTH会增加乳酸的含量;在大鼠成骨细胞中,PTH会诱导葡萄糖摄取,并与1型受体(PTH1R)结合,其中PTH刺激PTH1R,启动Gαs调节,引起环腺苷一磷酸(cyclic adenosine monophosphate, cAMP)信号生成,PTH(1~31)主要刺激cAMP生成,产生与PTH(1~34)相同的合成代谢效应,说明了Gαs/cAMP信号是刺激骨骼代谢的重要途径[13]。其中PTH/cAMP信号还会增加胰岛素样生长因子1(insulin like growth factor 1, IGF1)在成骨细胞谱系中的合成与释放,间接促进有氧糖酵解,再通过哺乳动物雷帕霉素靶复合体2(mammalian target of rapamycin complex 2, mTORC2)的传导以提升糖酵解酶活性[13]。
当出现骨质疏松时,通过PTH治疗改善对骨骼的活性来影响糖代谢。且在骨转换过程中,没有对胰岛素分泌、胰岛素抵抗、胰腺β细胞功能和脂肪量产生影响[14]。运动过程中骨骼适应变化是骨骼动态负荷调整和PTH合成释放的共同作用,PTH在结构和组织水平上有不同的表达,30 min跑可将小鼠全身性PTH水平增加至2倍,运动期间增强的PTH信号传导增加了骨小梁和皮质骨的体积[15]。在2型糖尿病鼠中,骨中PTH/cAMP水平下降,而PTH治疗可逆转2型糖尿病中骨量、骨强度和大鼠骨缺损修复的不良骨骼效应,但不影响能量代谢。经过PTH治疗后的骨量增加比非糖尿病状态高出23%[16],在运动调节下PTH会得到升高[15],在2型糖尿病小鼠中,经过每天50 min、持续8周的游泳运动后会明显提高cAMP浓度[17],最终改善骨骼中的糖酵解过程,使得骨骼向良性方向发展。
2.2 胰岛素和IGFs对成骨细胞糖酵解的调节
胰岛素是控制全身性葡萄糖的关键激素,瘦素通过下丘脑中转调节骨量;还会直接作用于成骨细胞,引起骨内分泌激素的释放,促成胰岛素的合成[18],2型糖尿病会引起胰岛素紊乱,抑制成骨细胞生物功能活性[18-19]。临床研究[11]发现,糖尿病模型揭示了胰岛素缺失与成骨细胞功能之间的联系,在糖尿病大鼠中延迟的骨折愈合可以通过在骨折部位的胰岛素递送来克服,而不影响全身血糖水平,但关于胰岛素是否通过细胞代谢重编程促进骨形成方面的问题尚不清楚。对超重男童进行为期10周的全身振动训练,在骨矿含量、骨密度上会出现显著的提高[20]。
胰岛素样生长因子(insulin-like growth factors, IGFs)中的IGF1和IGF2与骨形成存在直接的联系,IGF1与出生后骨基质充分相关,并且作为骨合成代谢信号已被广泛研究。IGF1刺激骨形成,对成骨细胞的特立帕肽作用至关重要,骨形成水平较低会伴随着高血清IGF1基线并对特立帕肽的反映较弱[21],IGF1与其受体(insulin-like growth factor 1 receptor, IGF1R)结合进而调节mTORC2。作为传输的中枢信号,mTORC2再引导进一步的调节。研究mTORC2在骨骼发育和骨稳态的作用时发现,敲除mTORC2合成的关键性因子—Rictor,发现其缺失可导致胚胎以及出生后小鼠较短和较窄的骨骼结构。由于软骨细胞肥大的延迟,胚胎骨骼结构缩短、增殖、细胞凋亡、细胞大小或骨基质的产生没有变化,且对机械负荷的合成代谢反应减弱,也说明mTORC2信号传导对于最佳的骨骼生长和骨合成代谢是必需的[22]。
2.3 成骨细胞分化中Wnt信号通路对糖酵解的刺激
Wnt信号控制着细胞增殖、分化、极性变化和迁移,Wnt与卷曲蛋白(frizzled, FZD)和低密度受体样蛋白(low density receptor-like proteins, LPR)中LRP5/6共受体结合,引起β-catenin蛋白稳定化,最终形成Wnt/β-catenin结构,调节成骨细胞和骨形成过程,并通过糖原合酶的磷酸化作用引起β-catenin异位入核[23]。在小鼠胚胎期,敲除骨祖细胞中LRP5/6或β-catenin,可导致成骨细胞分化紊乱,LRP5功能的缺失或获得相应会引起骨量的下降或升高。在有氧情况下Wnt信号刺激产生乳酸,其中Wnt3a、Wnt7b和Wnt10b诱导成骨细胞分化和原代培养物中有氧糖酵解;Wnt3a能够诱导有氧糖酵解,并通过LRP5调节后,由RAC1下游的mTORC2-Akt信号传导,mTORC2会激活Akt磷酸化位点Ser473,进而诱导糖代谢。对ST2细胞代谢进行观察,发现Wnt3a会提高乳酸水平[24]。抑制Wnt3a诱导的代谢酶活性会损伤成骨细胞的分化,减弱mTORC2和糖酵解酶活性,降低血乳酸含量;对有氧糖酵解的直接刺激有助于Wnt-LRP5传导的骨合成,反言之,LRP5的高表达会引起高骨量和糖酵解能力的提高[11, 25]。作为骨代谢中重要的Wnt-LRP5信号,能够刺激成骨细胞谱系中有氧酵解过程,Wnt3a-LRP5信号传导在mTORC2-Akt信号活化下游的GLUT1、己糖激酶2(hexokinase II, HK2)、乳酸脱氢酶A(lactate dehydrogenase A, LDHA)和丙酮酸脱氢酶激酶1(pyruvate dehydrogenase kinase 1, PDK1)的水平急剧增加,同时诱导来自骨髓间充质细胞系ST2的成骨细胞分化,鉴于GLUT1和HK2的上调预期会刺激糖酵解的总体速率,增加LDHA和PDK1将有利于丙酮酸盐产生乳酸,从而改变代谢特征朝向成骨细胞[1]。有研究[26]发现,PTH也会调节Wnt信号转导,使骨髓间充质干细胞(mesenchymal stem cells, MSCs)向成骨细胞增殖、分化,并通过增加护骨素(osteoprotegerin, OPG)控制破骨细胞骨吸收。而且PTH的合成代谢作用与Wnt / LRP6 /β-catenin轴具有密切关联。见图1。
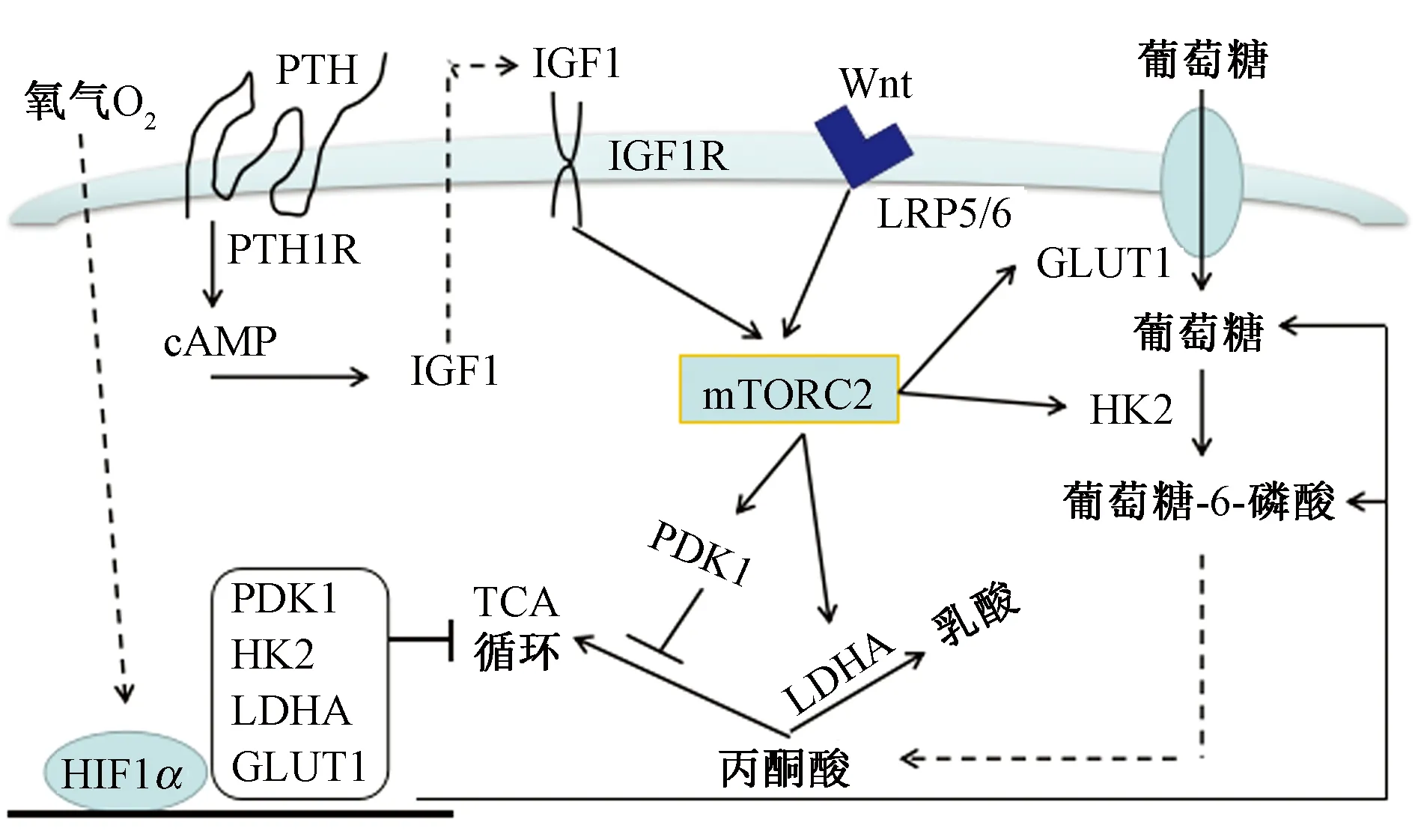
图1 成骨细胞谱系调节葡萄糖代谢[1]Fig.1 Osteoblast lineage regulates glucose metabolism[1]
3 破骨细胞中的糖代谢
破骨细胞属于巨噬细胞体系,成熟的破骨细胞会增强柠檬酸循环和线粒体呼吸产生ATP,引起骨吸收,最终维持矿物质稳定。破骨细胞经分化和融合巨噬细胞谱系的单核细胞前体以响应巨噬细胞集落刺激因子(macrophage colony stimulating factor, MCSF)和NF-κB受体活化因子配体(receptor activator of nuclear factor—κb ligand, RANKL)而形成。在小鼠骨髓巨噬细胞的RANKL诱导的破骨细胞分化期间,发现糖酵解、氧化磷酸化(oxidative phosphorylation, OXPHOS)以及乳酸产生增加。糖酵解和OXPHOS在葡萄糖和O2消耗以及乳酸产生过程中,会诱导RANKL激活,引起RAW264.7和骨髓巨噬细胞系中破骨细胞生成[27]。其中细胞的增殖和分化会因为葡萄糖浓度(0~100 mmol/L)而产生相应的变化,成熟细胞增殖多发生在20 mmol/L葡萄糖浓度下,分化多发生在5 mmol/L葡萄糖浓度下,这为调节代谢底物水平进而改善破骨细胞形成提供了参考。在成骨细胞成熟的中期和晚期阶段,糖酵解和呼吸都被增强,以满足生物合成需要分化的成分[27]。较高的代谢活性和ATP生产率刺激破骨细胞分化,包括增殖、迁移和融合以形成多核细胞、以及成熟破骨细胞中的骨吸收。这一系列的变化主要是由于:① 外源性ATP刺激破骨细胞形成和吸收池形成[28];② 破骨细胞具有丰富的线粒体[29];③ 在破骨细胞分化阶段涉及柠檬酸循环和OXPHOS的代谢酶活性升高[30];④ 成熟破骨细胞中H+-ATP酶将质子泵入细胞外再吸收区域[29]。
对于破骨细胞活化平衡的破坏会导致病理性骨丢失,如骨质疏松症、类风湿性关节炎、原发性骨癌和癌症向骨转移病症,缺氧起着重要作用。已经发现由缺氧引起的糖酵解和线粒体代谢活性的增加以及随之而来的线粒体活性氧的产生对于破骨细胞形成和再吸收必不可少。HIF会提高电子传递链反应(electron transport chain reaction, ETCR)效率[31],引起ATP调节和ROS提高,使用HIF抑制剂作为靶向治疗将改善骨溶解疾病中的骨吸收。见图2。
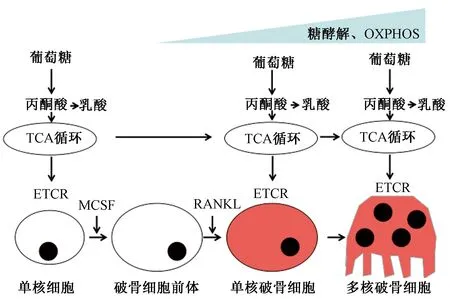
图2 破骨细胞分化过程中的代谢调控[1, 27]Fig.2 Metabolic regulation during osteoclast differentiation[1, 27]
4 运动与骨骼代谢调节
随着年龄的增长,机体的整体骨量会显著下降,运动是降低骨折风险,促进骨形成的关键因素[32]。研究发现[33],游泳等卸力性锻炼对于骨骼质量的改善没有显著性作用,而跑步运动、跳跃运动、举重运动都会对骨骼质量的提高带来显著性的改善。尤其是涉及到骨骼糖代谢过程,伴随年龄、代谢性疾病、性别、运动水平等因素的影响,当出现骨骼中糖代谢紊乱时,骨骼质量会出现更为显著的下降,甚至引起骨质疏松和骨折的风险。下面将从成骨细胞和破骨细胞两个角度,分析运动对于糖代谢的控制作用。
4.1 运动与成骨细胞糖代谢调节
在小鼠自愿攀爬运动模型下,会明显增加小鼠的骨形成能力,并提高PTH/PTHrP水平,使得骨髓基质细胞的成骨和成脂潜力增强,并抑制终末脂肪细胞分化并促进成骨细胞分化[34]。在跑台训练中,PTH并未对小鼠骨骼产生巨大的变化,但是骨吸收水平明显下降[35]。尤其是在不同的运动模式(平坡运动、下坡跑运动和游泳运动)下,均会导致小鼠血清PTH浓度出现显著的差异性[36]。在男性骨质疏松症中,HIF1α能直接引起破骨细胞分化和骨量的丢失,体外研究[37]发现,HIF1α蛋白会在低氧环境下的破骨细胞中聚积。HIF1α通过诱导葡萄糖转运蛋白和糖酵解酶在内的糖酵解相关基因来调节多种细胞类型的糖酵解途径,而HIF1α缺陷型骨髓B细胞比野生型细胞的葡萄糖利用效果低[38]。
关于胰岛素和IGF1在骨代谢中的研究相对较多,进行有氧运动训练会改善非胰岛素依赖型糖尿病患者的骨代谢水平[39],尤其是在胰岛素调节的成骨细胞调节中。已经发现IGF1和骨密度之间的必然联系,其中渐进性抗阻训练法(progressive resistance exercise, PRE)比骨质疏松预防性锻炼(osteoporosis prevention exercise, SPO)效果更好[40]。生长激素(growth hormone, GH)和IGF1刺激生长并调节成骨细胞基因表达,进而刺激骨生长。而在糖代谢过程,在对患有Ⅰ型糖尿病的青少年女孩进行研究,发现青少年女孩骨量和IGF1水平与对照组相比较低,HbA1c、葡萄糖水平又显著高于对照组[41]。
在Wnt/LRP6/β-catenin轴,尤其是LRP6/β-catenin的调节中,还发现LRP6对PTH的合成具有重要作用,其中LRP5/LRP6会结合于FZD,进而使得β-catenin信号进一步激活[42]。其中在对C57BL/6小鼠进行的运动干预中发现,不同运动方式对胫骨中PTH1R、FZD、β-catenin等基因的表达发生了显著变化;跑台和游泳运动后胫骨中FZD基因表达有一致性变化,与对照组相比显著上调;运动组的原代MSCs诱导分化的成骨细胞中FZD、RANKL基因表达同样显著提高,其中下坡跑运动原代MSCs诱导分化的成骨细胞LRP5基因显著上调;游泳运动引起胫骨LRP6和β-catenin基因表达高于平坡跑台运动;游泳运动诱使胫骨β-catenin基因表达显著高于下坡跑台运动[36]。
4.2 运动与破骨细胞糖代谢调节
在骨代谢中,RANKL和MCSF是破骨细胞生成前体分化为成熟破骨细胞的必需因子。运动会对破骨细胞分化具有抑制作用,最为经典的研究[43]中指出,有效的运动刺激能够提高OPG与RANKL竞争性结合,阻止RANKL与RANK直接的结合。当进行高糖饮食后,会抑制RANKL诱导的破骨细胞生成现象,在体外培养过程中,成骨细胞样细胞与高葡萄糖的孵育可抑制骨骼矿化水平。在对71名老年女性进行的每周3次、为期8个月的运动效果评价中,发现抗阻运动使大转子(2.9%)和全髋(1.5%)的骨密度增加,并改善了身体成分。抗阻运动和有氧运动均改善了平衡,而OPG和RANKL水平及OPG/RANKL比率未观察到显著变化,其中乳糖酶非持久性与骨密度变化无关[44]。mTOR和Rictor(一种mTORC2成分)的RNAi基因抑制导致刺激依赖性RANKL易位的减少,用雷帕霉素长时间暴露ST2细胞,令mTORC2被抑制,导致RANKL易位显著减少,最终说明了RANKL的反向信号是通过mTORC2激活触发RANKL易位[45]。
综上所述,对于骨骼系统中的糖代谢,涉及到骨骼内糖代谢机制。运动会有效提高成骨细胞中的糖代谢水平,引起骨形成;而在破骨细胞中,运动能够调控MCSF和RANKL的形成,抑制破骨细胞的分化水平。但由于糖代谢调节功能的多重性,有关运动的分子水平变化还需进一步的探讨。见图3。
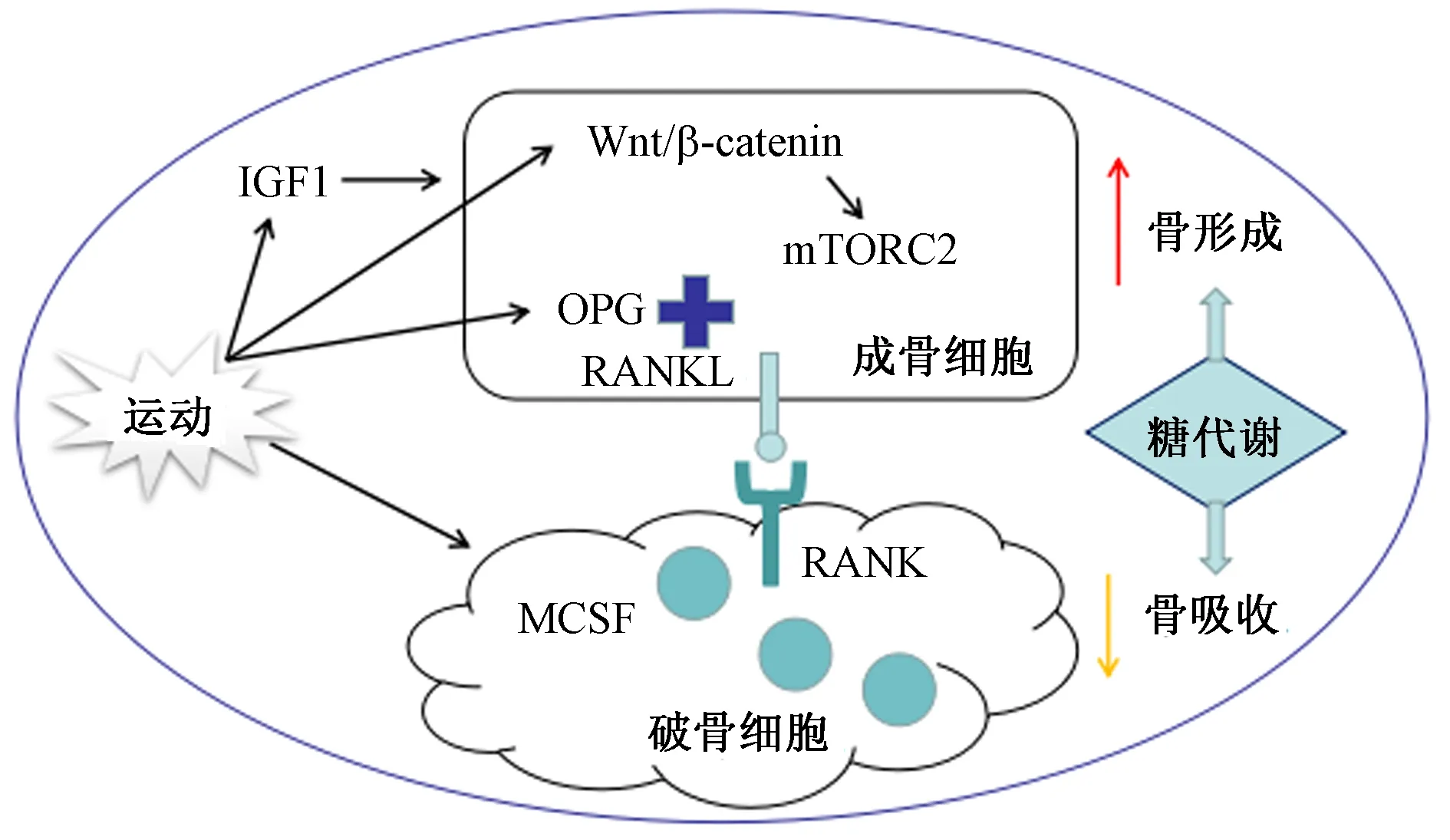
图3 运动对骨骼系统糖代谢作用调节示意图Fig.3 Schematic diagram of exercise regulation on skeletal system glucose metabolism
5 小结与展望
了解骨骼细胞中的分子生物机制是研发新型骨合成代谢疗法的关键,在过去的几十年中,对于转录因子和信号介导等开展了普遍的研究。其中糖代谢作为人体内分布最广泛的能量消耗,一直受到广泛的关注,尤其是对饮食、吸收、转化、代偿等各个方面展开的研究,但关于骨骼细胞糖代谢状态和代谢表型变化的讨论甚少。本文将糖代谢机制引入到骨代谢中来,一方面将人体最重要的骨骼系统引入,探讨骨骼中糖代谢机制,并对成骨细胞和破骨细胞中糖代谢过程进行阐述,以说明糖代谢的分子发生状况;另一方面,进行骨骼系统中糖代谢水平的讨论,为进一步改善糖尿病患者骨质量下降等问题提供新思路。
通过对运动介导的糖代谢干预效果分析,发现尤其是力学刺激性运动对于改善骨骼糖代谢机制具有明显的效果,能够提高成骨细胞中PTH、胰岛素、IGFs、Wnt信号通路等信号水平,同时抑制破骨细胞的分化和吸收能力。这也为肌骨系统提供了新的运动干预意识,并对探讨肌肉和骨骼联合糖代谢机制指明了新的研究方向。

