犬恶丝虫核苷二磷酸激酶(NDPK)基因的原核表达及其免疫荧光定位
张浩杰,刘 梅,李春燕,何 冉,兰景超,罗 娌,古小彬,谢 跃,杨光友,*
(1.四川农业大学 动物医学院,四川 成都 611130;2.成都大熊猫繁育研究基地,四川 成都 610081)
犬恶丝虫病是由犬恶丝虫(Dirofilariaimmitis)引起的人兽共患寄生虫病,其成虫主要寄生于犬科和猫科动物的右心室及肺动脉内[1-2]。该病呈世界性分布,在热带、亚热带地区广泛流行,主要通过蚊媒传播,危害的宿主动物达30余种[1-2]。人可因被携带犬恶丝虫病原的蚊虫叮咬而感染,主要引起肺部出现病变,其次虫体在皮下、眼部、阴囊等处也有发现[3]。近年来,人感染该病的确诊例数呈逐年上升的趋势,已引起国际社会的高度重视[4]。目前,该病的诊断主要通过常规方法检测微丝蚴,但其灵敏度低,而免疫学诊断方法尚不完善;在预防中,由于尚无商业化的疫苗,目前主要采用药物预防,但化学药物存在耐药性及环境污染等问题[2]。
核苷二磷酸激酶(nucleoside diphosphate kinase,NDPK,EC 2.7.4.6)是一种“管家酶”,其主要功能是催化腺苷三磷酸(nucleoside triphosphate,ATP)和核苷二磷酸(nucleoside diphosphate,NDP)之间的磷酸基团的转移反应以此来维持细胞NDP和NTP代谢平衡,对生物体的新陈代谢具有重要意义[5-6]。近年来研究发现,NDPK还可参与细胞内信号传导,调节细胞增殖、分化、发育和凋亡等[5, 7-8]。NDPK已于多种寄生虫中被发现,如恶性疟原虫(Plasmodiumfalciparum)、克氏锥虫(Trypanosomacruzi)、硕大利什曼原虫(Leishmaniamajor)、亚马孙利什曼原虫(Leishmaniaamazonensis)、马来丝虫(Brugiamalayi)、旋毛虫(Trichinellaspiralis)和捻转血矛线虫(Haemonchuscontortus)[5-22],且认为NDPK可能是潜在的诊断抗原[11, 14, 22]和成为研发新的抗寄生虫药物的靶点[8-9, 13, 19]。但目前尚未见有关犬恶丝虫NDPK(Di-NDPK)的报道。
本研究从犬恶丝虫成虫转录组数据库中筛选Di-NDPK基因[1],完成克隆和原核表达,并分析其基本特征。对NDPK重组蛋白(rDi-NDPK)的反应原性进行了免疫印迹分析;用免疫组化的方法分析了Di-NDPK在犬恶丝虫雌虫和雄虫体内的分布情况,为Di-NDPK的功能研究、免疫诊断方法、疫苗和治疗药物等的研发奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 实验样品和试验动物
犬恶丝虫的雌雄虫体均来源于自然感染犬恶丝虫死亡后的犬,解剖后采集的活虫用PBS清洗,进行形态学鉴定后储存于液氮中。将犬恶丝虫雌虫和雄虫包埋后,制作石蜡切片。2只健康新西兰大白兔,雌性,1.5~2.0 kg,购自成都达硕实验动物有限公司。
1.1.2 主要试剂
DH5α、BL21(DE3)、pMD19-T Vector购于TaKaRa公司;总RNA抽提试剂盒、TaqPCR MasterMix、质粒小量抽提试剂盒、增强型HRP-DAB底物显色试剂盒购于北京天根生化科技有限公司;DNA Marker、Protein Marker、QuickCutTM限制性内切酶(EcoRⅠ/HindⅢ)、T4 DNA连接酶购于大连宝生物工程有限公司;HRP-标记羊抗兔IgG、HRP-标记兔抗犬IgG购于武汉博士德生物工程有限公司;琼脂糖凝胶回收试剂盒、镍螯合亲和层析柱、IgG纯化预装柱购于德国Qiagen公司;反转录试剂盒购于美国Thermo公司;IPTG、弗氏完全佐剂和不完全佐剂购于美国Sigma公司;FITC-标记羊抗兔IgG购于美国EarthOx公司;其他试剂为国产分析纯。
1.2 方法
1.2.1 生物信息学分析
从犬恶丝虫成虫转录组数据库中筛选得到的Di-NDPKunigene 8 687(GenBank No.:JR904615.1),ORF Finder工具分析Di-NDPK基因ORF框。利用BLAST对测序得到的目的片段序列进行检索,确认扩增得到的是NDPK基因。将该基因序列通过Clustal W软件与其他已报道的NDPK基因比对,用MEGA 5.1软件分别进行序列相似性分析和构建NJ(neighbor-joining)树。
1.2.2Di-NDPK基因的扩增、克隆
根据GenBank中筛选的序列(GenBank No.:JR904615.1),用Primer premiere 5.0进行引物的设计,上游引物:F,5′-CCGGAATTCATGTCAGCTACAAAGGAACGAACATTTA-3′;下游引物:R,5′-CCCAAGCTTCTATTCATACACCCAAGTAATTGTTGCTG-3′(下划线序列分别含EcoRⅠ和HindⅢ酶切位点),采用RT-PCR方法从犬恶丝虫总RNA中扩增Di-NDPK基因的ORF框。按照RNA抽提试剂盒指示提取犬恶丝虫总RNA,按反转录试剂盒合成cDNA,再进行PCR扩增。PCR反应体系(10 μL):预染PCR Mixture 5 μL,灭菌水3.5 μL,上下游引物及cDNA各0.5 μL。反应条件:95 ℃ 5 min;95 ℃ 45 s,58.5 ℃ 45 s,72 ℃ 45 s,35个循环;72 ℃延伸10 min。PCR产物经1%琼脂糖核酸凝胶电泳检测是否有目的片段大小的条带,接着用琼脂糖凝胶回收试剂盒回收目的产物,构建pMD19-T-NDPK及pET-32a-NDPK重组质粒,将菌液PCR和双酶切鉴定为阳性的重组质粒送生工生物工程(上海)股份有限公司测序。
1.2.3 rDi-NDPK的表达和纯化
将测序正确的菌接种于LB液体培养基中(含AMP),37 ℃环境下培养,至菌液在紫外分光光度计下D值达0.6左右,加入IPTG至终浓度为1 mmol·L-1,继续诱导培养6 h后,12 000 r·min-1离心收集菌体,经12%SDS-PAGE电泳检测,确定rDi-NDPK是否表达,并同时优化rDi-NDPK基因的原核表达条件。rDi-NDPK在最佳表达条件下大量表达后,经过镍螯合亲和层析纯化蛋白,最后用NanoDropTM One超微量紫外分光光度计测定纯化后蛋白的浓度。
1.2.4 rDi-NDPK的Western blotting分析
rDi-NDPK经12%SDS-PAGE分离,通过半干式转移到硝酸纤维素膜上,用脱脂奶粉(5%)室温封闭2 h后,加入一抗(犬恶丝虫阳性血清,1∶100),在4 ℃条件下孵育过夜;经TBST洗涤4次后,加入二抗(HRP-标记兔抗犬IgG,1∶2 000)室温孵育2 h,再用TBST洗涤4次,经二氨基联苯胺(DAB)显色后,超纯水终止反应。
1.2.5 间接免疫荧光染色
用4%多聚甲醛固定犬恶丝虫雄虫和雌虫成虫,接着用石蜡包埋后制成切片(每片4 μm),37 ℃晾干后,4 ℃保存。试验前,于60 ℃环境下烘1.0~1.5 h,再依次按二甲苯Ⅰ(7 min)、二甲苯Ⅱ(7 min)、100%乙醇Ⅰ(3 min)、100%乙醇Ⅱ(3 min)、95%乙醇(3 min)、85%乙醇(3 min)、75%乙醇(3 min)、双蒸水(8 min)进行脱蜡和水化。于95~100 ℃柠檬酸缓冲液中进行抗原的热修复后,用PBS洗涤3次;于组织上滴加3%H2O2进行抗原氧化(20 min),用PBS洗涤3次;于组织上滴加5%BSA进行封闭(60 min),用PBS洗涤3次;于组织上滴加兔NDPK-IgG(1∶100),湿盒中4 ℃孵育过夜;用PBS洗涤3次,滴加FITC标记的羊抗兔IgG(0.1%伊文氏蓝1∶100稀释),湿盒中37 ℃避光孵育1 h后使用PBS洗涤3次,再滴加适量甘油缓冲液封片,并在荧光显微镜下观察并拍照记录。
1.2.6 间接ELISA的建立和评估
通过标准棋盘滴定法测定rDi-NDPK与血清反应的ELISA最佳稀释浓度。96孔板中包被抗原浓度10 μg·孔-1,4 ℃过夜。用PBST反复洗涤3次,加入5%的脱脂奶粉,37 ℃封闭1.5 h后反复洗涤3次。分别加入犬阳性血清和犬阴性血清,37 ℃孵育1 h后反复洗涤3次。随后加入HRP标记的羊抗犬二抗孵育1 h。反复洗涤后,每孔加入100 μL可溶性TMB显色底物进行显色,并以2 mol·L-1的H2SO4终止显色,于酶标仪上测定吸光值(λ=450 nm)。测定24份犬恶丝虫病阴性血清的D450,按照计算方法,临界值=平均值+3SD。
用建立的ELISA方法分别对8份细粒棘球蚴病阳性血清,2份细颈囊尾蚴病阳性血清,8份犬钩虫病阳性血清,18份犬弓首蛔虫病阳性血清进行检测,检测其交叉反应性。
以rDi-NDPK建立的ELISA方法,对24份犬恶丝虫病阳性血清进行检测,结合临界值,判定该方法的可靠性。特异性=真阴性血清数/(真阴性血清数+假阳性血清数)×100%,敏感性=真阳性血清数/(真阳性血清数+假阴性血清数)×100%,总体符合率=(真阳性血清数+真阴性血清数)/(真阳性血清数+假阳性血清数+真阴性血清数+假阴性血清数)×100%。检测所有血清的批间变异和批内变异的变异系数(CV),即标准方差与平均值之比。每个被检测样品在不同的96孔板上分别检测3次,计算批间CV,在每个板内设3个重复,计算批内CV。
2 结果与分析
2.1 Di-NDPK基因的生物信息学分析
2.1.1 Di-NDPK蛋白的理化性质预测
经ORF Finder工具分析预测,Di-NDPK的ORF框长为462 bp,其中A、T、C、G含量分别为33.77%、27.27%、16.45%、22.51%,G+C含量为38.96%,A+T含量为61.04%。Protparam分析结果显示,Di-NDPK基因序列编码153个氨基酸,蛋白质的分子式C782H1232N212O221S9,相对分子量约45.7 ku。蛋白质不稳定系数及亲水性平均数分别为35.94和-0.277,因此,预测Di-NDPK是稳定的可溶性蛋白。对Di-NDPK的信号肽切割位点和跨膜区进行预测,结果显示无信号肽和跨膜区。预测Di-NDPK的B抗原表位结果显示,Di-NDPK的抗原表位主要集中在1-4、91-93、96-106、110-112、122-127位氨基酸。Predictprotein预测Di-NDPK蛋白的二级结构显示,该蛋白中α-螺旋(H)占39.87%,β-折叠(E)占18.30%,环状结构(L)占41.83%。
2.1.2 Di-NDPK蛋白的氨基酸序列相似性分析及系统发育树构建
对Di-NDPK基因的氨基酸序列在NCBI中通过BlastP在线搜索,并通过DNAMAN进行序列比对,比对结果如图1,结果发现,Di-NDPK氨基酸序列与罗阿丝虫(Loaloa)(登录号:XP_003139722)、马来丝虫(登录号:P48817)、犬弓首蛔虫(Toxocaracanis)(登录号:KHN88613)、有齿食道口线虫(Oesophagostomumdentatum)(登录号:KHJ94439)、鼠类圆线虫(Strongyloidesratti)(登录号:CEF65937)、美洲板口线虫(Necatoramericanus)(登录号:ETN73053)、十二指肠钩口线虫(Ancylostomaduodenale)(登录号:KIH60906)、锡兰钩口线虫(Ancylostomaceylanicum)(登录号:EPB68610)的NDPK或NDPKa氨基酸序列相似性分别为92%、88%、82%、72%、71%、70%、71%、71%,且从图中可以看出这些物种有94个氨基酸较为保守。运用MEGA5.0软件构建NJ系统发育树(图2),从树中可以看出,Di-NDPK与罗阿丝虫和马来丝虫的亲缘关系较近,聚为一个分支。
2.2 Di-NDPK基因的RT-PCR扩增及表达载体的构建
Di-NDPK基因的PCR产物通过1%琼脂糖凝胶电泳,得到与预期结果一致的特异性条带(图3-A)。重组质粒pMD19-T-NDPK和pET32a(+)-NDPK经EcoRⅠ和HindⅢ Quick Cut酶进行双酶切鉴定,插入片段的大小与预期结果一致(图3-B、C)。酶切鉴定正确的质粒pET32a(+)-NDPK送去测序,测序正确的序列用于转入BL21(DE3)菌株中,进行诱导表达。

图1 犬恶丝虫和其他物种的NDPK多序列比对Fig.1 Multiple sequence alignment of NDPK in D. immitis and other species

图2 NDPK蛋白的系统发育树(NJ树)Fig.2 Phylogenetic analysis of NDPK proteins (NJ tree)
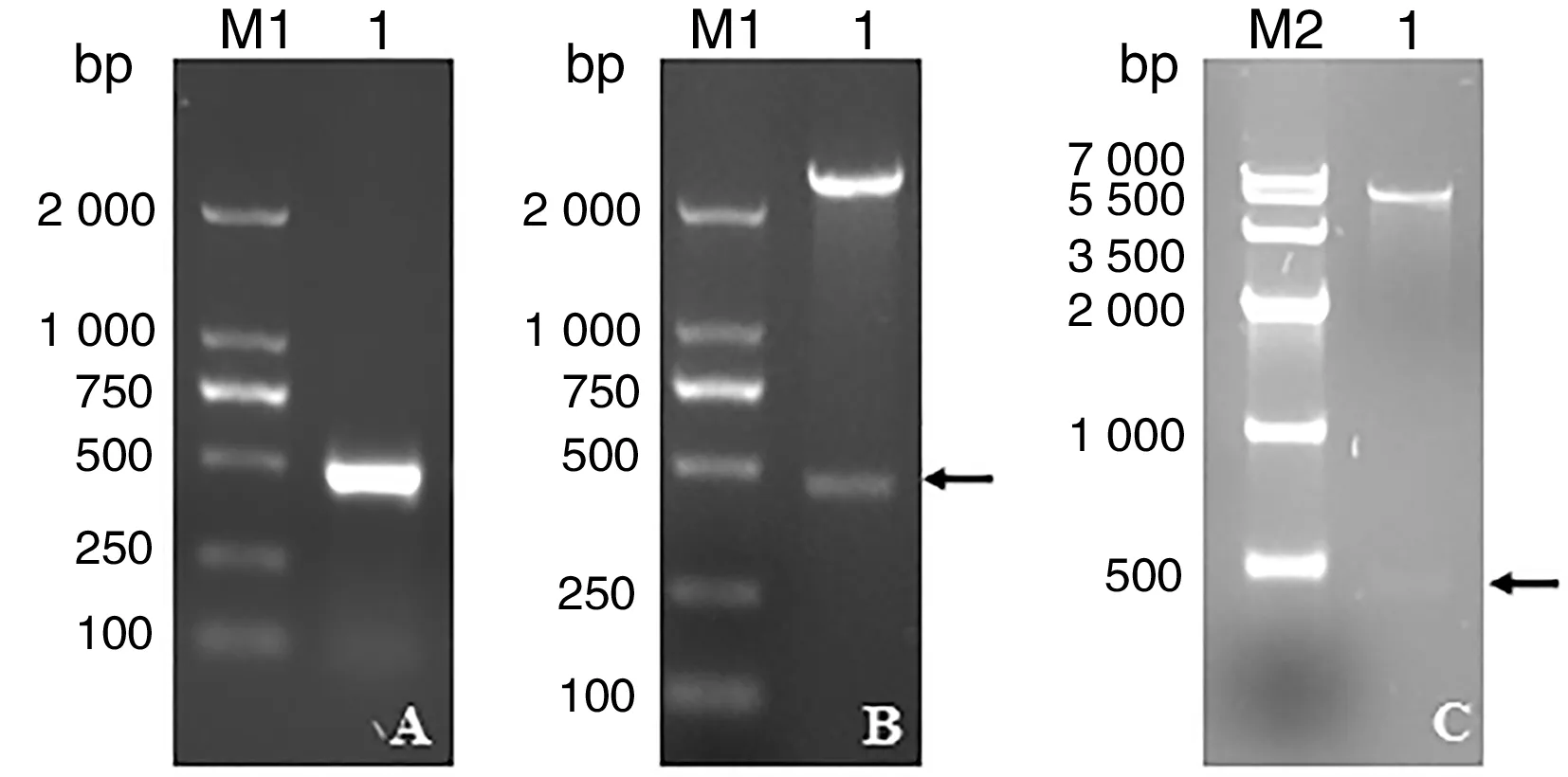
M1和M2,DNA分子质量标准;A,Di-NDPK的PCR产物;B,pMD19-T-NDPK的双酶切鉴定;C,pET32a(+)-NDPK的双酶切鉴定。M1, DL2000; M2, DL7000; A, PCR products of Di-NDPK; B, Identification of recombinant plasmid pMD19-T-NDPK by restriction endonucleases digestion; C, Identification of recombinant plasmid pET32a(+)-NDPK by restriction endonucleases digestion.图3 Di-NDPK基因的RT-PCR产物及重组质粒的酶切鉴定Fig.3 PCR products of Di-NDPK gene and plasmid by restriction endonucleases digestion

M,蛋白质分子质量标准;A,rDi-NDPK蛋白的表达,1,经IPTG诱导的含有pET32a(+)-NDPK的细菌;2、3,未经IPTG诱导的含有pET32a(+)-NDPK的细菌;4,经IPTG诱导的含有pET32a(+)的细菌。B,rDi-NDPK蛋白的纯化及免疫印迹,1,纯化后的rDi-NDPK;2,rDi-NDPK的免疫印迹。M, Protein marker; A, The expression of rDi-NDPK, 1, pET32a(+)-NDPK induced by IPTG; 2, 3, pET32a(+)-NDPK without IPTG induction; 4, pET32a(+) induced by IPTG; B, Purification of rDi-NDPK and Western blotting analysis, 1, Purified rDi-NDPK; 2, Western blotting analysis of rDi-NDPK.图4 rDi-NDPK的表达、纯化及免疫印迹分析Fig.4 The expression and purification of recombinant protein NDPK and Western blotting analysis
2.3 rDi-NDPK的表达、纯化及免疫印迹
经过条件优化显示,温度37 ℃,时间6 h,IPTG浓度为1.0 mmol·L-1是rDi-NDPK原核表达的最佳条件。rDi-NDPK经12%SDS-PAGE电泳,得到约35 ku的蛋白,与预期条带大小相同(图4-A)。原核表达的重组菌,超声破碎后经可溶性分析,该蛋白以上清的形式存在。经镍柱亲和层析柱纯化后的rDi-NDPK条带单一,显示纯度较好(图4-B)。免疫印迹分析,显示rDi-NDPK能与自然感染犬恶丝虫的犬阳性血清特异性结合,证明rDi-NDPK具有良好的反应原性(图4-B)。
2.4 Di-NDPK的免疫荧光定位
间接免疫荧光显示,Di-NDPK主要分布于雌性犬恶丝虫成虫的肠上皮细胞和肠腔,尤其在肠上皮细胞中大量分布,且分泌至肠腔中,在侧索有少量分布(图5-A、B)。Di-NDPK在雄性犬恶丝虫成虫的侧索、肌肉细胞和肠腔均广泛分布(图5-C、D)。
2.5 ELISA
间接ELISA结果显示,最佳血清稀释度为1∶20,最佳抗原包被浓度为0.58 μg·孔-1。在最佳血清稀释度和抗原包被浓度条件下,临界值为0.498。用建立的间接ELISA方法检测24份犬恶丝虫阳性血清,结果显示,16份阳性血清D值>临界值,8份阳性血清D值<临界值,敏感性为66.7%(图6-A)。但与犬细粒棘球蚴病阳性血清、犬钩虫病阳性血清以及犬弓首蛔虫病阳性血清发生交叉反应,特异性为38.9%(图6-B)。批内重复性试验结果显示,批内平均变异系数为1.5%,批间重复性试验结果显示,批间平均变异系数为6.9%。批内和批间变异系数均小于10%,证明该方法具有良好的重复性。
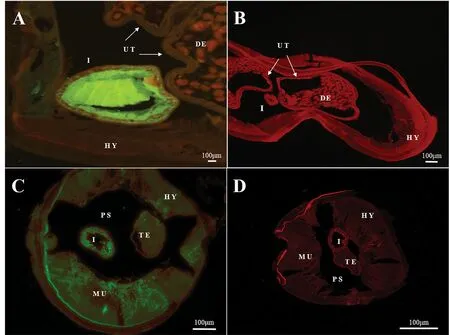
A,雌虫阳性;B,雌虫阴性对照;C,雄虫阳性;D,雄虫阴性对照;HY,侧索;I,肠;TE,睾丸;PS,假体腔;MU,肌肉;UT,子宫;DE,胚胎。A, Female positive; B, Female negative control; C, Female positive; D, Female negative control; I, Intestines; PS, Pseudocoelom; UT, Uterus; MU, Muscle; HY, Hypodermis.图5 雌性犬恶丝虫成虫横切面Di-NDPK蛋白的间接免疫荧光定位Fig.5 Tissue localization of adult female and male D. immitis NDPK protein detected by indirect immunofluorescence
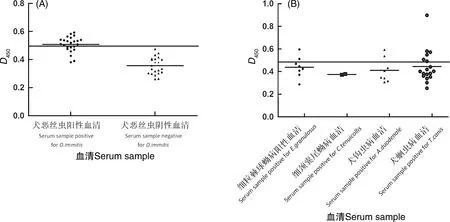
A,ELISA临床试验分析;B,ELISA交叉反应试验分析。实线代表cut-off值0.498。A, Clinical trial of the iELISA; B, The cross-reaction of the iELISA. The bold horizontal line indicates the cut-off value, which was 0.498.图6 重组Di-NDPK间接ELISA分析Fig.6 Indirect ELISA using rDi-NDPK as the antigen
3 讨论
NDPK存在于多种生物物种,在进化过程中高度保守[7, 18]。Di-NDPK的氨基酸序列与罗阿丝虫等不同线虫物种的NDPK氨基酸序列相似性高达70%以上。同时,对Di-NDPK蛋白的二级结构预测发现,该蛋白含有一个细胞黏附序列,即RGD序列(aa106-108),氨基酸相似性比较分析发现,该序列与其他寄生虫的氨基酸序列完全一致。此外,Di-NDPK蛋白还存在一个核苷二磷酸激酶活性位点(aa116-124),仅与马来丝虫的同源氨基酸序列位点有1个氨基酸差异,与普遍公认的NDP磷酸化序列(HGSDSV)也非常一致。其次,RGD序列紧密靠近NDPK活性位点,有可能RGD序列的Arg(R)残基在底物结合到活性位点裂口的位置中扮演着重要作用。Di-NDPK的C-端残基是YE,几种线虫的氨基酸相似性分析发现,这几种线虫的C-端残基也都是YE,非常保守,与大多数的NDPK以Y、YE、YET残基结尾较一致,与报道的恶性疟原虫的C-端残基ICS不同,这些残基对于NDPK的二聚是非常重要的[5, 8]。此外,由于Di-NDPK氨基酸序列中存在Lys12,与人类的Lys12一致,所以Di-NDPK可能有与DNA结合的活性[5]。
免疫印迹分析发现,rDi-NDPK能够被自然感染犬恶丝虫的犬阳性血清所识别,提示阳性血清中具有同Di-NDPK特异性结合的抗体,同时说明rDi-NDPK具有良好的反应原性。在对马来丝虫NDPK研究中也发现,人携带马来丝虫的慢性无症状的患者血清中NDPK特殊的IgG能被检测出[8]。其次,NDPK在利什曼原虫、旋毛虫和捻转血矛线虫中已被确认存在其分泌蛋白产物中[11, 14, 16, 22]。作为分泌蛋白,通常暴露在宿主的免疫系统下,具有潜在的免疫学诊断价值。
犬恶丝虫病的常规诊断方法主要有病原检测,血清学检测和分子生物学检测[23]。目前,血清学检测是最常用的检测方法,分为抗原检测和抗体检测。抗原检测的假阴性结果常见于轻微感染、雌虫尚未成熟、仅感染雄虫等情况;抗体检测较抗原检测的优势在于,不论雌虫还是雄虫都能检测出来。宿主感染犬恶丝虫2个月后,幼虫刺激机体所产生的免疫反应就能被检测出来,抗体检测比抗原检测能更早地检测出犬恶丝虫,适用于犬恶丝虫病的早期检测[24]。目前,已报道的重组抗原DGK、MTFP具有较高的敏感性和特异性,适合用于犬恶丝虫病的诊断,同时,一些敏感性和特异性低的重组抗原,不适合作为诊断抗原[25-26]。本实验结果显示,rDi-NDPK敏感性为66.7%,特异性为38.9%,同时与犬细粒棘球蚴病血清、犬细颈囊尾蚴病血清、犬钩虫病血清和犬弓首蛔虫病血清的交叉反应。因此,rDi-NDPK蛋白不适合用于犬恶丝虫病的诊断。
研究发现,嗜血性寄生虫(如犬恶丝虫)肠上皮细胞的“隐藏抗原”能被宿主的免疫应答机制所识别,但它们通常不会暴露在宿主的免疫系统之下,因此,与分泌排泄抗原或传统的暴露在虫体表面的抗原相比,肠上皮细胞的“隐藏抗原”更适合做寄生虫的重组蛋白疫苗[27]。对Di-NDPK的免疫荧光定位研究发现,NDPK蛋白分布在侧索及肠上皮细胞和肠腔中,尤其在肠上皮细胞和肠腔中有大量的NDPK存在,说明NDPK可能主要分泌到犬恶丝虫的肠腔中,是其肠上皮细胞的“隐藏抗原”。其次,对兔抗rDi-NDPK抗体检测显示,rDi-NDPK具有良好的免疫原性,与马来丝虫和利什曼原虫报道的结果一致[8, 16]。因此,我们推测Di-NDPK可能是一个犬恶丝虫的候选疫苗基因,其免疫保护效果还有待进一步的验证。

