基于主成分分析及隶属函数法的巨菌草幼苗耐盐碱性评价
闫晶秋子,李钢铁,*,刘玉军,麻云霞,杨 颖
(1.内蒙古农业大学 沙漠治理学院,内蒙古 呼和浩特 010018; 2.通辽市奈曼旗林业局兴隆沼林场,内蒙古 通辽 028300)
盐碱地土壤含盐量高、碱度大、物理结构差、养分缺乏,不利于植物生长,甚至会造成植株死亡,严重影响农林业生产和土地绿化[1]。我国盐碱地总面积9 913万hm2,约占全国土地面积的10%[2]。筛选适应盐碱土环境生长发育的植物对于充分利用盐碱地、改善生态具有积极作用。
巨菌草(PennisetumgiganteumZ. X. Lin)原产于非洲,隶属禾本科(Gramineae)狼尾草属(Pennisetum),为多年生C4植物,直立、丛生,株高一般为300~580 cm,根系发达,分蘖能力强,年产鲜草200 t·hm-2以上[3]。前人对草类抗盐碱性的研究大多集中于苜蓿(Medicagosativa)、高羊茅(Festucaelata)、芨芨草(Achnatherumsplendens)、草坪草、羊草(Leymuschinensis)、赖草(Leymussecalinus)等[4-6],关于巨菌草的研究大多集中在饲草料[7]、留茬沙帐[8-10]、抗旱性[11]等方面,关于其对盐碱环境的适应性鲜有报道。本文从巨菌草幼苗耐盐碱指标着手,对其幼苗的生理生化指标做相关性和主成分分析,筛选出主要影响指标,并采用隶属函数法对生长在不同盐碱环境下的巨菌草幼苗进行抗盐碱性评价,旨在确定适宜巨菌草生长发育的盐碱区域,为相关研究及生产应用提供参考。
1 材料与方法
1.1 试验材料
2018年4月从福建引种巨菌草,栽植于内蒙古农业大学温室内。截取长势相同的芽结,种植在直径20 cm、高20 cm的花盆内(带托盘),土壤基质为河砂。选取生长状况良好、高度一致的幼苗供试验使用。
1.2 试验设计
参考试验地盐碱土主要成分和前人研究[12-14],对内蒙古高原干旱-半漠境草原盐渍区的土壤盐碱化类型进行人工模拟。利用NaCl、Na2SO4、NaHCO3和Na2CO3等4种单盐,设计不同比例,称取相应物质的量配比的单盐进行混合,以模拟巨菌草所受的混合盐碱胁迫。共设计5个处理组(A~E):A组溶液中仅用NaCl和Na2SO4,两者浓度比为1∶1,B组采用NaCl、Na2SO4和NaHCO3,三者在溶液中的浓度比为1∶2∶1,C~E组溶液中NaCl、Na2SO4、NaHCO3、Na2CO3的浓度比分别为1∶9∶9∶1、1∶1∶1∶1、9∶1∶1∶9,每个处理组都按照相应的各组分比例,配制混合盐碱总浓度分别为30、60、90、120、180 mmol·L-1的溶液用于试验。另设置不加任何处理的对照组(CK)。每个处理设置3个重复,每重复1盆苗。
待巨菌草幼苗长至三对叶后,选取长势相同的幼苗进行试验。每天上午8:00—9:00进行胁迫处理。为确保盐分总量不变,每盆浇灌量为河砂田间持水量的2倍(200 mL),同时在每个花盆的底部放置托盘,防止盐分流失。CK浇灌同体积的pH值为6.8的蒸馏水。共胁迫处理7 d,利用称重法控制土壤含水量。7 d后,摘取相同部位的功能叶,在液氮环境下带回实验室,测定各项生理指标。
1.3 指标测定及方法
参照文献[15-18]的方法测定各指标,简述如下:株高生长量(H),卷尺测量法;含水量(MC)、相对含水量(RWC)、水分饱和亏(WSD),烘干称重法;丙二醛含量(MDA),硫代巴比妥酸法;过氧化氢酶活性(CAT),紫外吸收法;超氧化物歧化酶活性(SOD),氮蓝四唑还原法;可溶性糖含量(SS),蒽酮比色法;游离脯氨酸含量(Pro),酸性茚三酮比色法;可溶性蛋白含量(SP),考马斯亮蓝G-250法;叶绿素含量(Chl),包括叶绿素a(Chla)和叶绿素b(Chlb),分光光度法。
1.4 数据处理
采用WPS 2011软件对所有试验数据进行整理,在SPSS 20.0平台上进行相关性分析和方差分析,利用主成分分析和模糊数学隶属函数法[19]评价抗盐性。
2 结果与分析
2.1 不同处理对巨菌草生理生化指标的影响
如图1所示,随盐碱浓度增加,5个处理组中巨菌草的株高生长量均呈现下降趋势,且除了B组30 mmol·L-1处理下巨菌草的株高生长量与对照无显著差异外,其余各处理的巨菌草株高生长量均与对照呈现出显著(P<0.05)差异。与CK相比,株高生长量下降最大的是B组180 mmol·L-1处理,降幅达68.23%。

同一处理组不同柱上无相同字母的表示差异显著(P<0.05)。Bars marked without the same letters in the same test group indicated significant difference at P<0.05.图1 各处理下巨菌草幼苗生理生化指标的变化Fig.1 Changes of physiological and biochemical indexes in seedlings of Pennisetum giganteum Z. X. Lin under different treatments
整体来看,5个处理组中巨菌草的相对含水量均随盐碱浓度的增加逐渐减小,除A、B、C组中30、60 mmol·L-1处理下巨菌草的相对含水量与CK无显著差异外,其余处理下巨菌草的相对含水量与CK均呈显著(P<0.05)差异。C组120 mmol·L-1处理下,巨菌草失水量最大,与对照相比下降79.4%。在A、B、C组模拟条件下,从相对含水量来看,巨菌草可以抵御一定浓度的盐碱胁迫,但当盐碱浓度过大后,巨菌草仍会大量失水。
除B组各盐碱浓度处理下巨菌草的丙二醛含量均显著(P<0.05)高于对照外,其余各组不同盐碱浓度处理下巨菌草的丙二醛含量变化并不一致。从过氧化氢酶活性来看,各组别不同盐碱浓度处理下的变化并无明显规律。A组各处理间无显著差异;B组在30、60、120 mmol·L-1处理下,巨菌草的过氧化氢酶活性较CK显著(P<0.05)增强;C组在60、90、120 mmol·L-1处理下,巨菌草的过氧化氢酶活性较CK显著(P<0.05)增强;D、E组在120、180 mmol·L-1处理下,巨菌草的过氧化氢酶活性较CK显著(P<0.05)增强,在30 mmol·L-1处理下,巨菌草的过氧化氢酶活性较CK显著(P<0.05)降低。
各处理组中随盐碱浓度增加,巨菌草超氧化物歧化酶活性的变化程度也不统一。A组仅在120 mmol·L-1处理下,巨菌草的超氧化物歧化酶活性较CK显著(P<0.05)增强;B组在90、180 mmol·L-1处理下,巨菌草的超氧化物歧化酶活性较CK显著(P<0.05)增强;C组在60、120 mmol·L-1处理下,巨菌草的超氧化物歧化酶活性较CK显著(P<0.05)下降;D组各处理下巨菌草的超氧化物歧化酶活性均较CK显著(P<0.05)下降,且较高浓度(90~180 mmol·L-1)处理下的巨菌草超氧化物歧化酶活性还显著(P<0.05)低于较低浓度(30~60 mmol·L-1)处理;E组除120 mmol·L-1处理下巨菌草的超氧化物歧化酶活性较CK显著(P<0.05)增强外,其余处理的巨菌草超氧化物歧化酶活性均较CK显著(P<0.05)降低。
随盐碱浓度增加,5个处理组中巨菌草可溶性糖含量变化程度不一,除B组120 mmol·L-1处理和D组60、180 mmol·L-1处理与CK不存在显著性差异外,其余各处理的巨菌草可溶性糖含量均与CK呈显著(P<0.05)差异。除D组外,各组均在180 mmol·L-1处理下巨菌草的可溶性糖含量最高,这可能是因为在高盐碱胁迫下,巨菌草通过增大自身可溶性糖含量来维持渗透压平衡,保护自身免受盐碱胁迫的伤害。
各处理组中随盐碱浓度增加,巨菌草游离脯氨酸含量整体呈先缓慢增加后急剧上升的趋势,除B组30、60 mmol·L-1处理下巨菌草的游离脯氨酸含量与CK无显著差异外,其余各处理较CK均显著(P<0.05)增加。这可能是因为,在高浓度盐碱处理下,巨菌草主要通过积累游离脯氨酸来应对盐碱胁迫。
随盐碱浓度增加,各处理组巨菌草的可溶性蛋白含量变化不一。A组在60、90、120 mmol·L-1处理下,巨菌草的可溶性蛋白含量较CK显著(P<0.05)增加;B组在90、180 mmol·L-1处理下,巨菌草的可溶性蛋白含量较CK分别显著(P<0.05)降低和增加;C组在60、90、180 mmol·L-1处理下,巨菌草的可溶性蛋白含量较CK显著(P<0.05)增加;D组除30 mmol·L-1处理外,其余各处理下巨菌草的可溶性蛋白含量较CK均显著(P<0.05)增加;E组除120 mmol·L-1处理下巨菌草的可溶性蛋白含量较CK显著(P<0.05)增加外,其余处理与CK均无显著差异。
随盐碱浓度增加,各处理组巨菌草叶绿素含量均表现出先上升后急剧下降的趋势,暗示低浓度的盐碱胁迫可促进巨菌草的光合作用,但过高的盐碱浓度会抑制巨菌草的光合作用。
2.2 各生理生化指标间的相关性分析
选择上述试验的各指标两两配对,分别计算其在不同试验组别下的相关系数,结果如表1所示。其中,MC与RWC、MC与Chl、MC与Chla、MC与Chlb、RWC与Chl、RWC与Chla、RWC与Chlb、Chl与Chla、Chl与Chlb、Chla与Chlb在各组别下均呈极显著(P<0.01)正相关,MDA与Pro在各组别下呈极显著(P<0.01)或显著(P<0.05)正相关,MC与WSD、RWC与WSD、WSD与Chl、WSD与Chla、WSD与Chlb在各组别下均呈极显著(P<0.01)负相关,Chl与Pro、Chla与Pro、Chlb与Pro在各组别下呈极显著(P<0.01)或显著(P<0.05)负相关。由此可知,在本试验模拟的胁迫环境下,巨菌草幼苗的MC增加,WSD降低。这有利于植株光合色素的积累,从而增强其光合作用,但也在一定程度上加剧了膜脂过氧化的程度。大多数指标对在5个处理组间的显著性表现不统一,说明巨菌草幼苗在适应不同盐碱环境时,体内水分、有机渗透物质和保护酶活性等生理指标的相互作用并不完全统一。
表1 各处理组别下不同指标间的相关系数
Table1Correlation coefficient within physiological and biochemical indexes under different test groups

指标对Index pairABCDE指标对Index pairABCDEH-MC0.4740.1870.930∗∗0.1910.448WSD-CAT0.705∗∗-0.803∗∗-0.2430.5000.750∗∗H-RWC0.635∗0.729∗∗0.878∗∗0.5090.579∗WSD-SOD-0.1290.808∗∗0.926∗∗0.652∗∗-0.004H-WSD-0.634∗-0.728∗∗-0.877∗∗-0.510-0.580∗WSD-Pro0.904∗∗0.710∗∗0.937∗∗0.984∗∗0.422H-Chl0.3690.766∗∗0.3990.3710.294Chl-Chla0.975∗∗0.977∗∗0.999∗∗0.997∗∗0.989∗∗H-Chla0.5130.778∗∗0.4140.3540.187Chl-Chlb0.885∗∗0.947∗∗0.994∗∗0.988∗∗0.885∗∗H-Chlb0.0100.681∗∗0.3630.4020.593∗Chl-MDA-0.817∗∗-0.458-0.520∗-0.473-0.708∗∗H-MDA-0.705∗∗-0.867∗∗-0.630∗∗-0.150-0.439Chl-SP-0.0360.4690.3150.698∗∗-0.029H-SP0.131-0.0310.390-0.2280.311Chl-SS-0.549∗-0.446-0.685∗∗-0.736∗∗0.312H-SS0.296-0.740∗∗-0.764∗∗-0.4250.111Chl-CAT-0.628∗0.753∗∗-0.431-0.531∗-0.773∗∗H-CAT-0.643∗∗0.5000.539∗-0.357-0.606∗Chl-SOD0.015-0.674∗∗-0.516∗-0.632∗-0.331H-SOD0.323-0.535∗-0.964∗∗-0.3240.486Chl-Pro-0.787∗∗-0.746∗∗-0.830∗∗-0.937∗∗-0.543∗H-Pro-0.700∗∗-0.935∗∗-0.714∗∗-0.498-0.414Chla-Chlb.0.761∗∗0.857∗∗0.988∗∗0.974∗∗0.809∗∗MC-RWC0.860∗∗0.773∗∗0.937∗∗0.895∗∗0.956∗∗Chla-MDA-0.848∗∗-0.426-0.559∗-0.494-0.698∗∗MC-WSD-0.783∗∗-0.766∗∗-0.933∗∗-0.883∗∗-0.947∗∗Chla-SP-0.1100.543∗0.2950.737∗∗0.022MC-Chl0.791∗∗0.658∗∗0.662∗∗0.897∗∗0.923∗∗Chla-SS-0.472-0.393-0.715∗∗-0.707∗∗0.420MC-Chla0.821∗∗0.618∗0.680∗∗0.918∗∗0.881∗∗Chla-CAT-0.727∗∗0.629∗-0.399-0.501-0.726∗∗MC-Chlb0.643∗∗0.663∗∗0.621∗0.839∗∗0.936∗∗Chla-SOD0.114-0.657∗∗-0.522∗-0.636∗0.329MC-MDA-0.615∗0.235-0.763∗∗-0.298-0.491Chla-Pro-0.799∗∗-0.683∗∗-0.851∗∗-0.953∗∗-0.516∗MC-SP0.3170.416-0.1400.793∗∗-0.174Chlb-MDA-0.613∗-0.466-0.428-0.419-0.643∗∗MC-SS-0.4580.312-0.887∗∗-0.685∗∗0.122Chlb-SP0.1850.3160.3580.603∗-0.181MC-CAT-0.4860.796∗∗0.310-0.146-0.651∗∗Chlb-SS-0.612∗-0.487-0.614∗-0.785∗∗-0.080MC-SOD0.320-0.838∗∗-0.905∗∗-0.379-0.238Chlb-CAT-0.3180.876∗∗-0.500-0.587∗-0.809∗∗MC-Pro-0.721∗∗-0.258-0.875∗∗-0.905∗∗-0.321Chlb-SOD-0.188-0.642∗∗-0.501-0.611∗-0.288RWC-WSD-0.988∗∗-0.999∗∗-0.999∗∗-0.997∗∗-0.995∗∗Chlb-Pro-0.626∗-0.775∗∗-0.777∗∗-0.885∗∗-0.551∗RWC-Chl0.945∗∗0.977∗∗0.738∗∗0.977∗∗0.917∗∗MDA-SP-0.0660.3360.293-0.639∗-0.421RWC-Chla0.966∗∗0.963∗∗0.751∗∗0.982∗∗0.881∗∗MDA-SS-0.0220.939∗∗0.951∗∗-0.224-0.325RWC-Chlb0.752∗∗0.913∗∗0.704∗∗0.951∗∗0.899∗∗MDA-CAT0.869∗∗-0.276-0.4450.743∗∗0.959∗∗RWC-MDA-0.897∗∗-0.357-0.736∗∗-0.506-0.614∗MDA-SOD0.1940.1460.533∗0.957∗∗0.086RWC-SP0.1150.434-0.2940.663∗∗0.111MDA-Pro0.759∗∗0.873∗∗0.868∗0.530∗0.961∗∗RWC-SS0.359-0.288-0.907∗∗-0.694∗∗0.315SP-SS0.1950.1660.289-0.1680.730∗∗RWC-CAT-0.700∗∗0.803∗∗0.243-0.500-0.750∗∗SP-CAT0.2030.017-0.799∗∗-0.257-0.302RWC-SOD0.136-0.807∗∗-0.926∗∗-0.652∗∗0.005SP-SOD-0.041-0.0380.367-0.582∗0.762∗∗RWC-Pro-0.895∗∗-0.710∗∗-0.937∗∗-0.984∗∗-0.422SP-Pro-0.2200.2060.171-0.704∗∗-0.3146WSD-Chl-0.949∗∗-0.977∗∗-0.738∗∗-0.977∗∗-0.916∗∗SS-CAT-0.199-0.198-0.3450.130-0.180WSD-Chla-0.970∗∗-0.963∗∗-0.750∗∗-0.981∗∗-0.879∗∗SS-SOD-0.424-0.0800.734∗∗0.0180.412WSD-Chlb-0.744∗∗-0.912∗∗-0.703∗∗-0.949∗∗-0.895∗∗SS-Pro0.354-0.759∗∗0.971∗∗0.613∗-0.120WSD-MDA0.907∗∗-0.357-0.736∗∗0.5060.614∗CAT-SOD0.274-0.824∗∗-0.3720.879∗∗0.067WSD-SP-0.004-0.4310.299-0.657∗∗-0.100CAT-Pro0.423-0.694∗∗-0.1350.4080.911∗∗WSD-SS0.369-0.2880.907∗∗0.694-0.315SOD-Pro-0.3770.581∗0.741∗∗0.636∗0.157
*与**分别表示相关性达到显著(P<0.05)与极显著(P<0.01)水平。
* and ** indicated significant correlation atP<0.05 andP<0.01, respectively.
2.3 抗盐碱各指标的主成分分析
主成分分析中的特征根和贡献率是选择主成分的主要依据。对5个处理组13个抗盐碱生理指标进行主成分分析。从表2可以看出,前4个主成分的累积贡献率为82.88%,说明前4个主成分可以很好地反映5个处理组抗盐碱的信息,因此选取前4个主成分作为5个处理组抗盐碱评价的综合指标。结合旋转因子载荷矩阵(表3)可以看出,主成分1的特征值为6.938,由RWC、WDS、Chl、Chla、Chlb、SS和Pro等7个指标构成,代表了总指标53.37%的信息,其中RWC、Chl、Chla和Chlb为正向指标,其余为负向指标;主成分2的特征值为1.699,由SOD这1个指标构成,为负向指标,代表了总指标13.07%的信息;主成分3的特征值为1.082,由SP这1个指标构成,为正向指标,代表了总指标8.32%的信息;主成分4的特征值为1.056,由MDA和CAT两个指标构成,二者均为正向指标,代表了总指标8.12%的信息。上述4个主成分的11个指标可作为巨菌草5个处理组抗盐碱的主要分析指标。
表2 主成分分析
Table2Principal component analysis

成分Component特征值Eigenvalues贡献率Contribution/%累积贡献率CumulativeContribution/%16.93853.3753.3721.69913.0766.4331.0828.3274.7641.0568.1282.8850.7205.5488.4260.6044.6593.0670.3092.3895.4480.2642.0397.4790.1611.2498.71100.0900.6999.40110.0740.5799.97120.0030.0299.99130.001 0.01100
表3 方差旋转因子载荷矩阵
Table3Variance rotation factor load matrix
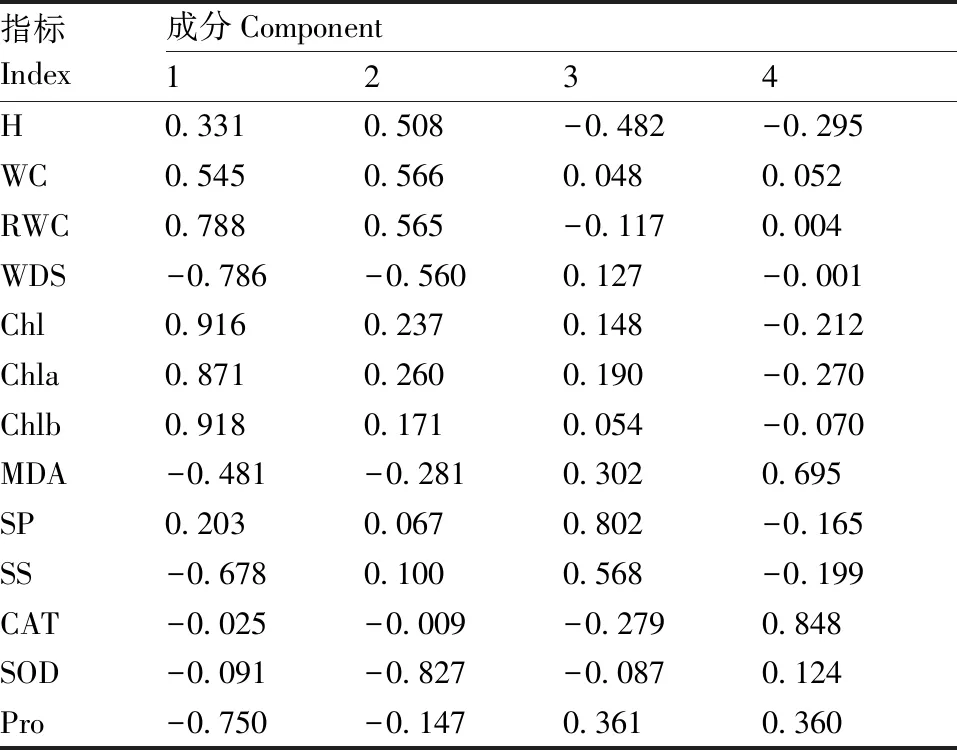
指标Index成分Component1234H0.3310.508-0.482-0.295WC0.5450.5660.0480.052RWC0.7880.565-0.1170.004WDS-0.786-0.5600.127-0.001Chl0.9160.2370.148-0.212Chla0.8710.2600.190-0.270Chlb0.9180.1710.054-0.070MDA-0.481-0.2810.3020.695SP0.2030.0670.802-0.165SS-0.6780.1000.568-0.199CAT-0.025-0.009-0.2790.848SOD-0.091-0.827-0.0870.124Pro-0.750-0.1470.3610.360
2.4 耐盐碱性评价
根据主成分分析的结果,选择主成分1~4中较大的特征向量RWC、WDS、Chl、Chla、Chlb、SS、Pro、SOD、SP、MDA和CAT等11个指标进行隶属函数分析,计算5个处理组下11个指标的各自隶属函数平均值,评价其抗盐碱能力次序(表4)。
在A、C、E组,随盐碱浓度增加,巨菌草的抗盐碱性依次减弱;在B组,各浓度下巨菌草的抗盐碱性由强到弱表现为30 mmol·L-1处理>60 mmol·L-1处理>120 mmol·L-1处理>90 mmol·L-1处理>180 mmol·L-1处理;在D组,各浓度下巨菌草的抗盐碱性由强到弱表现为60 mmol·L-1处理>30 mmol·L-1处理>120 mmol·L-1处理>180 mmol·L-1处理>90 mmol·L-1处理。换言之,仅当组配溶液中NaCl、Na2SO4、NaHCO3、Na2CO3浓度比为1∶1∶1∶1时,巨菌草在60 mmol·L-1的浓度下具有较好的抗盐碱性;在其他处理组下,巨菌草在30 mmol·L-1的浓度下具有较好的抗盐碱性。
3 讨论
巨菌草是禾本科植物,在北方畜牧业中具有广泛的应用前景。但受降雨、地形和蒸发等因素的影响,一些地区的地下水和表层土壤水分失衡,土壤底部的水分带着土壤中的盐分向上运动,长期积累下就使得土壤表层的盐分含量越来越高,造成土壤的盐碱化[19],进而制约了这些地区巨菌草的生长发育。幼苗期是植物对外界环境最敏感的时期,所以苗期的耐盐碱性在一定程度上也能反映植物全生育期的耐盐碱性。
石德成等[12]和程波等[20]在对盐胁迫环境下星星草、苜蓿的生物量进行观测后指出,二者生物量与盐浓度呈反比关系,这与本试验研究结果基本一致。另外,本试验结果说明巨菌草株高生长量对盐碱性环境(B~E组)较为敏感,即使混合盐碱浓度仅为30 mmol·L-1,其生长量与对照相比也存在明显差异。
RWC是植物自身养分运输和水分代谢的主要载体,当土壤中的水分不能维持植株正常生长发育时,植物便会自动调节自身的渗透压,以便从土壤中吸取水分[21-22]。本试验结果表明,在A、B、C组条件下,当混合盐碱浓度为30~60 mmol·L-1时,巨菌草RWC与CK相比并无显著变化,说明巨菌草可通过调节自身的水势营造一个比外界水势更低的环境,保证体内的正常新陈代谢。但当盐碱浓度大于90 mmol·L-1时,巨菌草体内的RWC迅速降低,表明此时巨菌草发生了生理干旱。
表4 不同处理下各指标的隶属函数值及其排名
Table4Membership function values of different indexes and comprehensive ranking under different treatments

处理组Testgroup浓度Concentration/(mmol·L-1)各指标的隶属函数值Membership function valueRWSWDSChlChlaChlbMDASPSSProCATSOD平均值〛Mean排名RankingA300.5240.6330.8610.8420.6670.8550.7250.8420.8840.7110.7490.7541600.6670.2560.7540.7110.7150.7990.4130.7420.7900.7210.7320.6642900.7010.1660.6980.4120.6890.6560.2750.8210.5300.5240.4010.53431200.3190.3110.6400.8520.4201.0000.0000.7640.4980.4950.3660.51541800.4260.3000.7940.6110.6340.6450.2100.4930.7060.3860.3540.5055B300.9450.8630.9240.8640.9121.0000.9830.9220.8410.7030.8640.8931600.8630.4210.8890.7930.7530.8560.8110.7890.8230.8220.7110.7762900.8960.4350.8360.7210.6610.8160.6010.8460.9150.8610.8230.76541200.8610.6030.8250.6210.8420.7410.6580.8680.8000.7500.8920.76931800.2060.3840.6870.6330.2560.2070.1090.4210.0000.4330.3110.3325C300.8030.3680.7940.8460.5330.6720.7110.7160.8970.9110.7140.7241600.8760.4330.5240.6870.4420.7890.8460.7560.7460.9430.7000.7042900.1110.4160.5490.7030.2860.2080.3160.3670.3010.0030.4630.33831200.2670.2510.4840.5220.3000.0680.3260.0180.3010.4550.4210.31041800.3670.3060.4210.5690.2560.2420.1060.3360.2630.1360.3080.3015D300.7160.2310.7060.5110.7220.6770.8410.1380.6010.4970.3940.5492600.8110.3060.7530.5030.6990.7000.8030.2660.7160.5210.4000.5891900.2630.3550.6030.7550.2030.2760.4060.3110.2650.2610.2110.35551200.2810.4000.5160.7060.3590.3160.4160.3470.2090.2410.2000.36331800.3060.3110.5670.6270.4120.5200.2160.4120.2180.2110.1190.3564E300.6980.3190.7450.4050.5110.5350.6640.2680.5260.5160.3570.5041600.5060.4530.6190.5890.4990.5970.7060.3160.3170.4770.3460.4932900.3970.5440.5330.5460.5030.4220.5640.2990.4490.3970.3220.45231200.5960.3120.7150.4220.4770.4610.3790.3060.6000.3110.3410.44741800.3260.3220.6990.3060.3000.3210.3610.3770.1220.2990.2110.3315
表5 各处理组的总体隶属函数值及其排名
Table5Overall membership function values and rankings under different test groups

处理组Test group总体隶属函数值Overall membership function value排名RankingA0.594 2B0.707 1C0.476 3D0.442 5E0.446 4
当植株受到盐碱胁迫时,细胞膜便会发生膜质过氧化反应,产生大量的MDA,植物体内MDA含量越高,说明细胞膜膜质过氧化程度越重,细胞膜受损越严重[22]。阿曼古丽·买买提阿力等[13]和李子英等[23]对海岛棉和柳树进行研究后发现,高盐或高碱的环境都会引起植株细胞膜膜质过氧化的发生,进而抑制植株生长发育。本试验中,随着盐碱程度加深,巨菌草体内的MDA含量整体呈积累趋势,反映出细胞膜的膜质过氧化程度相应加深。

SS、SP、Pro均为植物体内的有机渗透调节物质,当植株处在逆境时,可通过调节自身的有机渗透物质来维持代谢平衡[25]。郭立泉等[26]、杨升等[27]、樊秀彩等[28]的研究表明,植株在低盐碱胁迫时,其自身的SS、SP、Pro均缓慢增长,但随着盐碱胁迫程度加深,抗盐碱性较弱的植物SP含量会骤降,而耐盐性植株的SP含量显著增加。依此来看,本试验中巨菌草在低盐碱的环境下表现出较好的适应性。
植物的抗盐碱性是由多种基因控制的,这些基因相互作用,形成较为复杂的综合性状,其中每一个基因都与植物的抗盐碱性存在一定程度的联系。不同植物对盐碱环境的适应方式不同,有些植物通过几种相关联的机理综合作用共同发挥抗盐碱特性,因此以单一的指标研究植物中的抗盐碱性具有局限性,不能准确全面地评价植物的抗盐碱能力,应从植物整体上全面把握其抗盐碱性[29-31]。但是,判定植物抗盐碱性涉及的生理生化指标较多,且指标之间相互影响。为此,郭栋良等[32]、马彦军等[33]、林兴生等[34]、赵国栋等[35]采用多个抗盐碱生理指标综合评价植物的耐受性,以弥补由单一指标评价出现的片面性,使评定结果接近实际情况。隶属函数分析提供了一条在多指标测定的基础上对材料特性进行综合评价的途径。前人采用隶属函数法对苜蓿的抗旱性进行评价表明,隶属函数分析虽然不是绝对的抗旱分析方法,但通过充分利用多个指标进行综合评价,可克服仅利用少数指标对品种进行评价的不足,更能揭示不同植物或同种植物不同品种间差异的实质,从而提高抗旱鉴定的准确性[36]。胡能兵等[37]对辣椒的抗热性进行评价时,对入选的热害指标赋予不同权重,然后结合隶属度和权重得出辣椒抗热性等级表,增强了研究结果的说服性。本文利用主成分分析法对巨菌草幼苗抗盐碱相关生理指标进行选择,既能把握幼苗的综合性状表现,又能简化选择程序,更具有科学性。主成分分析表明:RWC、WDS、Chl、Chla、Chlb、SS、Pro、SOD、SP、MDA和CAT这11个指标可作为巨菌草幼苗抗盐碱性的主导因素,其累计贡献率达82.88%。筛选出指标后,通过隶属函数法将筛选出的生理生化指标进行平均值比较,采用综合得分对不同盐碱环境下巨菌草幼苗的抗盐碱性做出评价。根据隶属函数值对生长在5种盐碱胁迫环境下巨菌草幼苗的抗盐碱性由强到弱进行排序,结果为B组>A组>C组>E组>D组。

