四川攀枝花地区印度块菌菌根根际土壤内可培养放线菌功能多样性
王田田, 孟小靖, 马沁沁, 雍彬, 苗玉志
四川攀枝花地区印度块菌菌根根际土壤内可培养放线菌功能多样性
王田田, 孟小靖, 马沁沁, 雍彬, 苗玉志*
四川师范大学生命科学学院, 四川成都 610101
以四川攀枝花地区印度块菌菌根根际土壤为对象, 利用4种放线菌分离培养基筛选其中的放线菌, 采用基于16S rRNA 基因的PCR-RFLP方法结合传统的形态学观察进行鉴定。通过测定各分离菌株摇瓶培养发酵液中酶活性或代谢产物获取各菌株降解碳水化合物以及产促生剂的能力, 采用平板对峙法测定各菌株抗病原真菌活性。结果共分离得到125株放线菌, 经形态学观察去重复得到57株(W1-W57), 经多样性分析将其归于3个属的23个种, 其中以链霉菌属最多(91.3%), 功能分析表明: 有23株、17株、15株和18株放线菌能分别降解1,3--葡聚糖、几丁质、纤维素和果胶, 其中有47.8%、26.1%和26.1%的菌株能同时降解4、3和2类碳水化合物; 有19株、3株和2株放线菌分别能产含铁载体、IAA和ACC脱氨酶, 其中有21.7%、56.6%和21.7%的菌株能分别产生3、2和1种根际促生剂; 有10株放线菌表现出对不止一种病源真菌的拮抗能力, 其中菌株W2和W19对4种病源真菌同时具有拮抗活性, 且这2株菌对4种病源真菌抑菌能力比其他菌强; 同时获得了包括W2、W3、W17、W19、W20、W34、W36和W54等在内的多功能高活性菌株, 该研究表明四川攀枝花地区印度块菌菌根土壤内含丰富的多功能放线菌。所获结果可为我国印度块菌人工种植新技术的开发提供新思路。
印度块菌; 根际土壤; 可培养放线菌; 功能多样性
0 前言
块菌属于典型的地下共生菌根真菌, 由于生长过程中菌丝体和共生菌根分泌代谢产物的化感作用, 在其菌根根际土壤中产生了独特的微生物群落, 它们在自然地理因子的胁迫下作用于生境土壤, 形成了具有多重营养功能的生态复合体, 对块菌的生长起着重要作用[1-2]。因而块菌菌根土壤细菌群落功能的研究成为了块菌生物学当前的热点[3]。在块菌菌根土壤细菌群落功能研究中, Antony-Babu等[4]采用温度梯度凝胶电泳(TGGE)和荧光原位杂交(FISH)技术对黑孢块菌(Tuber melanosporum)菌根土壤细菌群落进行了分析, 预测了它们在块菌生长中的重要作用。Picceri等[5]和Gryndler等[6]发现块菌菌根土壤细菌群落同块菌生境中营养组分的变化密切相关, 并且其土壤有效营养的改变依赖不同细菌群落的具体功能。Antony等[7]通过采用时相温度梯度凝胶电泳(TTGE)和功能基因芯片技术(FAGs)对黑孢块菌生境细菌群落及功能研究表明它们在块菌子囊果形成阶段具有提供有效营养、调节共生竞争和促进渗透吸收等重要作用。王冉等[8]将印度块菌(T. inducum)菌根土壤中分离到的细菌与不同浓度的块菌孢子混合接种于华山松上, 揭示了菌根土壤细菌对块菌菌丝生长的显著促进作用。Sbrana等[9]通过联合培养的方法筛选到17株能促进块菌子囊果形成的芽孢杆菌。Alfonso等[10]通过功能菌株分离鉴定以及促生实验, 获得了大量的活性功能菌株, 证实了它们具有促进块菌菌根化和刺激生长等功能。但这些成果缺乏对特定生境块菌菌根土壤细菌群落功能进行系统研究。因而, 块菌特定生长区域菌根土壤功能细菌群落的研究仍需我们去探索。
放线菌属微生物是众所周知的胞外酶生产者, 包括纤维素酶, 葡聚糖酶, 淀粉酶, 蛋白酶, 几丁质酶和其他重要次级代谢产物。大量研究表明, 放线菌广泛分布于不同的土壤生态环境中, 它们通过产生各种功能酶高效调节土壤中有机质的分解或合成, 改善土壤肥力, 促进植物生长[11-13], 这些研究表明放线菌的作用在维持土壤生态功能方面具有非常重要的作用, 表现出极为显著的功能多样性[14]。Barbieri等[15]研究表明在黑孢块菌生境中含丰富的放线菌属微生物, Pavic等[16]从黑孢块菌子囊果中分离到属于放线菌属的萎蔫短小杆菌()和红球菌(sp.)进行了特征化并对其功能研究, 发现它们具有降解几丁质、溶解Ca3(PO4)2、富集铁离子和固氮等功能, 用以提供块菌生长过程中所需营养物质。Goudjal等[17]对沙漠块菌(Tul.)共生放线菌进行了分离, 获得了链霉菌(sp.strain TL7)等7株链霉菌, 对其功能研究表明它们具有抗真菌活性、产铁载体活性以及调控和促进植物生长等作用。这些研究表明块菌生境中的放线菌都具有特定的功能作用。
四川攀枝花是中国块菌产区的天然分布中心区域, 是中国块菌之乡, 其中印度块菌是其目前产量最大且分布最广的块菌种类[18], 其菌根根际土壤细菌群落已经得到广大科研工作者的研究[19-20], 但均未涉及特定功能放线菌。因此, 有必要开展该地区块菌菌根根际土壤中可培养放线菌功能的研究。本文以四川攀枝花地区印度块菌菌根根际土壤为对象, 利用4种放线菌分离培养基筛选放线菌, 采用基于16S rRNA基因的PCR-RFLP方法结合传统的形态学观察进行鉴定, 通过测定各分离菌株摇瓶培养发酵液中酶活性或代谢产物获取各菌株降解碳水化合物以及产促生剂的能力, 采用平板对峙法测定各菌株抗病源真菌活性, 所获结果可为我国印度块菌人工种植新技术的开发提供新思路及提供工业化的微生物资源。
1 材料与方法
1.1 材料
1.1.1 样品采集
样品采集分别选择四川攀枝花地区印度块菌产量相对较高的阿拉乡(26°35'02N; 101°66'76E)、中坝乡(26°38'96N; 101°67'01E)、格里坪镇(226°62'66N; 101°51'44E)共计3个代表位点进行土壤样本采集。为保证样本采集的有效性, 通过探测到各位点共生菌根根际土壤附近有成熟块菌子囊果后确定为土壤样本采集菌塘。取样于2017 年11 月22日和23日进行, 每个位点选择3个菌塘, 用无菌小铲于土层深度5—8 cm处分别取约200 g菌根根际土壤混合均匀作为一个位点的土样, 3个位点的土壤样本各取200 g混合后作为代表性样本分装于无菌袋带回实验室立即处理。
1.1.2 主要试剂和仪器
限制性核酸内切酶(I、II和III)、DNA Taq聚合酶和DNA Marker: 上海英俊生物公司; 几丁质: 成都康迪生物公司, N-乙酰-D-氨基葡萄糖和大豆粉: 博奥维新公司生产; 细菌DNA提取试剂盒: 天根生物公司; 其他试剂均为国产分析纯。恒温培养箱(THZ-300): 上海恒科仪器有限公司; 全自动压力蒸汽灭菌器(G154DW): 厦门致微仪器有限公司; PCR仪: 德国耶拿公司; 电泳仪和凝胶成像系统: Bio-RAD公司。
1.1.3 培养基
(1)四种放线菌分离培养基: 高氏1号(g·L-1): 可溶性淀粉20, MgSO4∙7H2O 0.5, FeSO4∙7H2O 0.01, K2HPO40.5, NaCl 0.5, KNO31.0, 琼脂15、Tap Water Yeast琼脂[17]、Waksman培养基和Waksman albumin琼脂[21]; 每个培养基补充50 mg·L-1的制霉菌素和50 mg·L-1萘啶酮酸抑制真菌和其他细菌的生长; (2)产几丁质酶放线菌分离培养基(g·L-1): 胶体几丁质 12.5、蛋白胨 2、K2HPO40.5、KNO31、NaCl 0.5、MgSO4·7H2O 0.5、FeSO4·7H2O 0.01; 产1,3--葡聚糖酶放线菌分离培养基(g·L-1): 燕麦粉 3.0、FeSO4·7H2O 0.01、K2HPO40.1、CaCO30.5、(NH4)2SO40.5、MgSO4·7H2O 0.01、NaNO30.4; 产纤维素酶放线菌分离培养基(g·L-1): CMC 20、Na2HP042.5、KH2P041.5、蛋白胨 2.5、酵母膏 0.5; 果胶酶: 蔗糖 20, 果胶 10, (NH4)2SO40.2, K2HPO40.3, MgSO4·7H2O 0.5。
1.2 放线菌的分离及初筛
各取1 g菌根土壤溶于10 mL无菌水中充分摇匀后按照10-1到10-6进行梯度稀释, 取各稀释梯度100 μL分别涂布于四种不同放线菌分离平板28 ℃培养15 d, 挑取单菌落菌株分别划线涂布各分离平板培养获得单菌落用于初筛。初筛采用形态学观察: 观察放线菌在各平板上的形态以及培养特征并记录; 然后挑取菌体显微涂片, 于普通光学显微镜下观察, 记录各菌株的显微形态, 根据培养特征和显微特征进行分类并去重复, 然后挑取不同菌株制备菌悬液, 用25%的甘油于-20 °C保存备用。
1.3 放线菌多样性分析
1.3.1 基因组提取和16S rRNA扩增
所有菌株基因组的提取采用天根基因组试剂盒并按操作说明进行。16S rRNA扩增引物为27F (AGAGTTTGATCMTGGCTCAG)和1492R(TACGGYTACCTTGTTACGACTT), 扩增体系为: 10× Buffer 2.5 μL, 模板DNA 1 μL, Taq酶(5 U·μL-1) 0.2 μL, dNTPs (2.5 mmol·μL-1) 2 μL, 引物(10 pmol·μL-1)各1 μL, 补水至25 μL。反应条件为: 94 ℃ 5 min, 94 ℃ 30s, 48 ℃ 30 s, 72 ℃ 90 s, 30个循环; 72 ℃ 10 min, 将扩增得到的产物经0.8%琼脂糖电泳检测后用于限制性核酸内切酶酶切。
1.3.2 PCR-RFLP分析
将扩增检测合格的16S rRNA产物用限制性内切酶I、II和III同时酶切: 取各菌株的16S rRNA产物8 μL各加入10 U的3种内切酶, 用缓冲液补充体积到20 μL, 37 °C酶切过夜, 酶切产物用5%琼脂糖电泳(80 V, 3 h)检测, 用Bio-Rad凝胶成像系统拍照保存, 应用NTsys软件分析RFLP酶切电泳谱型并归类, 选取不同RFLP酶切电泳谱型代表菌株的16S rRNA基因序列由擎科生物成都公司测序, 所得序列去除无效序列后在NCBI上利用Blastn程序搜索GenBank核酸蛋白序列数据库相关序列, 确定各类群的种属特性, 选取参比菌株用MEGA6.0构建系统发育树, 提交各菌株序列到Genbank获取登录号。
1.4 降解碳水化合物活性分析
各菌株对块菌生境不同碳水化合物的降解通过测定各菌株裂解真菌细胞壁的组分(几丁质和1, 3--葡聚糖)或者植物来源的土壤材料(纤维素, 果胶)来确定。分别接种各菌株到几丁质酶、1,3--葡聚糖酶、纤维素酶和果胶酶等发酵培养基中, 于28 ℃、180 r·min-1摇瓶培养5 d, 发酵液用于各酶活性测定。
几丁质酶活性测定通过使用Chernin等[22]描述的方法进行; 1,3--葡聚糖酶活性测定通过Mahasneh等[23]描述的方法进行; 纤维素酶活性测定通过Hendrick等[24]描述的方法进行; 果胶分解酶活性测定通过Hankin等[25]描述的方法进行。
1.5 产促生剂能力检测
产吲哚乙酸(IAA)试验采用Ruanpanun等[26]的方法进行; ACC脱氨酶活力测定参考Seleh等[27]的方法进行; 铁载体的生产使用缺铁矿物盐培养基(MM9), 产量测定参照Sadeghi等[28]的方法进行。
1.6 抗真菌活性分析
目标菌采用4株主要浸染植物致病的真菌, 分别为: 黄瓜尖孢镰刀菌(sp), 立枯丝核菌(Kühn), 禾谷镰刀菌()和大豆核盘菌()。参照Bredholdt等[29]的方法进行。
1.7 数据分析
所有实验重复3次, 所得数据采用Excel 2010统计, 用SPSS18.0软件对数据进行显著性分析。
2 结果与分析
2.1 放线菌的分离和多样性
采用放线菌分离培养基, 从四川攀枝花地区印度块菌菌根根际土壤中分离到125株放线菌, 经纯化后再平板培养获得各菌株单菌落, 对各菌株菌落形态和显微涂片观察, 根据各菌株菌落形态和显微结构初筛去重复得到57株放线菌, 对这些菌株编号为W1-W57(见表1)。
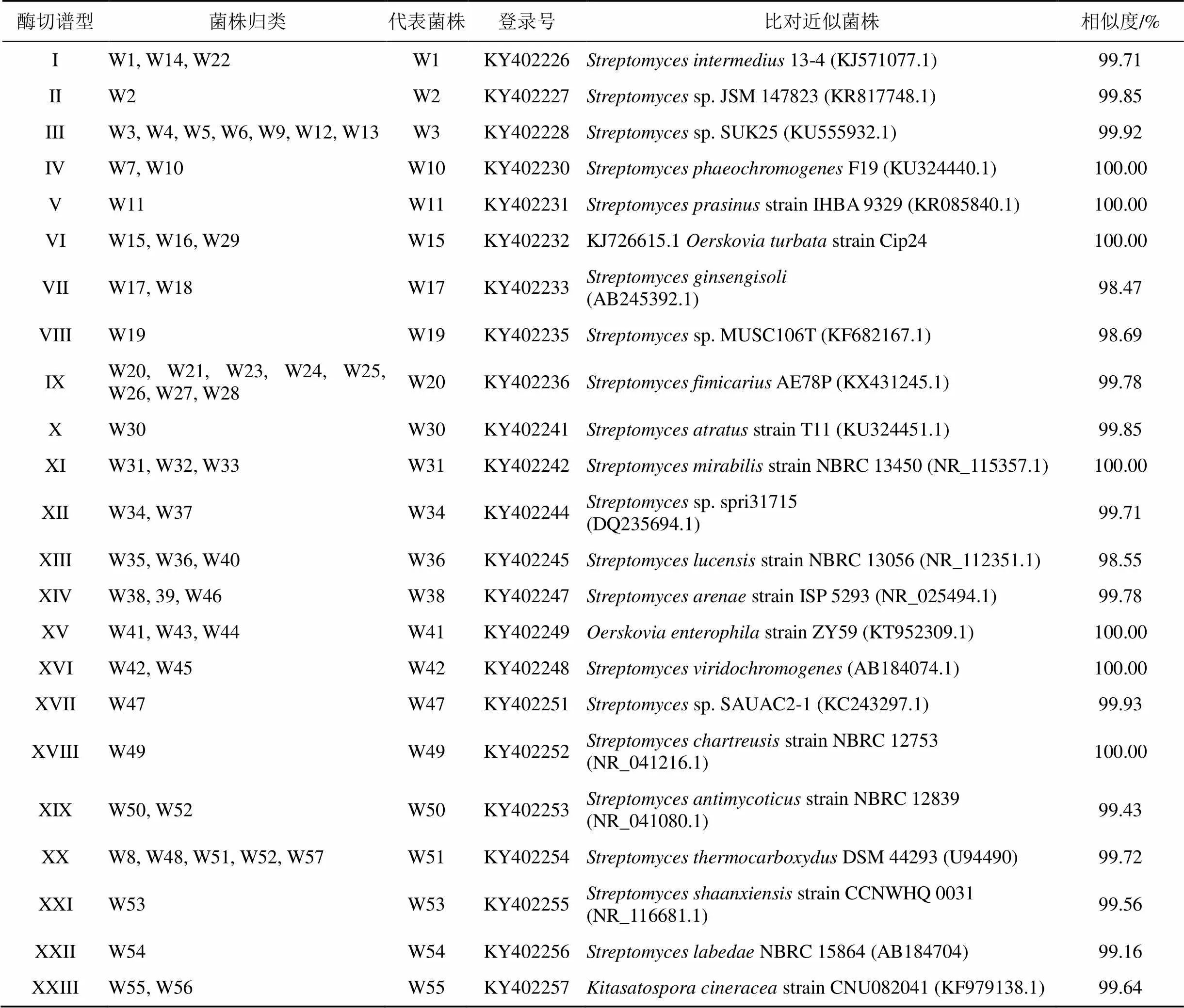
表1 57株块菌菌根土壤放线菌16S rRNA基因的RFLP 分型及亲缘关系

图1 块菌菌根根际土壤放线菌菌株16S rRNA 基因序列的系统发育分析
Figure 1 Phylogenetic analysis of 16S rRNA gene sequences of actinomycetes strains from mycorrhizal soil
用限制性内切酶I、II和III对上述57株菌的16S rRNA 基因进行三酶切后电泳获得酶切图谱, 应用NTsys软件分析将57株放线菌归为23类谱型(见表1)。由于每类谱型的菌株形态特征和分子水平相近, 因而从每个谱型的菌株中随机选取1株代表进行16S rRNA基因测序, 测序结果同NCBI中的核酸序列比对并进行序列相似度分析, 23株放线菌同GenBank数据库中相似性最高的菌株的相似性在98—100%, 其中相似度低于99%的有3株菌, 相似度在99—100%的有13株, 7株菌的相似度为100%, 但没有相似度低于97%的菌株获得(见表1)。
系统发育进化分析显示这些菌株能够被完全区分开, 表明这些菌株间存在不同的遗传多样性, 也表明了一个相对较远的遗传关系(见图1)。23类菌株产生了三个不同的分类单元, 分布于链霉菌属()、北里孢菌属()以及厄氏菌属)共3个属, 其中归于链霉菌属的放线菌21株(91.3%), 另外两个属各仅有1株菌, 基于进化树分析, 23株放线菌被鉴定得到, 并获取登录号(见表1)。
2.2 碳水化合物降解活性
通过分别测定23个代表菌株发酵液中酶产量, 获得各菌株对几丁质、1,3--葡聚糖、纤维素和果胶降解活性见表2。结果表明, 有18株(78.3%)具有产几丁质酶活性, 其产量范围为5.5—30.0 U·mL-1, 产量最高的为W3菌株, 最低为W49菌株; 所有23个放线菌(100%)都表现出对1,3--葡聚糖的降解活性, 其降解程度明显不同, 水平范围从最低的2.92 U·mL-1到最高的35.26 U·mL-1, 降解能力最强的菌株是W34; 有8株菌(34.8%)不具备分解纤维素的能力, 分别为菌株W1、W2、W11、W15、W17、W19、W47和W50, 而其余15株菌(65.2%)具备纤维素降解能力, 菌株W54的降解能力最强为11.43 U·mL-1; 有18株菌(78.3%)具备分解果胶的能力, 有5株菌(21.7%)不能降解果胶, 分别是菌株W01、W02、W20、W30和W41, 果胶酶产量范围为101.44— 4270.0 U·mL-1, 其中菌株W54的果胶酶活性最高为4270.0 U·mL-1, 菌株W19的果胶酶活性最低为101.44 U·mL-1。总体上, 23株可培养放线菌都表现出了不同程度的碳水化合物降解活性, 其中有13株菌(56.5%)同时具备降解几丁质、1,3--葡聚糖、纤维素和果胶的能力, 有6株菌(26.1%)同时具备降解3类碳水化合物的能力。因此, 块菌菌根根际土壤中的放线菌表现出极大的碳水化合物利用活性。
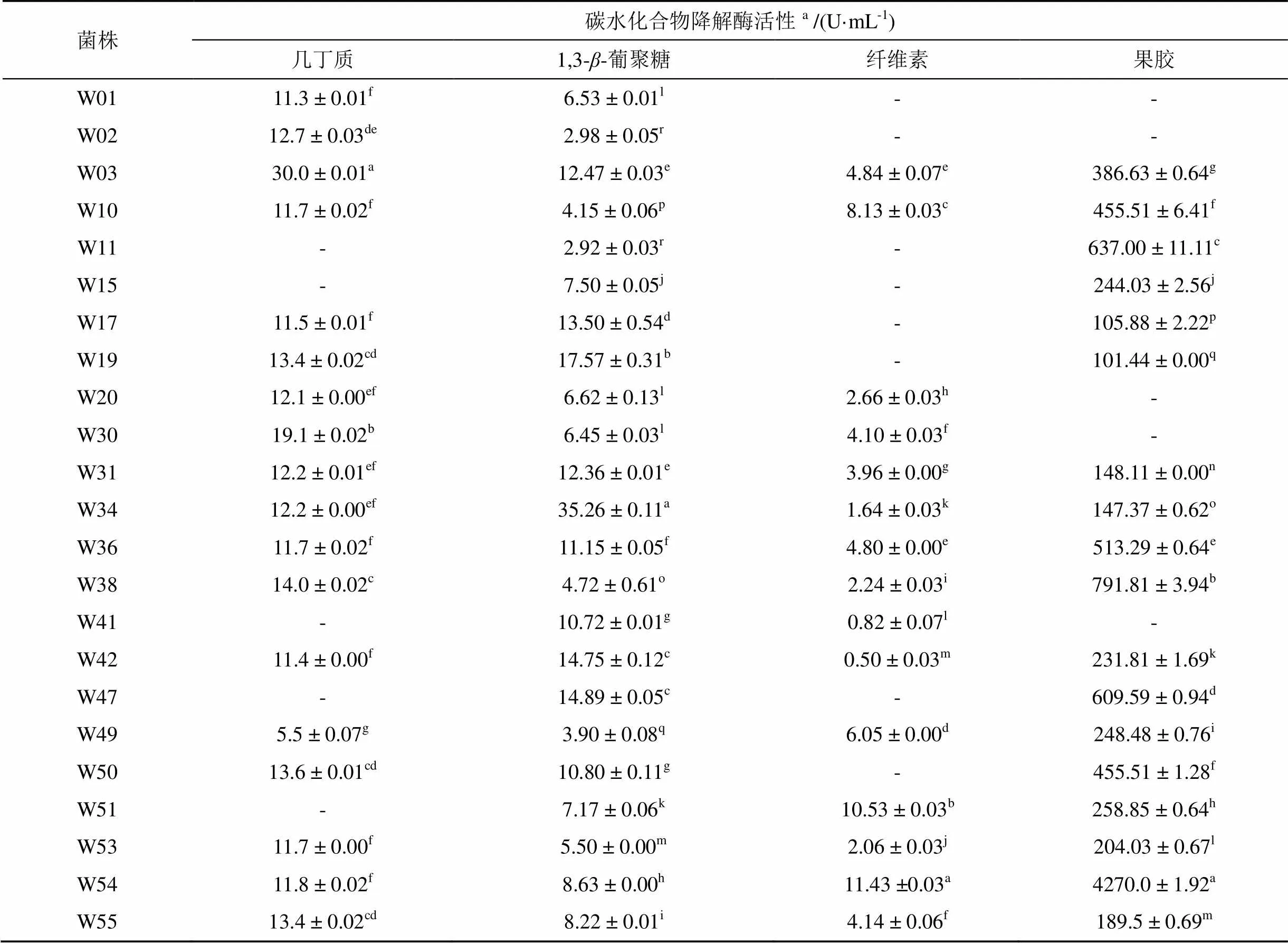
表2 23株块菌菌根土壤放线菌碳水化合物降解活性
注:a表中数据表示平均值±标准偏差; 同列不同字母表示显著差异(LSD,< 0.05), 阴性未检出: -。
2.3 产促生剂活性
各菌株产铁载体活性、IAA、ACC脱氨酶的生产和溶磷能力检测结果见表3。结果表明, 在23个待测菌株中, 19个菌株(82.6%)能够产铁载体活性, 其产量范围为0.86—257.79 μg·mL-1, 菌株W31产量最高; 22个菌株(95.6%)表现出溶解磷酸盐的能力, 其范围为0.26—15.90 μg·mL-1, 菌株W36溶解磷酸盐能力最强; 有W31、W34和W50共3个菌株(13.0%)被发现能够产生IAA, 其生产范围为7.6— 78.1 μg·mL-1, 菌株W31产量最高为97.6 μg·mL-1; ACC脱氨酶的生产仅仅在菌株W31和 W50中被观察到, 其产量分别为57.6 μg·mL-1和45.8 μg·mL-1。总体而言, 本研究中所有23个菌株都表现出产促生剂的能力, 其中5个菌株(21.7%)能同时产3种不同的促生剂, 13个菌株(56.5%)具备产2种不同促生剂的能力, 4个菌株(17.4%)可产1种不同的促生剂, 但没有菌株同时具备产4种促生剂的能力。

表3 23株块菌菌根土壤放线菌产铁载体活性、IAA和ACC脱氨酶
注:a表中数据表示平均值±标准偏差; 同列不同字母表示显著差异(LSD,< 0.05), 阴性未检出: -.
2.4 抗真菌活性
对23株块菌菌根根际土壤放线菌进行了抗真菌活性的初步检测, 发现获得的这些放线菌菌株表现出不同程度的对真菌拮抗能力, 结果见图2和表4。
由图2和表4可知, 其中包括W1、W2、W19、W20、W22和W49共计6株菌(26%)对具有抑制能力, 其抑菌效果明显不同, 其中W19产生的抑菌圈直径为14.1 mm为最大, 其次是菌株W2, 抑菌圈直径为8.3 mm; 同样有W1、W2、W17、W18、W19和W49共计6株菌(26%)对Kühn具有抑制能力, 其中W12产生的抑菌圈直径为23.3 mm最大, 其次是菌株W19, 抑菌圈直径为16.4 mm; 对具有抑制作用的也是6株菌(26%), 分别是W2、W17、W19、W22、W42和W55, 其中W19产生的抑菌圈直径为27.7 mm为最大, 其次是菌株W2, 抑菌圈直径为8.5 mm; 另外, 有3株菌(13%)对f. sp.具有抑制作用, 分别是W2、W19和W49, 但这3株菌对f. sp.的抑制能力较弱, W2产生的抑菌圈直径1.1 mm为最大, 其次是W19为0.7 mm。但发现有2株放线菌(W2和W19)能够同时对这4种植物真菌病原菌产生抑制作用, 有1株放线菌(W49)能够抑制3种植物真菌病原菌, 有3株放线菌(W1、W17和W22)能够抑制2种植物真菌病原菌, 有4株放线菌(W18、W20、W42和W55)能够抑制1种植物病原真菌。其中, 以菌株W2和W19抑菌作用全面而且抑制作用相对最强, 是本试验筛出的促生和生防功能理想菌株。
3 讨论
过去20多年里, 在可控条件下的块菌菌根苗合成技术及应用研究已经取得了相当大的进步, 但人工培育块菌的漫长生长周期和极低的产出一直是困扰块菌产业的难题。现有研究表明块菌菌根根际细菌能够促进菌根苗的合成、块菌菌丝生长和子囊果的产生, 同时还具有对块菌根际植物病原菌的生防作用[2], 而具有高度适应性并生长于菌根根际的放线菌能产生抗生素、多种酶和生长调节剂[30-31], 因此开展块菌自然生境菌根根际放线菌的促生和生防功能研究是实现块菌人工栽培和增产的重要环节[32]。
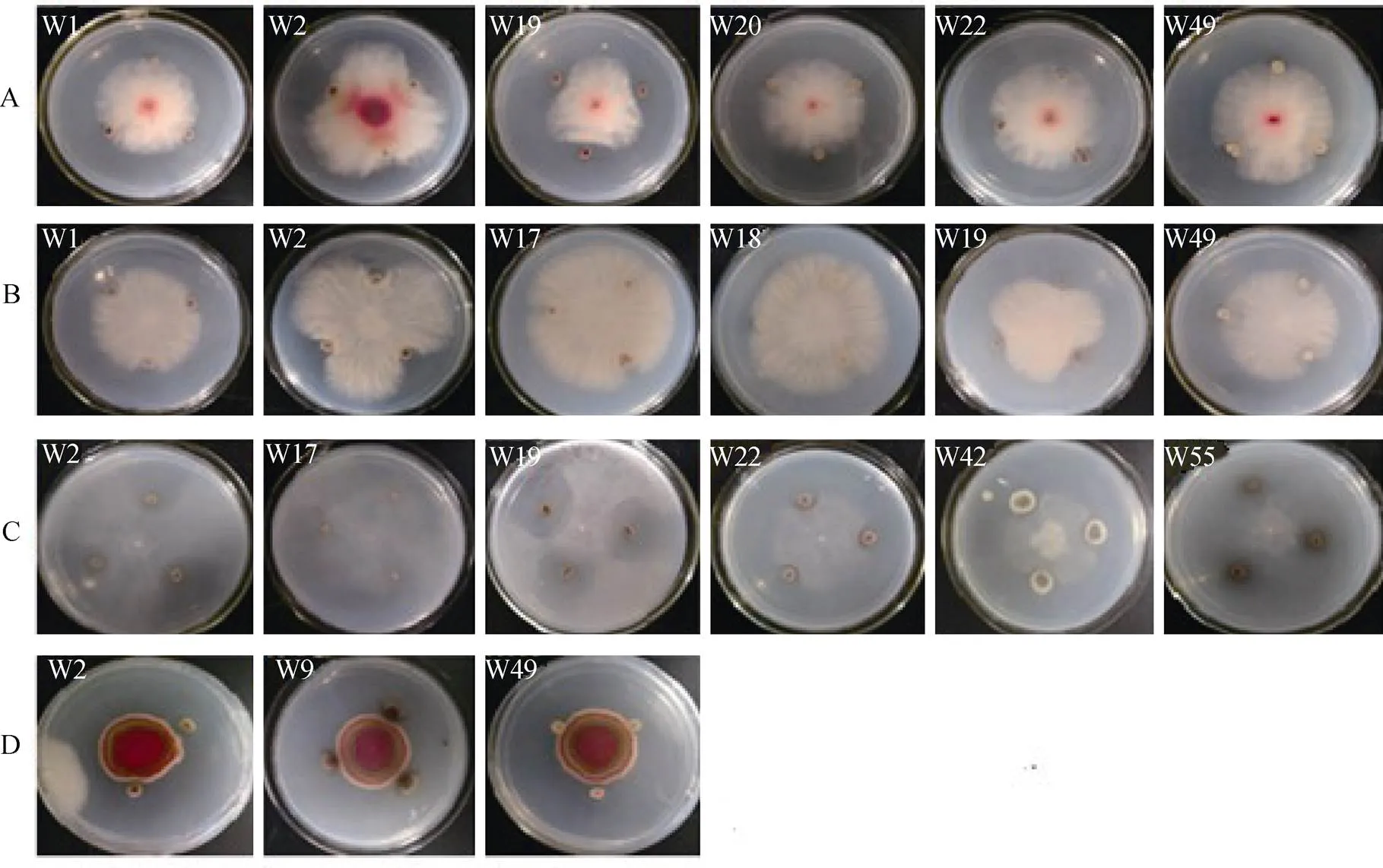
图2 23株块菌菌根土壤放线菌在4种真菌固体培养平板上产生的抑菌圈
Figure 2 Halo of 23 actinomycetes from the truffle mycorrhizal soil on 4 fungal solid media plate. A:B:Kühn, C:D:f. sp.

表4 23株块菌菌根土壤放线菌在4种真菌固体平板上抑菌圈直径
注:a表中数据表示平均值±标准偏差; 同列不同字母表示显著差异(LSD,< 0.05), 阴性未检出: -.
在这一研究中, 采用四种不同放线菌分离培养基从四川攀枝花地区印度块菌菌根根际土壤中共分离到125株放线菌, 基于形态结构和16S rRNA基因序列的进化树分析, 这些菌株归属于23个不同的物种, 分布于链霉菌属()、北里孢菌属()以及厄氏菌属)三个属, 该结果明显多于Pavic等报道的从黑孢块菌生境中分离到2株放线菌[16]以及Goudjal等报道的从沙漠块菌生境中分离到链霉菌属的7株放线菌[17], 但明显比来源于其它类型土壤放线菌分离结果少[33], 这表明块菌菌根根际土壤中放线菌物种多样性同块菌生境及形成的菌根共生体的存在密切相关。另外, 我们分离到的北里孢菌属以及厄氏菌属作为块菌根际土壤放线菌, 在以前的研究中未见报道[34-35], 这进一步表明块菌菌根根际土壤放线菌的特异性。
迄今为止, 虽然有大量关于块菌菌根根际土壤细菌及其功能的研究, 但是针对特定生境块菌菌根根际放线菌功能的系统研究还未见报道[4, 36]。本研究通过对所分离获得的放线菌菌株及其功能进行系统分析, 分别获得了具有能分解纤维素和果胶, 产铁载体活性、IAA和ACC脱氨酶的菌株; 并获得同时降解不同多糖类物质, 产多种植物根际促生剂和拮抗真菌的多功能高活性菌株, 这些数据表明放线菌可能是攀枝花地区印度块菌生长的一类重要菌根根际促生菌, 这是在已经报道的块菌根际促生菌的基础上的一个很好补充[4, 10, 16-17]。
虽然土壤和气候条件对块菌生长的重要性已经得到广泛的认同[37-39], 但是块菌栽培的不完全成功揭示了块菌根际促生菌在这一过程中的重要性[40]。毫无疑问, 进行块菌促生菌株有关营养交换和吸收的功能研究将为真菌-细菌-宿主植物间的相互作用提供一个直接的证据[41-42]。但是, 不同生境块菌菌根根际土壤细菌群落和功能及同块菌生长相关性的研究仍需要我们去探索。此外, 如何将块菌菌根土壤中的促生菌有效构建到块菌人工培育体系中以真正实现模拟自然生境的块菌人工栽培仍是下一步研究的重要工作。
4 结论
本研究从四川攀枝花地区印度块菌菌根土壤中共分离到125株放线菌, 经形态学观察去重复得到57株(W1—W57), 经多样性分析将其归于3个属的23个种, 其中以链霉菌属最多(91.3%), 功能分析表明: 有23株、17株、15株和18株放线菌能分别降解1,3--葡聚糖、几丁质、纤维素和果胶, 其中有47.8%、26.1%和26.1%的菌株能同时降解4、3和2类碳水化合物; 分别有19株、3株和2株放线菌分别能产铁载体、IAA和ACC脱氨酶, 其中有21.7%、56.6%和21.7%的菌株能分别产生3、2和1种根际促生剂; 有10株菌表现出对不止一种病源真菌的拮抗能力, 其中菌株W2和W19对4种病源真菌同时具有拮抗活性, 且这2株菌对4种病源真菌抑菌能力比其它菌强; 同时获得了包括W2、W3、W17、W19、W20、W34、W36和W54等在内的多功能高活性菌株。该研究表明四川攀枝花地区印度块菌菌根土壤含丰富的放线菌, 且这些放线菌均表现出一种或多种功能活性, 所获结果可为我国印度块菌人工种植新技术的开发提供新思路。
[1] BARBIERI E, CECCAROLI P, SALTARELLI R, et al. New evidence for nitrogen fixation within the Italian white truffle[J].Fungal Biology, 2010, 114(11/ 12): 936–942.
[2] MARJANOVIC Ž, GLISIC A, MUTAVDZIC D, et al. Ecosystems supportingPico production in Serbia experience specific soil environment seasonality that may facilitate truffle lifecycle completion[J]. Applied Soil Ecology, 2015, 95(9): 179–190.
[3] NAVARRORODENAS A, BERNA LM, LOZANOCARRILLO C, et al. Beneficial native bacteria improve survival and mycorrhization of desert truffle mycorrhizal plants in nursery conditions[J]. Mycorrhiza, 2016, 26(7): 769–779.
[4] ANTONY-BABU S, DEVEAU A, VAN J D, et al. Black truffle-associated bacterial communities during the development and maturation ofascocarps and putative functional roles[J]. Environmental Microbiology, 2014, 16(9): 2831–2847.
[5] PICCERI G G, LEONARDI P, IOTTI M, Gallo M, et al. Acteria-produced ferric exopolysaccharide nanoparticles as iron delivery system for truffles ()[J]. Applied Microbiology and Biotechnology, 2018, 102(3): 1429– 1441.
[6] GRYNDLER M, SOUKUPOVA L, HRSELOVA H, et al. A quest for indigenous truffle helper prokaryotes[J]. Environmental Microbiology Reports, 2013, 5(3), 346–352.
[7] SORRENTINO E, SUCCI M, TIPALDI L, et al. Antimicrobial activity of gallic acid against food-relatedstrains and its use as biocontrol tool toimprove the shelf life of fresh black truffles[J].International Journal of Food Microbiology, 2018, 266, 183–189.
[8] 王冉, 刘培贵, 万山平, 等. 印度块菌()菌根促生细菌的研究[J]. 微生物学通报, 2015, 42(12): 2366–2376.
[9] S BRANA C, AGNOLUCCI M, BEDINI SDiversity of culturable bacterial populations associated toectomycorrhizas and their activity onmycelial growth[J]. Fems Microbiology Letters, 2002, 211(2), 195–201.
[10] ALFONSO N R, LUIS M B. Beneficial native bacteria improve survival and mycorrhization desert truffle mycorrhizal plants in nursery conditions[J]. Mycorrhiza, 2016, 26(7): 769–779.
[11] 宋漳. 不同林分土壤放线菌的分布及其与土壤因子的关系[J]. 浙江林学院学报, 1997, 14(1): 41–44.
[12] 马腾, 王雪薇, 阮继生, 等. 三江源地区不同退化程度草地的土壤放线菌区系[J]. 微生物学通报, 2008, 35(12): 1879–1883.
[13] LIU Xiao, CONG Jing, LU Hui, et al. Community structure and elevational distribution pattern of soil Actinobacteria in alpine grasslands[J]. Acta Ecologica Sinica, 2017, 37(4): 213–218.
[14] PIAO Zhe, YANG Lingzhang, ZHAO Liping, et al. Actinobacterial community structure in soils receiving long-term organic and inorganic amendments[J]. Applied and Environmental Microbiology, 2008, 74(2): 526–530.
[15] BARBIERI E, GUIDI C, BERTAUX J, et al. Occurrence and diversity of bacterial communities induring truffle maturation[J]. Environmental Microbiology, 2007, 9(9): 2234–2246.
[16] PAVIC A, STANKOVIC S, SALJNIKOV E, et al. Actinobacteria may influence white truffle (Pico) nutrition, ascocarp degradation and interactions with other soil fungi[J]. Fungal Ecology, 2013, 6(6): 527–538.
[17] GOUDJIA Y, ZAMOUML M, MEKLAT A, et al. Plant- growth-promoting potential of endosymbiotic actinobacteria isolated from sand truffles (Tul.) of the Algerian Sahara[J]. Annals of microbiology, 2016, 66: 91–100.
[18] 孙亚明. 攀枝花块菌资源可持续经营研究[J]. 中国农业资源与区划, 2016. 37(4): 198–202.
[19] 万山平, 郑毅, 汤利, 等. 攀枝花块菌-华山松菌根土壤可培养细菌的多样性研究[J]. 植物分类与资源学报, 2015, 37(6): 861–870.
[20] 王冉, 刘培贵, 万山平, 等. 印度块菌()菌根促生细菌的研究[J]. 微生物学通报, 2015, 42(12): 2366–2376.
[21] TOKALA R K, STRAP J L, JUNG C M. Novel plant- microbe rhizosphere interaction involving Streptomyces lydicus WYEC108 and the pea plant ()[J]. Applied and Environmental Microbiology, 2002, 68(5): 2161–2171.
[22] CHERNIN L, ISMAILOV Z, HARAN S, et al. Chitinolyticantagonistic to fungal plant pathogens[J]. Applied and Environmental Microbiology, 1995, 61(5): 1720–1726.
[23] MAHASNEH A M, STEWART D J. A medium for detecting beta-(1-3) glucanase activity in bacteria[J]. Journal of Applied Bacteriology, 2010, 48(3): 457–458.
[24] HENDRICKS C W, DOYLE J D, HUGLEY B. A new solid medium for enumerating cellulose-utilizing bacteria in soil[J]. Applied and Environmental Microbiology, 1995, 61(5): 2016–2019.
[25] HANKIN L, ZUCKER M, SANDS D C. Improved solid medium for the detection and enumeration of pectolytic bacteria[J]. Applied and Environmental Microbiology, 1971, 22(2): 205–209.
[26] RUANPANUM P, TANGCHITSOMKID N, HYDE K D, et al. Actinomycetes and fungi isolated from plant-parasitic nematode infested soils: screening of the effective biocontrol potential, indole-3-acetic acid and siderophore production[J]. World journal of microbiology and biotechnology, 2010, 26(9): 1569–1578.
[27] SELEH S S, GLICK B R. Involvement of gacS and rpoS in enhancement of the plant growth-promoting capabilities Enterobacter cloacae CAL2 and UW4[J]. Canadian journal of microbiology, 2001, 47(8): 698–705.
[28] SADEGHI A, KARIMI J, ABASZADEH D, et al. Plant growth promoting activity of an auxin and siderophore producing isolate of Streptomyces under saline soil conditions[J]. World journal of microbiology and biotechnology, 2012, 28 (4): 1503–1509.
[29] BREDHOLDT H, GALATENKO O A, ENGELHARDT K, et al. Rare actinomycete bacteria from the shallow water sediments of the Trondheim fjord, Norway: isolation, diversity and biological activity[J]. Environmental Microbiolog, 2007, 9(11): 2756–2764.
[30] TOKALA R K, STAP J L, JUNG C M, et al. Novel plant-microbe rhizosphere interaction involvingWYEC108 and the pea plant ()[J]. Applied and Environmental Microbiology, 2002, 68(5): 2161–2171.
[31] PANDEY P, BISH S, SOOD A, et al. Consortium of Plant-Growth-Promoting Bacteria: Future Perspective in Agriculture[M]// SHIMIZU M. Bacteria in Agrobiology: Plant Probiotics. Springer Berlin Heidelberg. Germany: Springer-Verlag Berlin Heidelberg, 2012, 201–220.
[32] BHATTACHARYYA P, JHA D. Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture[J]. World journal of microbiology and biotechnology, 2012, 28(4): 1327–1350.
[33] 张盼盼, 秦盛, 袁博, 等. 南方红豆杉内生及根际放线菌多样性及其生物活性[J]. 微生物学报, 2016, 56(2): 241– 252.
[34] DIB-BELLAHOUEL S, FORTAS Z. Activity of the desert truffleChatin, against associated soil microflora[J]. African Journal Microbiology Research, 2014, 8(32): 3008–3016.
[35] SBRANA C, AGNOLUCCI M, BEDINI S, et al. Diversity of culturable bacterial populations associated toectomycorrhizas and their activity onmycelial growth[J]. Fems Microbiology Letters, 2002, 211(2): 195–201.
[36] FREY-KLETT P, GARBAYE J, TARKKA M. The mycorrhiza helper bacteria revisited[J]. New Phytologist,2007, 176(1): 22-36.
[37] BRAGATO G, VIGNOZZI, N, PELLEGRINI S, et al. Physical characteristics of the soil environment suitable forproduction in fluvial landscapes[J]. Plant Soil, 2010, 329(1): 51–63.
[38] BRADAI L, BISSATI S, CHENCHOUNI H, et al. Effects of climate on the productivity of desert truffles beneath hyper-arid conditions[J]. International journal of biometeorology, 2015, 59(7): 907–915.
[39] IOTTI M, LEONARDI P, VITALI G, et al. Effect of summer soil moisture and temperature on the vertical distribution ofmycelium in soil[J]. Biology and Fertility of Soils, 2018, 54(6): 1–10.
[40] QIAO Peng, TIAN Wei, LIU Peigui, et al. Phylogeography and population genetic analyses reveal the speciation of thecomplex[J]. Fungal Genetics and Biology, 2018, 113: 14–23.
[41] YE Lei, LI Qiang, FU Yu, et al. Host species effects on bacterial communities associated with the fruiting bodies of Tuber species from the Sichuan Province in Southwest China[J]. Mycological Progress, 2018, 17(7): 833–840.
[42] SCHNEIDER-MAUNOURY L, SECLERCQ S, CLEMENT C, et al. Iscolonizing the roots of herbaceous, non-ectomycorrhizal plants[J]. Fungal Ecology, 2018, 31, 59–68.
Functional diversity of culturable actinomycetes isolated frommycorrhizal soils in Panzhihua, Sichuan
WANG Tiantian, MENG Xiaojin, MA Qinqin, YONG Bin, MIAO Yuzhi*
College of Life Sciences, Sichuan Normal University, Chengdu 610101, China
In this study, we isolated actinomyces frommycorrhizal soils in Panzhihua, Sichuan by four types of medium, and all isolates were identified by PCR-RFLP based on 16S rRNA gene in combination with morphological observation. The abilities of each strain to degrade carbohydrates and produce growth promoters were obtained by measuring the enzyme activity or metabolites in shaking flask fermentation broth of each isolate. Then, dual-culture inhibition was adopted for screening strains antifungal activity. A total of 125 actinomyces were isolated, of which 57 strains (W1-W57) were selected after morphological character observation and assigned to 3 genera. Actinomyces could be divided into 23 species, and among all isolates the Streptomyces were the most (91.3%). Result of functional analysis was as follows: 23, 17, 15, and 18 strains of all isolates degraded 1,3--glucan, chitin and cellulose and pectin, respectively, of which 47.8%, 26.1% and 26.1% were able to degrade simultaneously 4, 3 and 2 carbohydrates, respectively. 19 isolates produced the siderophore, 3 isolates secreted indoleacetic acid, and 2 strains produced ACC deaminase, of which 21.7%, 56.6% and 21.7% respectively had simultaneously the above bioactivities of 3, 2 and 1, respectively. 10 isolates had more than one ability to resist pathogenic fungi; W2 and W19 showed better inhibitory ability to four pathogenic fungi than other isolates. At the same time, the multifunctional functions and high bioactive strains including W2, W3, W17, W19, W20, W34, W36 and W54 were obtained. This study shows that there are lots of multifunctional actinomycetes inmycorrhizal of Panzhihua, Sichuan, and the results can also provide new ideas for the development of new planting techniques in artificial cultivation of.
Tuber inducum; rhizospheric soil; culturable actinomycetes; functional diversity
10.14108/j.cnki.1008-8873.2019.05.017
CLCQ939.96
A
1008-8873(2019)05-127-11
2018-07-10;
2018-10-08
四川省应用基础项目(2017JY0147); 四川省教育厅重点项目(15ZA0036)
王田田(1992—), 女, 四川自贡人, 硕士研究生, 主要从事微生物多样性研究, E-mail: 1120152047@qq.com
苗玉志, 男, 博士, 副教授, 主要从资源微生物研究, E-mail: skymyz88@163.com
王田田, 孟小靖, 马沁沁,等. 四川攀枝花地区印度块菌菌根根际土壤内可培养放线菌功能多样性[J]. 生态科学, 2019, 38(5): 127-137.
WANG Tiantian, MENG Xiaojin, MA Qinqin, et al. Functional diversity of culturable actinomycetes isolated frommycorrhizal soils in Panzhihua, Sichuan[J]. Ecological Science, 2019, 38(5): 127-137.

