姜黄素通过影响自噬调控肝细胞上皮间质转化及肝纤维化进程的作用与机制研究
孔德松,张自力,张 峰,郑仕中
(1. 南京中医药大学附属南京中医院科研部,江苏 南京 210001;2. 南京中医药大学药学院药理学教研室,江苏 南京 210023;3. 江苏省中药药效与安全性评价重点实验室,江苏 南京 210023)
肌成纤维细胞(myofibroblast,MFB)的大量生成与活化是肝纤维化过程中的核心环节[1-2]。近年来,研究发现[3-5],肝细胞经上皮间质转化(epithelial-mesenchymal transition,EMT)转化为成纤维细胞后,对肝纤维化的发生与发展起重要作用,我们的前期研究也得到了同样的结论[6]。抑制肝细胞EMT过程,减少MFB的生成,将是减缓甚至逆转肝纤维化的有效措施。姜黄素(curcumin)的药理作用与临床开发一直是国内外制药领域关注的热点之一[7-8],临床应用前景十分诱人。我们的研究表明,姜黄素可以有效抑制肝星状细胞(hepatic stellate cell,HSC)的活化,具有很强的体内外抗肝纤维化作用,姜黄素在各类肝损伤中对肝细胞具有选择性保护作用[9-10]。文献研究发现,在姜黄素抗纤维化作用的研究中,涉及肝细胞EMT调控机制研究的报道较少。我们前期研究发现,姜黄素能够抑制缺氧诱导的肝细胞EMT进程,减少细胞外基质(extracellular matrix,ECM)的生成[6],但参与调控的具体机制,仍有待进一步深入研究。
大量研究证实,自噬在非酒精性脂肪肝、肝纤维化、肝癌等肝脏疾病的发病进程中发挥重要作用[11-14]。在肝细胞内,自噬通过清除错误折叠蛋白、过度积累的脂类(脂肪分解)和(或)受损的线粒体(线粒体自噬)等途径,保证肝脏细胞的能量供给,从而维持肝脏细胞的自稳态[15]。我们在前期预实验中发现,肝纤维化小鼠肝细胞的整体自噬水平是下降的,在缺氧环境下的,随着时间的推移,肝细胞自噬水平先是有所增加,后逐渐下降。最新研究表明,肝损伤进程中,肝细胞的自噬与EMT之间可相互调节,自噬可降低Snail蛋白的表达,抑制肝细胞EMT进程,同样EMT也可影响肝细胞内的自噬流[16]。为此,我们推测肝细胞内自噬流的变化与肝细胞的EMT及向MFB转变存在着重要关联。本文旨在探讨姜黄素对肝细胞自噬及EMT的干预效应,进一步深入阐释姜黄素的抗肝纤维化作用及机制。
1 材料
1.1 细胞株小鼠胚胎肝细胞BNL CL.2,购自中国科学院上海细胞所。
1.2 药物与试剂姜黄素(纯度>99%,美国Sigma公司);干扰质粒构建(南京谨庭生物科技有限公司);蛋白抽提试剂盒(碧云天生物技术研究所);转化生长因子β1(transforming growth factor β1,TGF-β1)(Cell Signal公司);波形蛋白(Vimentin)、α-平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)、Beclin-1、LC3抗体(Abcam公司);逆转录试剂盒、real time-PCR用试剂(Bio-Rad公司)。
1.3 仪器DM1L倒置光学显微镜(德国莱卡);SPECTRA MAX 190可见-紫外光微孔板检测仪(美国MD公司);Mini Protean 3 Cell电泳仪(美国Bio-Rad公司);GS-15R冷冻离心机、MSD97K49微量离心机(美国Beckman公司);PCR仪(美国AB公司)。
2 方法
2.1 实验分组取对数生长期的小鼠胚胎肝细胞BNL CL.2,分为5组:正常对照组、模型组、姜黄素低、中、高剂量(10、20、30 μmol·L-1)组,以TGF-β1(2 μg·L-1)处理细胞,同时给予姜黄素干预,作用24 h后检测相关指标。
按文献方法构建BECN1与阴性对照(CTR)基因的干扰RNA(siRNA),转染小鼠胚胎肝细胞BNL CL.2,得两种体外细胞模型:自噬基因沉默(siBECN1,模型细胞1)及对照(siCTR,模型细胞2)用于实验[16]。实验分为正常对照组、TGF-β1刺激组、BECN1 siRNA组、CTR siRNA组、姜黄素组、BECN1 siRNA+姜黄素组、CTR siRNA+姜黄素组,共7组。除正常对照组外,其余各组均以TGF-β1(2 μg·L-1)处理细胞,同时给予姜黄素干预,作用24 h后检测相关指标。
2.2 Western blot检测BNL CL.2肝细胞自噬、细胞表型及纤维化标志物蛋白表达细胞干预处理后,加入预冷RIPA裂解液,立即加入PMSF和磷酸酶抑制剂,冰上孵育30 min,移入离心管,4℃、15 000 r·min-1离心15 min,取上清液为细胞裂解液。BCA法测定蛋白浓度,加上样缓冲液,沸水浴10 min。SDS-PAGE凝胶电泳(上样量50 μg),100 V转膜1.5 h,脱脂奶粉封闭。根据实验前处理,分别加入一抗:肝细胞自噬相关蛋白(Beclin-1、LC3)、细胞表型相关蛋白(Vimentin)及纤维化标志物α-SMA,然后孵育二抗,化学发光剂ECL显色。
2.3 Real-time PCR检测BNL CL.2肝细胞自噬、细胞表型及纤维化标志物基因表达按TRIzol Reagent说明书提取细胞总RNA,酶标仪测定RNA含量。将mRNA反转录成cDNA,取反转录产物进行实时定量PCR反应。PCR以GAPDH为内参,所用特异性引物序列见Tab 1。实时荧光定量PCR法检测mRNA相对表达基于比较CT(threshold cycle)值法,每个样本的mRNA含量用各内参GAPDH含量进行标准化。
2.4 光学显微镜下观察细胞形态变化取对数生长期的小鼠胚胎肝细胞BNL CL.2,用0.25%胰蛋白酶消化制成细胞悬液,接种于12孔板中(1×105个/孔)。至细胞80%贴壁后,按“2.1”干预分为7组,显微镜下拍照,观察细胞形态变化。
2.5 GFP-LC3质粒转染和细胞的筛选按照质粒小量抽提纯化试剂盒说明书提取质粒pcDNA3.1-GFP-LC3。采用Effectene Transfection Reagent介导方法,将pcDNA3.1-GFP-LC3质粒转染BNL CL.2肝细胞,按说明书操作,将转染复合物加入到含10%胎牛血清的DMEM培养的细胞中。转染24 h后加入G418工作液,终浓度为800 mg·L-1,每3~5 d更换培养液,同时以未转染的BNL CL.2肝细胞作为阴性对照。培养14 d后,转染细胞有抗药克隆长出,而阴性对照组细胞全部死亡。将转染细胞有限稀释,并克隆化培养于96孔培养板中。培养5 d后,挑选单克隆细胞生长孔于倒置荧光显微镜下观察,有绿色荧光的细胞为阳性细胞。待孔中细胞增殖至约50%融合度时,相继传代于24孔、6孔培养板、细胞培养瓶中扩大培养。
3 结果
3.1 姜黄素增强BNL CL.2肝细胞自噬相关蛋白与基因的表达,抑制细胞间质型及纤维化标志物蛋白与基因的表达Fig 1的Western blot结果表明,TGF-β1刺激后,BNL CL.2肝细胞间质型标志物Vimentin及肌成纤维细胞标志蛋白α-SMA表达增加,而细胞自噬水平降低,Beclin-1与LC3表达下降;姜黄素能够降低Vimentin与α-SMA的表达,同时升高细胞内自噬相关蛋白的表达。Real-time PCR结果(Tab 2)与Western blot结果一致。
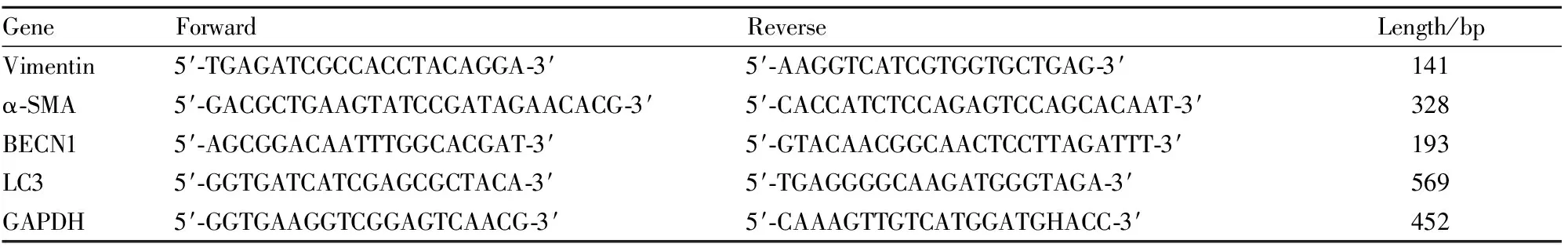
Tab 1 Primer sequence for real-time PCR

Tab 2 Effect of curcumin(CUR) on mRNA expression of Vimentin,α-SMA, BECN1, LC3 in BNL CL.2 cells stimulated by TGF-β1

Tab 3 Effect of CUR and BECN1 siRNA on mRNA expression of Vimentin,α-SMA, BECN1, LC3 in BNL CL.2 stimulated by TGF-β1
3.2 姜黄素可阻滞TGF-β1诱导及自噬基因干扰所致的BNL CL.2肝细胞的上皮间质转化进程从细胞形态学上看(Fig 2),TGF-β1诱导和自噬相关基因(BECN1)干扰后,BNL CL.2肝细胞转变为间质型细胞表型,给予姜黄素(20 μmol·L-1)干预,细胞形态未发生间质化转变。
3.3 姜黄素可减少TGF-β1诱导及自噬基因干扰所致的BNL CL.2肝细胞的自噬小体的形成如Fig 3所示,TGF-β1与BECN1 siRNA处理后,BNL CL.2肝细胞自噬水平降低,给予姜黄素(20 μmol·L-1)能明显增加细胞内自噬水平。
3.4 姜黄素通过促进自噬抑制BNL CL.2肝细胞EMT进程Tab 3的Real-time PCR结果表明,TGF-β1刺激后,BNL CL.2肝细胞间质型标志物Vimentin及肌成纤维细胞标志蛋白α-SMA基因表达增加;干扰自噬基因BECN1后,姜黄素抑制Vimentin与α-SMA基因表达的作用被部分阻断。
4 讨论
肝纤维化在我国常见、高发,肝细胞经EMT向MFB的转变是肝纤维化发病进程的关键事件。姜黄素体内外具有明显抗肝纤维化作用,并能抑制肝细胞EMT进程,减少ECM的生成。自噬参与多种肝脏疾病的发展进程调控,可能与肝细胞EMT存在重要关联,但机制仍不明确。目前,姜黄素确切的抗肝纤维化作用的内在机制仍不十分清楚,特别是其调控肝细胞EMT进程与抗肝纤维化的关系更是知之甚少,有待于进一步解析与阐明,以此为靶标的药物作用与机制研究更为鲜见,是当前肝纤维化病理机制与治疗学研究的一个突出的前沿创新点。基于我们已有的研究积累和掌握的文献资料,课题组提出并推测,自噬在肝纤维化发生时肝细胞EMT进程调控中发挥重要作用;姜黄素可通过影响肝细胞内自噬流的变化,进而逆转肝细胞EMT进程,减少MFB的生成及ECM的沉积。
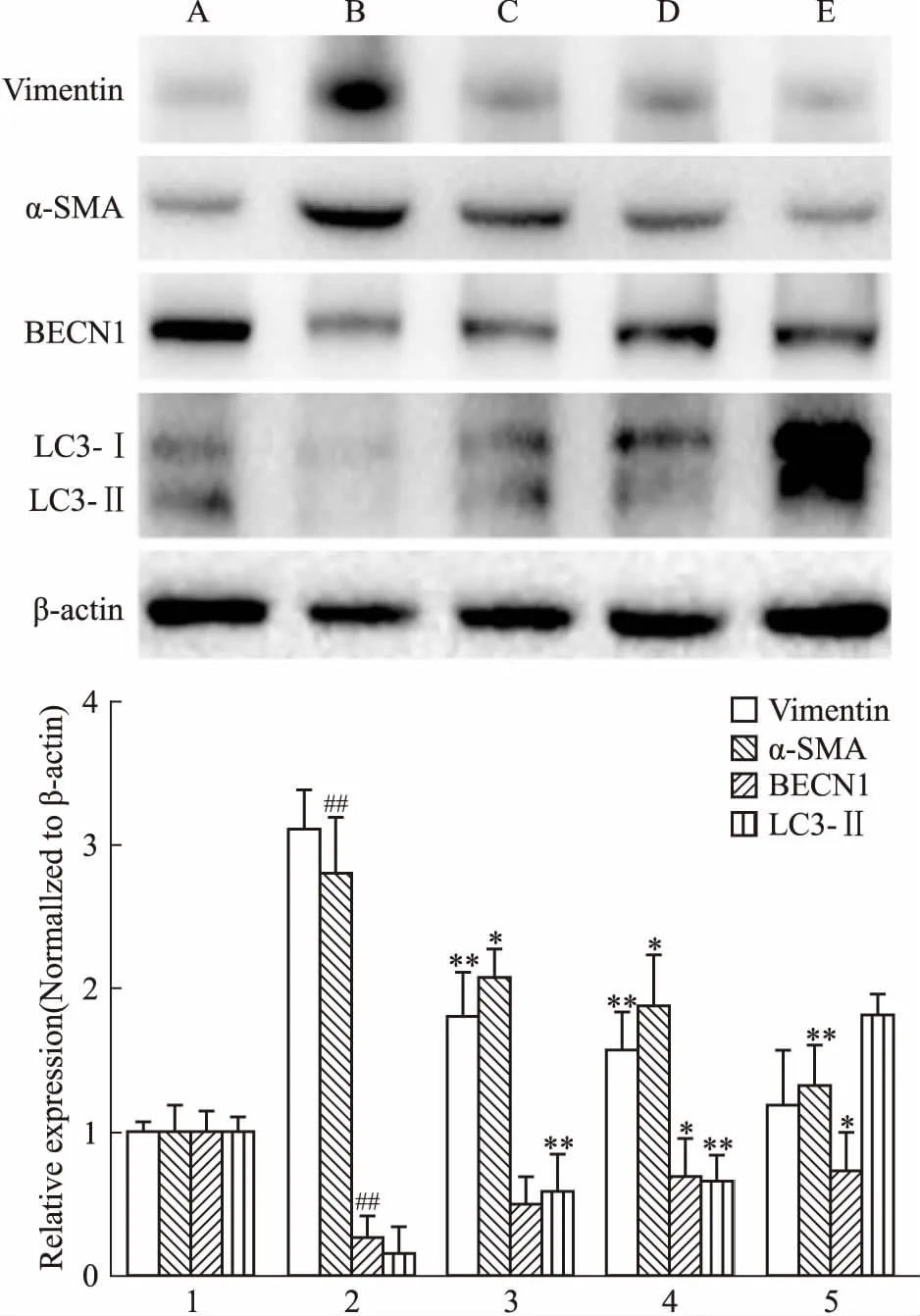
Fig 1 Protein expression of Vimentin,α-SMA,Beclin-1,LC3 in BNL CL.2 cells influenced by TGF-β1 and intervened by curcumin(CUR) by Western blot detection

Fig 2 Morphologic change of BNL CL.2 cells in each group
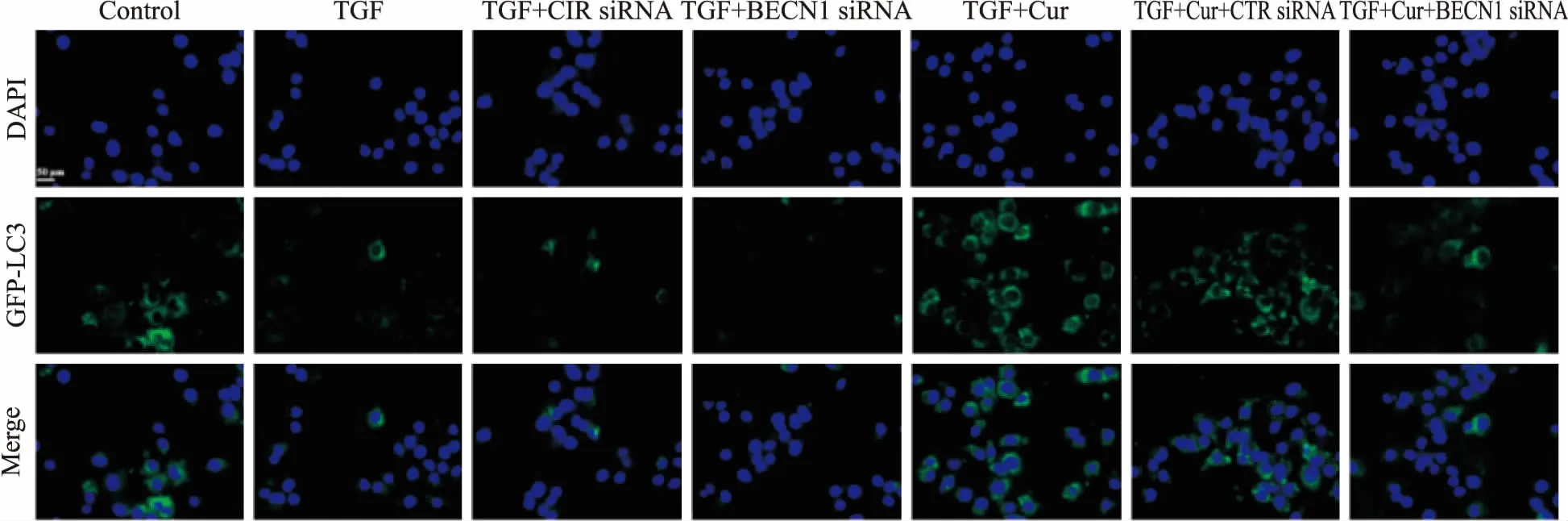
Fig 3 Autophagy levels in each group
本研究发现,TGF-β1(2 μg·L-1)处理后,BNL CL.2肝细胞间质型标志物Vimentin及MFB标志蛋白α-SMA表达增加,细胞形态也向间质型转变,自噬水平下降。干扰自噬相关基因BECN1,肝细胞的间质化表型转变更加明显。姜黄素能抑制TGF-β1诱导后肝细胞Vimentin及α-SMA的表达,抑制肝细胞的EMT进程,增加肝细胞自噬相关基因与蛋白Beclin-1、LC3的表达。干扰自噬基因BECN1后,姜黄素抑制Vimentin、α-SMA基因表达的作用被部分阻断,表明姜黄素抑制肝细胞EMT的作用依赖于对自噬的调控环节。我们的研究初步揭示了自噬在肝细胞向MFB转变中的作用,以及姜黄素通过提高肝细胞自噬水平,抑制肝细胞EMT进程,进而抑制肝纤维化发生与发展的内在机制。
本研究仍存在诸多不足,将在后续研究中进一步解决:① 项目的机制研究还有待进一步深入。姜黄素通过何种机制调控肝细胞的自噬,姜黄素调控自噬后,自噬又是通过何种机制影响肝细胞EMT的。细胞自噬过程是胞内信号转导网络综合调控的结果,ROS、mTOR、AMPK、p38-MAPK等多条信号转导通路参与其中[17-20]。前期本实验室研究发现,姜黄素可通过激活PPARγ,抑制HSC的氧化应激及进一步的活化。姜黄素是否能通过抑制ROS,调控肝细胞自噬,仍需进一步的验证。但自噬对EMT进程调控的报道仍较少,仍需进一步阐明其中调控机制。② 姜黄素调控肝细胞自噬与细胞凋亡、坏死、焦亡等进程的区别与联系等。当细胞遭受外界损伤时,细胞走向不同的死亡方式可能是由于细胞不同信号转导通路的活化,各通路间也存在着相互调控与关联。