化痰行瘀汤对肝纤维化大鼠治疗作用及对脂质过氧化的影响研究
俞忠明
1.浙江省中医药研究院 杭州 310007 2.浙江中医药大学
肝纤维化是病毒性肝炎、酒精性肝病、脂肪肝等多种慢性肝脏疾病发展为肝硬化的必经之路。肝硬化以门静脉高压和肝功能减退为临床特征,最终以并发消化道出血、肝性脑病、继发感染、癌变等而死亡[1]。因此,控制慢性肝脏疾病,特别是有效防治肝纤维化的进展,对于控制病情进展、降低死亡率具有重要意义。中医认为,肝纤维化的发生发展与痰瘀互结密切相关,本研究应用名中医经验方“化痰行瘀汤”,在前期的临床与实验研究中发现其治疗肝纤维化具有较好疗效。近几年来,对肝纤维化发病机制有新的认识,本课题重点研究脂质过氧化在肝纤维化防治中的作用机制,期望进一步阐明化痰行瘀汤抗纤维化作用的新途径和新靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级雄性SD大鼠72只,体质量180~220g,由北京维通利华实验动物技术有限公司提供,生产许可证号:SCXK(京)2016-0011。实验场地为浙江省中医药研究院实验动物中心,使用许可证号:SYXK(浙)2014-0003。动物饲养室温度为22℃~26℃,湿度为40%~70%。12h日光灯照射,自由饮食饮水。
1.1.2 受试试剂和药物 “化痰行瘀汤”方为:泽泻30g,浙贝 15g,桃仁 10g,丹参 10g,赤芍 10g,郁金10g。由浙江省立同德医院第二门诊部提供,加水量8倍,温度100℃,提取2次,每次1.5小时,提取液浓缩成生药浓度为1g/mL的溶液。复方鳖甲软肝片购自内蒙古福瑞中蒙药科技股份有限公司;丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、Ⅲ型前胶原(rocollagenⅢ,PCⅢ)、Ⅳ型胶原(collagen iv,Ⅳ-C)、透明质酸(hyaluronic acid,HA)、层黏连蛋白(laminin,LN)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(lutathione peroxidase,GSH-Px)、超氧化物歧化酶(Superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)试剂盒均购自南京建成生物工程研究所。
1.2 方法
1.2.1 动物分组、造模及干预 72只大鼠按体重随机分为正常组、模型组、化痰行瘀汤高、中、低剂量组及阳性对照组共6组,每组12只。除正常组外,其余各组均用腹腔注射CCL4制备肝纤维化模型。腹腔注射约 0.6mL(按 2mL/kg)40%(v/v)的 CCL4(溶于蓖麻油中),每周2次,共10周。根据以往研究经验,造模5周后即可形成肝纤维化。各治疗组于第6周给药,每天灌胃1次。化痰行瘀汤按高、中、低(17.85g/kg/d、8.925g/kg/d、4.464g/kg/d)剂量灌胃,模型组给予生理盐水6.3mL/(kg·d)灌胃,阳性对照组给予复方鳖甲软肝片8mg/(kg·d)灌胃。至第10周结束。实验期间各组大鼠均给予相同标准的饲料和饮用水,并观察记录生存和一般状况。
1.2.2 肝脏、脾脏指数测算及病理变化观察 末次给药后,禁食不禁水12h。大鼠处死前称体重,取肝脏和脾脏,在滤纸上轻轻拭干后立即称重,记录肝重和脾重。肝脏指数(%)=肝脏质量(mg)/体质量(g)×100%,脾脏指数(%)=脾脏质量(mg)/体质量(g)×100%。
各组均取肝叶中部用甲醛溶液固定,伊红(hematoxylin-eosin,HE)染色,观察其病理变化。将肝纤维化分为0~4级,0级:无纤维化;1级:纤维结缔组织仅局限于汇管区或汇管区扩大有向小叶发展的趋势;2级:纤维结缔组织增生进入肝小叶2/3并有1级同样的改变;3级:纤维结缔组织进入肝小叶达中央静脉周围;4级:纤维结缔组织在全小叶多处弥漫性增生,假小叶形成并有3级同样改变。
1.2.3 大鼠血清 ALT、AST、ALP及肝组织中 CAT、GSH-Px、SOD及MDA水平检测 采用生化分析法。腹主动脉采血,将全血静置2h,4000r/min离心10min,分离血清。按照试剂盒说明测定血清ALT、AST、ALP活性;取大鼠肝脏相同部位组织制备肝匀浆,按照试剂盒说明测定大鼠肝组织CAT、GSH-Px、SOD及MDA水平。
1.2.4 大鼠血清中PCⅢ、IV-C、HA、LN检测 采用酶联免疫吸附测定(Enzyme-linked Immune Sorbent Assay,ELISA)法,按ELISA试剂盒提供说明书操作,酶标仪检测各组大鼠血清中PCⅢ、Ⅳ-C、HA、LN含量。
1.2.5 统计学方法 采用SPSS18.0软件进行分析,各组数据均为计量资料,数据以±s表示。两组间比较时采用独立样本t检验,多组间比较方差齐性时采用方差分析,组间两两比较采用LSD-t法;多组间比较方差不齐时采用Kruskal-wallis H检验。等级资料采用ridit分析。P<0.05认为差异有统计学意义。
2 结果
2.1 化痰行瘀汤对肝纤维化大鼠生存状态的影响
空白对照组大鼠皮毛光滑亮泽,饮食正常,活动正常,体格健壮,无死亡。模型组表现为体重增长缓慢,精神不振,反应迟缓,饮食摄水量逐渐减少,大便溏泄,皮毛凌乱、稀疏,缺乏光泽。化痰行瘀汤高、中、低剂量组及阳性对照组表现为不同程度体重增长下降,精神不振,个别大便溏泄,皮毛晦暗、柔顺。其中,化痰行瘀汤高剂量组表现较其它治疗组明显改善,部分皮毛晦暗、柔顺,活动、饮食摄水量尚可,整体情况较好。实验结束时,模型对照组大鼠死亡2只,化痰行瘀汤中、低剂量组大鼠各死亡 1只,其他各组无死亡。
2.2 各组大鼠肝组织病理学变化 取各组大鼠肝脏,10%甲醛固定制成石蜡切片,进行HE染色,光学显微镜下观察肝脏组织学病理变化。正常组大鼠肝脏汇管区及肝小叶架构清晰完整,肝索整齐排列,肝细胞无炎症坏死。模型组大鼠肝脏汇管区周围纤维胶原大量增生,肝小叶及肝索正常排列遭到破坏,肝实质细胞大量坏死、出现气球样病变。阳性对照组和化痰行瘀汤高、中剂量组大鼠肝脏纤维化程度有所改善,纤维增生和细胞病变坏死情况减轻。见图1。

图1 化痰行瘀汤对肝纤维化大鼠肝组织病理学影响Fig.1 Effect of Huatan Xingyu Decoction on liver histopathology in rats with liver fibrosis
2.3 各组大鼠肝组织肝纤维化分期比较 各组大鼠肝组织肝纤维化分期情况结果见表1。与正常对照组比较,模型组差异有统计学意义(P<0.05),肝纤维化明显,提示造模成功。与模型组比较,化痰行瘀汤各个剂量组及阳性对照组差异有统计学意义(P<0.05),提示各治疗组具有一定的治疗作用。与阳性对照药比较,化痰行瘀汤高、中剂量组差异无统计学意义(P>0.05)。见表 1。
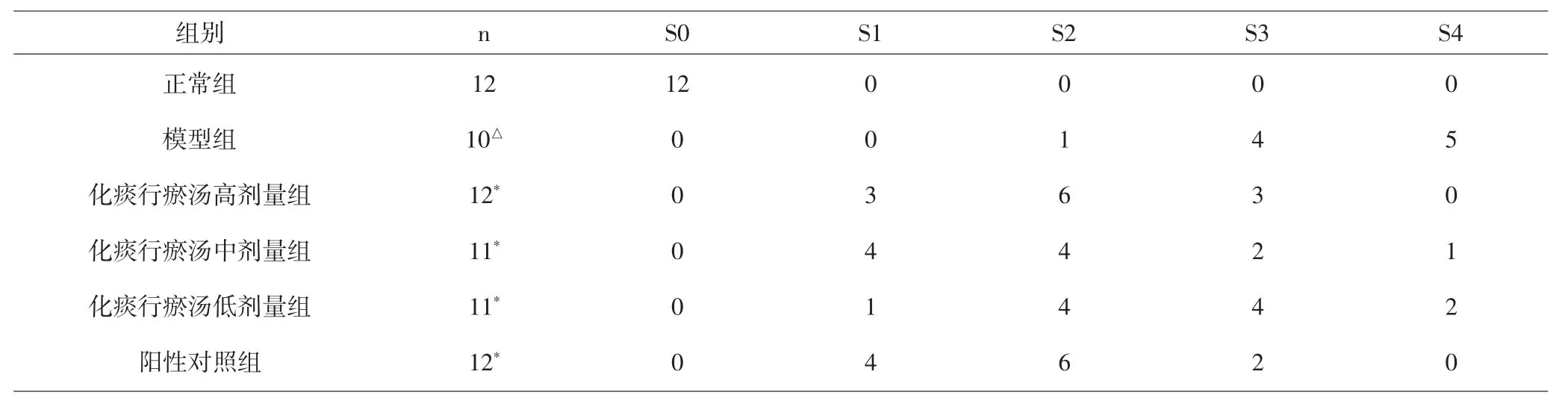
表1 化痰行瘀汤对肝纤维化大鼠对肝纤维化分期影响(n)Tab.1 Effect of Huatan Xingyu Decoction on staging of liver fibrosis in rats with liver fibrosis(n)
2.4 各组大鼠肝脏、脾脏指数比较 与正常组比较,模型组肝脏指数与脾脏指数显著升高(P<0.01);与模型组比较,化痰行瘀汤高剂量组及阳性对照组肝脏指数与脾脏指数都显著下降(P<0.01),化痰行瘀汤中剂量组肝脏指数与脾脏指数明显下降(P<0.05),化痰行瘀汤低剂量组肝、脾脏指数均无明显差异。见表2。
表2 化痰行瘀汤对肝纤维化大鼠肝脏、脾脏指数影响(±s,n=10)Tab.2 Effect of Huatan Xingyu Decoction on liver and spleen index in rats with liver fibrosis(±s,n=10)

表2 化痰行瘀汤对肝纤维化大鼠肝脏、脾脏指数影响(±s,n=10)Tab.2 Effect of Huatan Xingyu Decoction on liver and spleen index in rats with liver fibrosis(±s,n=10)
注:与正常组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01Note:Compared with the normal group,△△P<0.01;compared with the model group,*P<0.05,**P<0.01
组别 肝脏指数 脾脏指数正常组模型组化痰行瘀汤高剂量组化痰行瘀汤中剂量组化痰行瘀汤低剂量组阳性对照组3.82±0.46 6.93±0.67△△4.74±0.55**6.18±0.61*6.75±0.57 4.56±0.69**0.77±0.19 1.69±0.67△△0.94±0.22**1.11±0.32*1.54±0.26 0.95±0.35**
2.5 各组大鼠血清中ALT、AST、ALP水平比较 与正常组比较,模型对照组ALT、AST、ALP都显著升高(P<0.01);与模型组比较,化痰行瘀汤高及阳性对照组 ALT、AST、ALP 显著性下降(P<0.01),化痰行瘀汤中剂量组 ALT、ALP 显著性下降(P<0.01)、AST显著性下降(P<0.05),化痰行瘀汤低剂量组ALT、AST、ALP均无明显差异。见表3。
表3 化痰行瘀汤对肝纤维化大鼠血清中ALT、AST、ALP水平的影响(±s,n=10)Tab.3 Effect of Huatan Xingyu Decoction on serum ALT,AST and ALP levels in rats with liver fibrosis(±s,n=10)

表3 化痰行瘀汤对肝纤维化大鼠血清中ALT、AST、ALP水平的影响(±s,n=10)Tab.3 Effect of Huatan Xingyu Decoction on serum ALT,AST and ALP levels in rats with liver fibrosis(±s,n=10)
注:与正常组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01Note:Compared with the normal group,△△P<0.01;compared with the model group,*P<0.05,**P<0.01
组别 ALT(IU/L) AST(IU/L) ALP(IU/L)正常组模型组化痰行瘀汤高剂量组化痰行瘀汤中剂量组化痰行瘀汤低剂量组阳性对照组57.73±6.78 318.84±34.38△△195.40±29.51**213.26±28.62**298.60±31.71 153.81±31.01**149.68±24.33 445.36±91.39△△336.40±26.30**353.35±68.11*410.32±35.90 293.81±31.01**77.80±12.30 339.06±38.65△△155.37±19.93**238.41±22.36**300.36±69.82 134.79±18.33**
2.6 化痰行瘀汤对肝纤维化大鼠脂质过氧化指标影响 检测各组大鼠肝组织中CAT、GSH-Px、SOD及MDA等脂质过氧化指标发现,与正常组比较,模型组CAT、GSH-Px及 SOD 水平显著下降(P<0.01),MDA水平显著升高(P<0.01)。与模型组比较,化痰行瘀汤高、中剂量组及阳性对照组CAT、GSH-Px及SOD水平显著升高(P<0.01),MDA 水平显著下降(P<0.01),化痰行瘀汤中剂量组CAT、GSH-Px及SOD水平明显升高(P<0.05),MDA 水平明显下降(P<0.05)。见表 4。
表4 化痰行瘀汤对肝纤维化大鼠肝组织中CAT、GSH-Px、SOD、MDA的影响(±s,n=10)Tab.4 Effects of Huatan Xingyu Decoction on CAT,GSH-Px,SOD and MDA in liver tissues of rats with liver fibrosis(±s,n=10)

表4 化痰行瘀汤对肝纤维化大鼠肝组织中CAT、GSH-Px、SOD、MDA的影响(±s,n=10)Tab.4 Effects of Huatan Xingyu Decoction on CAT,GSH-Px,SOD and MDA in liver tissues of rats with liver fibrosis(±s,n=10)
注:与正常组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01Note:Compared with the normal group,△△P<0.01;compared with the model group,*P<0.05,**P<0.01
组别 CAT(KU/gprot) GSH-Px(KU/gprot) SOD(KU/gprot) MDA(nmol/mgprot)正常组模型组化痰行瘀汤高剂量组化痰行瘀汤中剂量组化痰行瘀汤低剂量组阳性对照组840.43±35.78 517.22±91.20△△656.38±25.37**608.55±93.18*545.51±72.78 685.11±29.48**809.87±40.08 473.88±91.58△△611.50±76.83**584.15±90.70*530.22±81.22 643.88±32.78**389.34±23.44 202.03±76.23△△321.22±21.02**262.53±19.84*237.21±17.32 339.84±24.06**1.38±0.17 5.97±1.89△△3.77±0.26**4.57±0.21*5.45±0.29 3.23±0.22**
2.7 化痰行瘀汤对肝纤维化大鼠血清肝纤维化标志物的影响 检测各组大鼠血清中PCⅢ、IV-C、HA、LN等肝纤维化标志物水平发现,与正常组比较,模型组PCⅢ、IV-C、HA、LN 都显著升高(P<0.01)。与模型组比较,化痰行瘀汤高剂量组及阳性对照组PCⅢ、IV-C、HA、LN 都显著下降(P<0.01),中剂量组 PCⅢ、IV-C、HA、LN 均明显下降(P<0.05)。见表 5。
表5 化痰行瘀汤对肝纤维化大鼠血清中PCⅢ、IV-C、HA、LN水平的影响(±s,μg/L,n=10)Tab.5 Effect of Huatan Xingyu Decoction on serum PCIII,IV-C,HA and LN levels in rats with liver fibrosis(±s,μg/L,n=10)

表5 化痰行瘀汤对肝纤维化大鼠血清中PCⅢ、IV-C、HA、LN水平的影响(±s,μg/L,n=10)Tab.5 Effect of Huatan Xingyu Decoction on serum PCIII,IV-C,HA and LN levels in rats with liver fibrosis(±s,μg/L,n=10)
注:与正常组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01Note:Compared with the normal group,△△P<0.01;compared with the model group,*P<0.05,**P<0.01
组别 PCⅢ IV-C HA LN正常组模型组化痰行瘀汤高剂量组化痰行瘀汤中剂量组化痰行瘀汤低剂量组阳性对照组52.88±4.43 155.11±10.20△△88.23±7.11**145.58±8.17*154.40±9.21 77.30±6.25**78.67±6.44 171.43±11.59△△107.65±7.83**158.46±8.88*170.60±9.50 90.25±7.42**83.35±6.80 224.67±17.67△△145.46±13.33**207.67±14.08*219.88±15.30 139.82±12.66**85.02±6.89 275.60±23.66△△186.80±12.34**256.36±15.06*270.54±18.38 167.22±11.25**
3 讨论
在我国,慢性病毒性肝炎、酒精性肝病、非酒精性脂肪性肝病以及肝癌等慢性肝病发病广、危害大,严重危害着国民健康。肝纤维化是肝脏对多种慢性损伤的病理修复反应,以肝脏细胞外基质过度增生沉积为特征,是大多数慢性肝病的共同病理特征,亦是慢性肝炎向肝硬化甚至肝癌发展的必经病理阶段[1]。近年来,肝纤维化的病理变化可逆转已是业界共识,抗肝纤维化治疗已成为当前慢性肝脏疾病研究的焦点之一[2]。中药复方具有多组分、多途径与多环节的综合治疗优势,在抗肝纤维化治疗方面研究取得了较大的进展,并取得了较满意的临床疗效,如扶正化瘀胶囊(片)、复方鳖甲软肝片以及下瘀血汤等[3]。
本课题组认为肝纤维化的病理表现为胶原等细胞外基质的积聚,这与中医的痰瘀互结的病机相似,因此,课题组选用浙贝化痰,泽泻利湿,丹参、赤芍活血,桃仁软坚散结散结,郁金为血中之气药,活血兼以行气,痰瘀兼治,可有效治疗肝纤维化[4]。课题组多年来将化痰行瘀汤应用于治疗肝硬化、肝纤维化临床病人,取得了较好的临床疗效,为课题组治疗肝纤维化的经验方。但化痰行瘀汤对肝纤维化作用机制尚不清楚,因此本项目重点探讨化痰行瘀汤对肝纤维化大鼠治疗作用和机制。
本研究使用经典的CCL4造成大鼠肝纤维化模型,大部分动物都出现了3级和4期的病理改变,纤维结缔组织弥漫性增生,假小叶形成,且均一性好,而且血清 ALT、AST、ALP 等肝酶和 PCⅢ、Ⅳ-C、HA、LN等肝纤维化指标显著升高,表明模型成功,肝纤维化大鼠具有明显的肝纤维化特征。而化痰行瘀汤高、中剂量组大鼠血清 ALT、AST、ALP 及 PCⅢ、Ⅳ-C、HA、LN降低,肝脾指数降低,HE病理显示肝脏纤维增生和细胞病变坏死情况减轻,说明高、中剂量组化痰行瘀汤均具有明显的抗肝纤维化作用,能减少肝脏胶原的合成。
肝纤维化的发病机制异常复杂,目前认为细胞外基质(extracellular matrix,ECM)过度沉积与肝星状细胞(hepatic stellate cells,HSCs)活化是其主要发病机制[5]。脂质过氧化是指在自由基的攻击下,不饱和脂肪酸发生过氧化反应,从而生成一系列活性氧的复杂过程。脂质过氧化除破坏生物膜、蛋白质、核酸等大分子物质外,还可诱导炎性细胞浸润,激活库普弗细胞和 HSC,所产生的脂质过氧化物质可以通过影响胶原代谢导致肝纤维化的形成。因此,清除氧自由基、抑制脂质过氧化成为抗肝纤维化的一个重要靶点[6]。本研究发现,模型组脂质过氧化相关指标MDA显著升高,抗氧化指标CAT、SOD、GSH-Px显著下降,表明模型组大鼠体内氧化与抗氧化作用失衡,肝组织内自由基产生过多,诱导产生氧化应激反应,进而导致肝细胞损伤。高、中剂量的化痰行瘀汤能能降低肝脏的脂质过氧化,发挥抗纤维化的作用,目前尚无这方面的文献报道。同时,化痰行瘀汤与复方鳖甲软肝片的作用相似,但本方选药组方精当,具有简、便、廉、验的特点,值得进一步推广和研究。
综上所述,化痰行瘀汤可能通过抗脂质过氧化发挥抗纤维化的作用,本课题组将进一步深入研究。

