MC1R基因多态性与豚鼠隐性黄毛色的相关性分析
赖伟宁, 康建红, 于丰, 胡明月, 闫守庆, 祝万菊
(1.吉林大学动物科学学院,长春130062; 2. 吉林大学动物医学学院,长春130062)
动物毛色往往是一个物种或品种的重要特征,可作为形态学标记来进行物种或品种纯度的鉴别(Drumletal.,2018;赵珊珊等,2018),同时,毛色的差异也会对动物的生长速度、生产性能以及对疾病的抵抗力具有一定的影响,因此研究动物毛色多样性的形成与调控机制具有重要理论和实践意义。动物的毛色是由黑色素细胞产生的色素决定,根据色素的性质可分为真黑素和褐黑素,黑色素的种类和含量不同,毛发颜色有所不同(Fontanesietal.,2011)。
豚鼠Caviaporcellus属于豚鼠科Caviidae,特殊的解剖结构及生物学特征使其被广泛用于医学动物实验(刘迪文等,2017);由于可爱的外表及温顺的脾气,也被作为宠物广泛饲养(Yuetal.,2018a)。豚鼠毛色具有丰富的多样性(Yuetal.,2018b),早期测交试验表明,豚鼠毛色主要由7个基因座位的一系列等位基因控制,同一座位的不同等位基因或不同座位的等位基因相互作用可产生多种毛色类型(Wright,1927)。野生型豚鼠毛发除腹部白色外,其他部位呈鼠灰色,黄毛色豚鼠身体各部位均为黄色(图1)。已有研究表明,豚鼠黄毛色呈孟德尔常染色体隐性遗传模式,由extension基因座位的e等位基因控制(Ibsen,1919)。extension基因座位编码黑素皮质激素受体1(melanocortin receptor 1,MC1R),该蛋白有7个跨膜结构域,是最小的G蛋白偶联受体(García-Borrónetal.,2005)。MC1R与黑色素细胞刺激激素α结合,通过激活膜上的腺苷酸环化酶系统,然后通过环磷酸腺苷激活酪氨酸激酶催化黑色素细胞内的酪氨酸合成黑色素(杨永升等,2004)。由于MC1R在动物毛色形成与调控中扮演着重要的角色,其编码基因的多态性与动物毛色的相关性已在多个物种中被广泛研究,现已表明小鼠Musmusculus(Robbinsetal.,1993)、牛Bostarurs(Klunglandetal.,1995)、马Equnscaballus(Marklundetal.,1996)、野猪Susscrofa(Kijasetal.,1998)、犬Canislupusfamiliaris(Evertsetal.,2000)和兔Oryctolaguscuniculus(Fontanesietal.,2006)的隐性黄毛色均与MC1R基因的多态性有关。本实验选择MC1R基因为豚鼠隐性黄毛色突变的候选基因,采用PCR扩增和测序方法分析了MC1R基因多态性与豚鼠隐性黄毛色的相关性。
1 材料与方法
1.1 试验动物
实验豚鼠来自吉林省长春市农安县相龙养殖场,分别采集60只野生型和33只黄毛色豚鼠背部毛发20~30根,存放于样品袋中,-20 ℃保存备用;2只野生型雌性和1只黄毛色雄性豚鼠用于测交实验。豚鼠测交实验在吉林大学实验动物中心完成[实验动物许可证号:SYXK(吉)2015-0006]。实验方案经吉林大学实验动物福利伦理委员会批准通过。

图1 野生型(左)和黄毛色(右)豚鼠的毛色表型Fig. 1 Phenotype of wild-type (left) and yellow-coatedcolor (right) Cavia porcellus
1.2 主要试剂
微量DNA提取试剂盒(EasyPure Micro Genomic DNA Kit)购自北京全式金生物技术有限公司,2×Taq PCR Mastermix、DL2000 DNA Marker和琼脂糖凝胶DNA回收试剂盒购自天根生化科技(北京)有限公司,其他试剂均为国产或进口分析纯。
1.3 试验方法
1.3.1 引物设计与合成利用小鼠MC1R基因全长编码区序列(NM_008559.2)在豚鼠参考基因组中进行Blast检索(https://blast.ncbi.nlm.nih.gov/Blast.cgi),获得豚鼠MC1R基因的位置和编码序列(NT_176187.1),然后采用Primer Premier 5.0设计引物,引物的名称、位置以及核苷酸序列的详细信息见表1和图2,引物由生工生物工程(上海)股份有限公司合成。
1.3.2 PCR扩增与测序选取野生型和黄毛色豚鼠各2只用于MC1R基因多态性的鉴定。毛囊DNA的提取采用北京全式金生物技术有限公司的微量DNA提取试剂盒,操作按说明书进行。PCR反应体系为20 μL:2×PCR Master Mix 10 μL,DNA 模板1 μL,正、反向引物(10 μmol·L-1)各0.5 μL,ddH2O 8 μL。PCR扩增条件:95 ℃ 2 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s,共30个循环;72 ℃ 8 min。PCR产物经2.0%琼脂糖凝胶电泳检测,切胶回收扩增条带送生工生物工程(上海)股份有限公司测序。

图2 豚鼠MC1R基因的编码区、断裂位点以及PCR扩增引物示意图
Fig. 2 The diagrammatic sketch of coding region, breakpoints and amplification primers ofMC1Rgene inCaviaporcellus
参考序列来源于NCBI核酸数据库中的NT_176187.1, 阴影部分表示MC1R基因的编码区, 水平箭头表示引物的位置和扩增方向, 垂直箭头表示缺失发生的位置
Reference sequence is based on NT_176187.1 in NCBI nucleic acid database, the shadow region indicates the coding sequence ofMC1Rgene, the horizontal arrows indicate the positions and amplification direction of primers, and the vertical arrows indicate the breakpoints

表1 引物名称、序列和位置Table 1 Name, sequence and location of primers
注: 引物序列的位置依据NCBI核酸数据库中的NT_176187.1
Note: Location of primer sequence is based on NT_176187.1 in NCBI nucleic acid database
1.3.3 序列比对和同源性分析采用DNAMAN进行序列拼接和同源性分析,Primer Premier 5.0进行编码区氨基酸的翻译。在GenBank数据库中下载相关物种MC1R基因编码的氨基酸序列进行同源性分析(https://www.ncbi.nlm.nih.gov/)。
1.3.4 多态性位点的基因分型依据MC1R基因在野生型和黄毛色个体之间的DNA序列长度多态性,以T-MC-F、T-MC-R2和T-MC-3-R2为引物进行PCR扩增,对89只豚鼠进行基因分型,其中包括58只野生型和31只黄毛色。PCR扩增体系和扩增条件与1.3.2相同。PCR产物用2.0%琼脂糖凝胶电泳检测,依据扩增片段确定每只个体的基因型。
1.3.5 动物测交试验与基因分型选取2只具有野生型表型的MC1R基因缺失杂合子雌性豚鼠与1只黄毛色雄性个体交配,对所有后代进行基因型分析,基因型分型方法同上。
2 结果
2.1 MC1R基因编码序列扩增与分析
以T-MC-F和T-MC-R为引物进行PCR扩增,2.0%琼脂糖凝胶电泳检测结果表明,2只野生型个体中均能扩增出与预期大小相符的目的条带,而黄毛色个体中没有目的条带扩增。测序结果表明,野生型个体基因组中扩增条带为1 249 bp,包括 151 bp 的5’非翻译区域、147 bp的3’非翻译区域和951 bp的编码序列(包括终止密码子)。野生型豚鼠MC1R基因编码氨基酸序列与GenBank数据库中的犬(AGG12071)、人Homosapiens(NP_002377)、小鼠(NP_032585)、兔(CBJ17601)、牛(NP_776533)和野猪(AQU43257)的同源性分别为78.4%、77.1%、77.0%、76.8%、75.9%和74.3%。
2.2 MC1R基因缺失位点的鉴定
由于引物T-MC-F和T-MC-R不能在黄毛色豚鼠中扩增MC1R基因编码区序列,推测该基因可能存在缺失多态性。在编码区上游(5’端)设计了1对引物(T-MC-5-F1和T-MC-5-R1),经PCR扩增,在野生型和黄毛色豚鼠基因组中均能扩增605 bp 的目的片段;在编码区下游(3’端)设计了2对引物,其中引物组合T-MC-3-F1和T-MC-3-R1只能从野生型中扩增323 bp目的片段,但引物组合T-MC-3-F2和T-MC-3-R2从野生型和黄毛色豚鼠中均能扩增345 bp目的片段。以分别位于MC1R基因编码区上游和下游引物T-MC-5-F1和T-MC-3-R2进行PCR扩增,电泳结果表明,野生型豚鼠中无扩增条带,但黄毛色豚鼠中有1 196 bp特异性扩增片段。然后分别以T-MC-5-F1和T-MC-R2以及T-MC-3-F1和T-MC-3-R2为引物组合对野生型豚鼠MC1R基因的5’端和3’端进行PCR扩增和测序,证明黄毛色豚鼠该基因存在 2 760 bp 的缺失,其位于参考基因组(NT_176187.1)第603 260 bp至第606 019 bp,其中包括了整个编码区和两侧部分序列(图3)。

图3 MC1R基因缺失区域的测序鉴定Fig. 3 Identification of the deletion region of MC1R gene by DNA sequencing
E. 野生型等位基因,e. 缺失突变等位基因
E. wild-type allele,e. allele of the deletion mutation
2.3 MC1R基因缺失多态性的基因分型
基因分型结果表明,在2种毛色表型个体中存在E和e2种等位基因,其中,引物T-MC-F和T-MC-R2 扩增长度为288 bp的野生型等位基因(E),而引物T-MC-F和T-MC-3-R2扩增长度为448 bp的缺失等位基因(e)。58只野生型个体中,36只为EE纯合子,22只为Ee杂合子,而31只黄毛色个体均为ee纯合子。图4为部分个体的基因分型电泳结果。
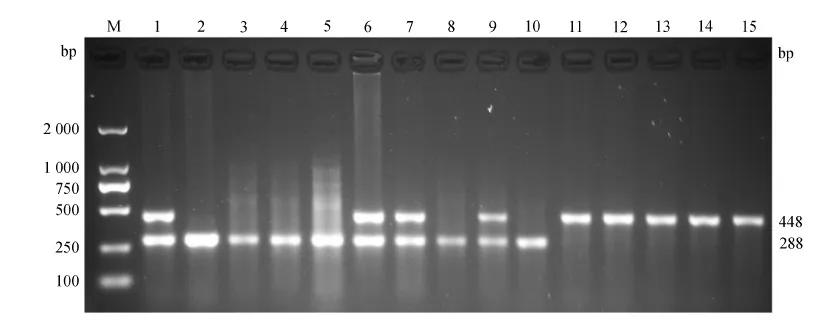
图4 MC1R基因缺失多态性的基因分型Fig. 4 Genotyping of deletion polymorphism of MC1R gene
M. DL2000 DNA Marker, 1~10. 野生型豚鼠, 11~15. 黄毛色豚鼠
M. DL2000 DNA Marker, 1-10. wild-typeCaviaporcellus, 11-15. yellow-coated colorC.porcellus
2.4 MC1R基因多态性的系谱分析
通过测交试验,2个家系共获得15只后代,其中野生型个体8只,黄毛色个体7只,基因分型结果表明,8只野生型个体均为Ee杂合子,而7只黄毛色个体均为ee纯合子(图5),表明豚鼠的隐性黄毛色符合常染色体隐性遗传方式。
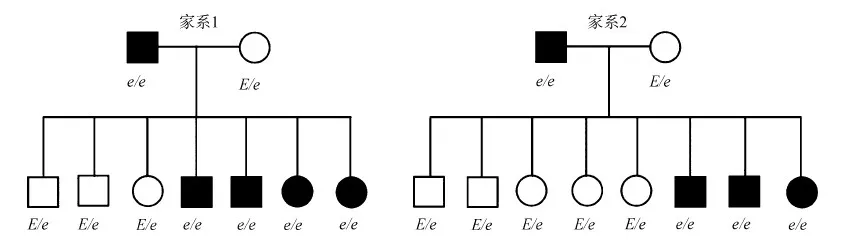
图5 豚鼠MC1R基因多态性的系谱分析
Fig. 5 Pedigree analysis ofMC1Rgene polymorphism ofCaviaporcellus
○ 雌性野生型, □ 雄性野生型, ● 雌性黄毛色, ■ 雄性黄毛色
○ female wild-type, □ male wild-type, ● female yellow-coated, ■ male yellow-coated
3 讨论
动物毛色形成过程从最开始的神经嵴细胞发育为成熟的黑色素细胞,再到黑色素细胞分泌黑色素以及黑色素的包装与转运,整个过程受到众多信号通路的调控,其中任一基因发生突变都将可能导致动物毛色的改变(Thomas & Erickson,2008)。目前,对动物毛色多样性的分子遗传基础研究主要采用候选基因法、遗传标记连锁分析法和基因组重测序法(Baueretal.,2018;Langevinetal.,2018)。
本实验首先用T-MC-F和T-MC-R为引物对野生型和黄毛色豚鼠的编码序列进行PCR扩增,发现黄毛色豚鼠基因组中无扩增片段,推测MC1R基因可能存在缺失,但缺失片段的大小和缺失区域并不清楚。因此,从MC1R基因编码区的5’端和3’端开始分别设计引物扩增不同的区域,直到能在2种毛色个体中均能成功扩增为止。通过该方法将MC1R缺失区域定位于引物T-MC-5-F1和T-MC-3-R2之间;通过PCR扩增与测序成功鉴定了黄毛色豚鼠MC1R等位基因e缺失的2 760 bp,包括MC1R基因的整个编码区及部分侧翼序列。Vidal(2018)对 3种毛色表型(黄/白、黑/黄/白和黑/白)豚鼠的MC1R基因编码区进行比较,鉴定了1个同义突变(c.654T>C)、2个错义突变(c.749T>A和c.872C>T)和1个2 760 bp的缺失,群体基因分型和测交实验证实c.749T>A多态性和缺失突变均与豚鼠的黄毛色相关。本实验对2只野生型毛色豚鼠的MC1R基因编码序列进行了测序,获得的序列与参考基因组序列完全相同;在纯黄毛色的MC1R基因中发现了2 760 bp的缺失,其断裂位点与Vidal(2018)所报道的一致(MH450219.1)。MC1R受体的缺失功能性突变可使黑色素合成过程中真黑色素向伪黑色素转变(Rees,2000),从而使动物的毛色表型发生改变,例如犬的MC1R受体第306位氨基酸由精氨酸到终止密码子(R306ter)的无义突变与犬的黄毛色表型相关(Evertsetal.,2000;Newtonetal.,2000)。因此豚鼠黄毛色表型可能是由于MC1R基因部分序列的缺失从而不能产生有功能的MC1R受体所导致。
为了建立针对等位基因e的2 760 bp缺失的基因分型方法,本实验在PCR扩增体系中添加3条引物,T-MC-F和T-MC-R2引物组合能扩增等位基因E上288 bp的片段,而T-MC-F和T-MC-3-R2引物组合能扩增等位基因e上448 bp的片段。PCR产物经琼脂糖凝胶电泳能准确区分3种基因型。由于等位基因E对e完全显性,EE纯合子和Ee杂合子的表型一致,从表型不能直接推测其基因型,利用本实验建立的针对MC1R基因缺失的PCR分型方法可以简单地确定各个体的基因型,从而加速豚鼠毛色纯系选育的进程。
4 结论
豚鼠MC1R基因存在2 760 bp的缺失多态性,包括全长编码区和部分侧翼序列。该缺失与豚鼠的黄毛色完全相关,即豚鼠黄毛色是由于MC1R基因的缺失所致。

