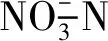罗非鱼藻菌共处型生物絮团养殖系统的初步探究
于永霞,罗国芝,2,3,刘文畅,谭洪新,2,3*,张南南,黎 爽,付贤茂
(1.上海海洋大学上海水产养殖工程技术研究中心,上海 201306;2.上海海洋大学农业部淡水水产种质资源重点实验室,上海 201306;3.上海海洋大学水产科学国家级实验教学示范中心,上海 201306)
罗非鱼(Oreochromisniloticus)因其摄食范围广、抗病能力强、生长速度快等优势成为一种重要的经济鱼类[1]。目前其养殖模式主要有池塘养殖、网箱养殖、稻田养殖和生物絮团技术(Biofloc technology,BFT)养殖等。其中,BFT养殖系统在水质调控、提供天然饵料、节约饲料、水生动物越冬和单位水体的终末产量等方面具有一定的优势[2-3]。


当前,相关研究主要采用异养同化作用为主的BFT养殖南美白对虾(Litopenaeusvannamei)和罗非鱼等水产动物,鲜有结合细菌的自养硝化作用和微藻的光合作用进行罗非鱼BFT养殖的相关报道[2,4,7]。因此,本实验旨在探讨藻菌共处型和全菌型生物絮团系统养殖吉富罗非鱼(GIFT,Oreochromisniloticus)的优势,为罗非鱼藻菌共处型生物絮团养殖系统的应用提供参考。
1 材料与方法
1.1 养殖设施
实验采用6个室内玻璃纤维养殖缸(直径110 cm,全高90 cm,底部为锥形,锥高30 cm,工作容积300 L),分别设为藻菌共处型生物絮团系统(实验组)和全菌型生物絮团系统(对照组),每组3个重复。所有养殖缸置于室内并通过支架覆盖有双层遮阳网。实验组每个养殖缸上方悬挂1个LED灯(型号TY-LED,功率:400 W),距工作水面38 cm。每个养殖缸锥底设有一个直径20 cm的刚玉曝气石,通过气体流量计(型号LZB-10,1.0 m3/h)连接一台空气泵(型号HG-750,浙江森森集团股份有限公司),使用加热棒(型号:AH-300,额定功率:300 W)控制养殖系统水温(T)。
1.2 实验鱼及饲料
吉富品系罗非鱼购自广东省花鲳水产养殖场。实验鱼先在一套循环水养殖系统中暂养一周。整个暂养和实验期间投喂通威饲料,其主要成分含量/%:粗蛋白质≥30.0、粗纤维≥13.0、粗脂肪≥3.0、粗灰分≤15.0、0.50≤钙≤2.00、总磷≥0.90、0.30≤氯化钠≤1.20、水分≤12.5、赖氨酸≥1.20。实验用水为曝气48 h后的自来水,pH7.5。
1.3 实验设计及管理
实验组模拟自然光照昼夜节律,控制为12L∶12D。实验组LED灯工作时,养殖水面光照度为(9 056.67±89.63)lx;LED灯未工作时,养殖水面光照度为(0.12±0.03)lx。对照组24 h不提供光照,养殖水面光照度(0.13±0.06)lx。对照组除了日常维护和采样过程中提供的手电筒光照外,并无其它光照且每天少于30 min。实验进行了114 d。
实验鱼初始体质量(0.94±0.04)g,每缸放养30尾,初始放养密度0.094 kg/m3。实验期间,每天分3次投喂饵料,投喂时间分别为每天的8∶00、12∶30和18∶30。每7 d随机取样称重1次用于调整投喂量。个体质量为小于2.3、2.3~5.5、5.5~23.5、23.5~36.5、大于36.5 g期间,日投饵率分别为15%、7.5%、5%、3%和2%。
实验采用一水葡萄糖(有机碳含量35.69%,呼伦贝尔东北阜丰生物科技有限公司生产)作为额外碳源。前三周,每日额外碳源的添加量和C/N计算值参考Avnimelech[15]的报道:实验第一周、第二周和第三周控制C/N分别为30、20和10(每日葡萄糖总量均分两次添加,添加时间分别为10∶30和16∶30)。随后停止添加葡萄糖也可控制水质[16]。随着养殖系统pH和碱度的降低,实验自第50天起,用碳酸氢钠(河南省桐柏博源新型化工有限公司生产)调节碱度,日投加NaHCO3总质量为日投饵料总质量的25%[17]。实验期间不调节总悬浮固体颗粒物(Total suspended solids,TSS)、不换水,仅补充蒸发损耗的水量。实验期间实验组和对照组的溶解氧(DO)分别为(7.75±0.43)和(7.72±0.45)mg/L,水温分别为(25.81±1.68)和(25.59±1.42)℃,pH分别为7.77±0.38和7.59±0.47。
1.4 测试指标和方法
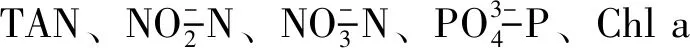
养殖第114天,每个养殖缸取5条鱼,MS-222麻醉,尾静脉取血,4 ℃下4 000 r/min离心10 min,取血清,-80 ℃保存待测;解剖取肝脏,用低温生理盐水制成组织匀浆,4 ℃下4 000 r/min离心10 min,取上清去沉淀,-80 ℃保存待测。溶菌酶(LZM)测定采用比浊法;碱性磷酸酶活力(AKP)采用对硝基苯磷酸盐法;总超氧化物岐化酶活力(T-SOD)测定采用黄嘌呤氧化酶法;采用南京建成相关试剂盒和方法进行测定。
实验结束后,实验用鱼饥饿处理24 h后,记录每个缸的养殖罗非鱼余数,计算成活率(SR),并将每条鱼进行称重并根据公式计算终末密度(FD)、增重率(WGR)、特定生长率(SGR)、饲料系数(FCR)和蛋白质效率(PER)。计算公式如下:
成活率(SR)=Nt/N×100%
终末密度(FD,kg/m3)=W2×Nt/V
增重率(WGR)=(W2-W1)/W1×100%
特定生长率(SGR)=[(lnW2-lnW1)/(t2-t1)]×100%
饲料系数(FCR)=F/(W2N2-W1N1)
蛋白质效率(PER)=(W2-W1)/(F×0.44)×100%
式中,W1和W2为时间t1和t2时的平均体重(g),且t1和t2分别为实验第1天和最后一天;N2为收获尾数,N1为放养尾数;F为t1~t2天食物总摄入量(g);V表示养殖缸体积。
1.5 数据分析
采用SPSS 19.0对数据进行单因素方差分析(One-Way ANOVA),实验结果用平均值±标准差表示,显著水平为P<0.05。
2 结果与分析
2.1 养殖水质的变化
实验期间Chl a和无机氮的浓度变化如图1所示。

图1 养殖期间叶绿素 a含量(a),总氨氮浓度(b),亚硝酸盐氮浓度(c)和硝酸盐氮浓度(d)的动态变化Fig.1 Dynamic changes of Chl a(a),total ammonia nitrogen(b),nitrite nitrogen (c),nitrate nitrogen(d)throughout the culture period
两组的Chl a有明显差别。实验1-21 d(额外碳源添加期间),实验组和对照组Chl a浓度持续小于35.45 μg/L。随后,实验22-49 d,实验组Chl a浓度持续上升达到最大值772.84 μg/L,50-74 d维持在相对稳定水平570.41~772.84 μg/L,75-114 d逐渐降低至400 μg/L以下水平。对照组22-114 d叶绿素a浓度持续小于2.98 μg/L的极低水平。

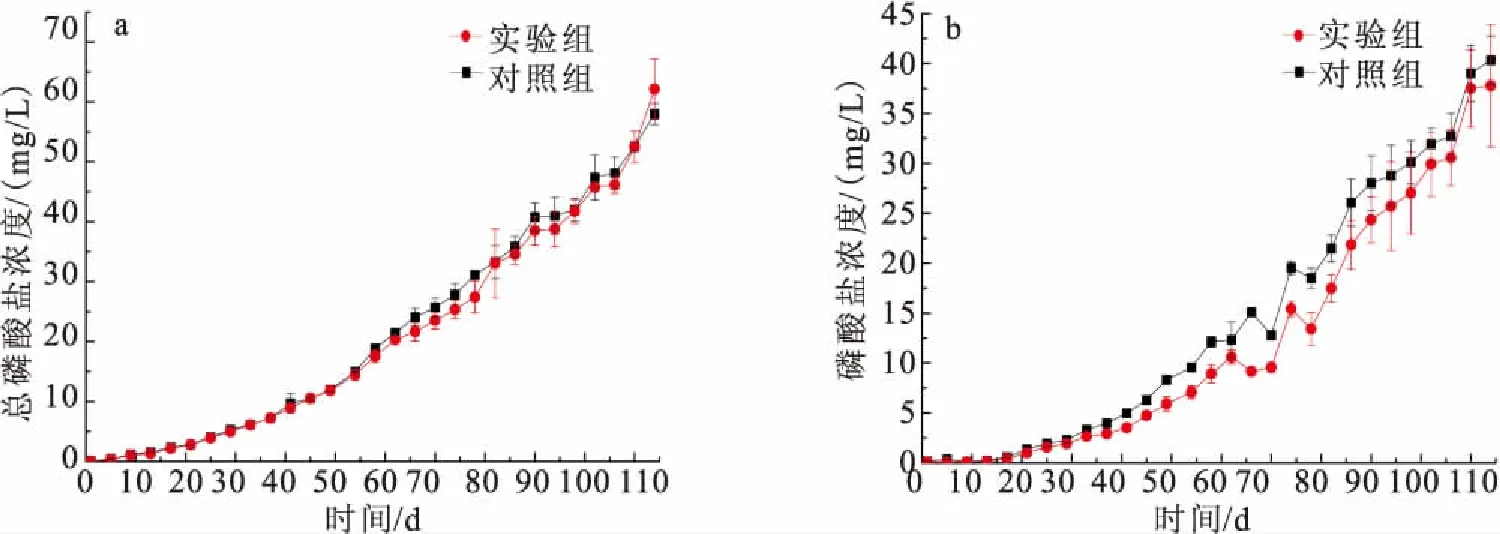
图2 养殖期间总磷酸盐浓度(a)和磷酸盐浓度(b)的动态变化Fig.2 Dynamic changes of total phosphate(a),orthophosphate(b)throughout the culture period
实验期间碱度的浓度变化如图3所示。实验过程中1-49 d两组不添加NaHCO3,第50天开始投加,当碱度>100 mg/L时,停止添加。实验组和对照组碱度在1-25 d和87-114 d没有差异,26-86 d,实验组显著高于对照组。第29天实验组碱度达到最高值131.99 mg/L后开始下降,而对照组在第21天达到最高值121.64 mg/L后开始下降,总体上实验组的碱度高于对照组。
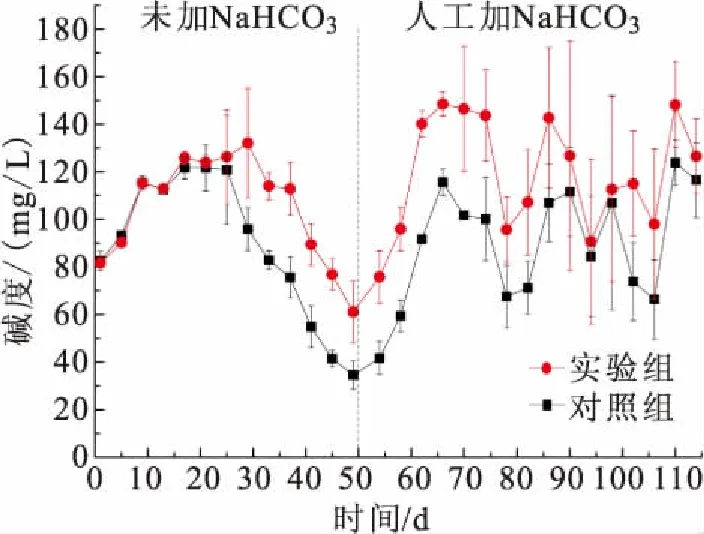
图3 养殖期间碱度的动态变化Fig.3 Dynamic changes of alkalinity throughout the culture period
实验期间TSS和FV的浓度变化如图4所示。养殖前期,TSS和FV的浓度持续增加,养殖后期波动上升。养殖期间,实验组TSS最高浓度为(658.33±87.12)mg/L,对照组为(529.33±41.05)mg/L。FV在对照组的第13天出现迅速升高的现象,然后降低,最后逐步增加;但是,实验组始终为逐步增加的现象。
2.2 生长性能
实验结束后,实验组和对照组罗非鱼的成活率分别为(85.56±7.70)%和(74.44±11.71)%,无显著差异(表1),FCR、FW、FD、WGR、SGR和PER也无显著差异。
2.3 非特异免疫酶活性
由表2可知,实验组罗非鱼的血清中LZM和T-SOD均高于对照组,AKP显著低于对照组。肝胰脏中,两组的AKP和T-SOD均无显著性差异,但实验组LZM显著低于对照组。
3 讨论
3.1 藻菌共处生物絮团系统对吉富罗非鱼养殖水质的影响
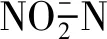

图4 养殖期间总悬浮固体颗粒(a)和絮体体积(b)的动态变化Fig.4 Dynamic changes of total suspend solid (a),floc volume (b)throughout the culture period

n=3
注:同列上标不同字母表示差异显著(P<0.05)。下同
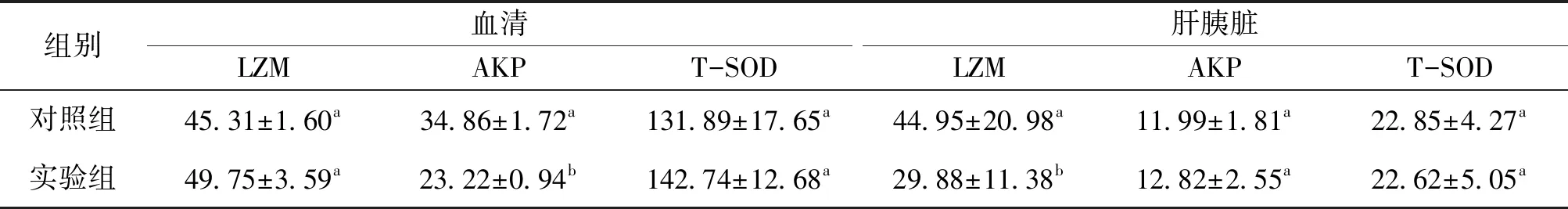
表2 两种生物絮团养殖系统中罗非鱼的非特异免疫能力Tab.2 Effects of two BFT systems on non-specific immune related enzymes of tilapia n=15/(U·g-1)

3.2 藻菌共处生物絮团系统对吉富罗非鱼生长性能的影响
Wilson等[26]认为絮团可以为虾提供天然饵料,并加速虾的生长。Ju等[24]认为,絮团中的微藻可能有利于提高虾的生长速率。本实验结果表明,实验组SR高于对照组,FCR低于对照组,这说明罗非鱼在藻菌共处型生物絮团中,更容易存活,且降低饲料成本,这符合Jung等[11]研究结果,微藻结合水体中的小颗粒等物质形成饵料被罗非鱼食用。
3.3 微藻消亡对生物絮团系统中罗非鱼免疫能力的影响
鱼类在生长过程中非特异性免疫能力起着重要的作用,非特性免疫因子包括AKP、LZM和T-SOD等,这些因子可以反映鱼体对生长环境或饵料等因子的适应程度[27-28]。本实验在微藻消亡期(第114天)取样测定,结果显示,实验组鱼体血清AKP和肝胰腺LZM活性均显著低于对照组,可能与此时微藻消亡有关。王潮辉等[28]研究表明,鱼体摄食含有益生菌等物质的絮团,可增强对地域环境的胁迫能力,而Zhi等[13]研究表明,细菌释放细菌毒素抑制藻细胞生长,并会向水体或生物絮团释放有毒物质,导致鱼体的营养物质、生存空间等理化环境受到限制,使得非特异性免疫能力下降。