肝脏影像报告和数据系统(LI-RADS)中MRI辅助特征的解读
吕蓉 于长路*
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝脏恶性肿瘤,为世界第5大常见肿瘤,在肿瘤性致死原因中排列第3位[1-3],HCC的早期识别可以大幅度提高病人的生存率[4]。增强MRI具有较高的软组织对比度,可多序列、多参数成像,较CT的检出率和敏感性更高[5-6],对HCC的诊断具有重要价值。肝脏影像报告及数据系统(the Liver Imaging Reporting And Data System,LI-RADS) 是一个用于标准化肝成像术语、技术、解释、报告和数据收集的综合系统,专门为面临肝癌风险的病人而建立[7]。该系统详细阐述了HCC的典型征象和辅助特征,本文就HCC非特异性恶性特征和HCC特异性征象等辅助特征进行详细解读。
1 HCC的典型影像表现
HCC的典型影像表现包括动脉期明显强化、门静脉/平衡期的廓清和“包膜”[8]。HCC的发展过程是从主要由门静脉供血到主要由肝动脉供血,因此在动脉期HCC表现为明显强化。由于血液通过HCC病灶进入肝静脉的速度比正常肝实质快,在门静脉/平衡期HCC表现为一种典型的廓清表现[5,8](图1)。在HCC高风险人群中,这种“快进快出”典型表现的诊断敏感度为64%~89%,特异度为96%,阳性预测值为93%[8]。“包膜”也是一种重要的诊断征象,“包膜”通常可以是肿块周边被压缩的肝实质、纤维成分或扩张的血窦/血管,也可以是这些成分的组合,这种“包膜”征象通常在高级别HCC病灶中出现,光滑的“包膜”可以在门静脉期及延迟期呈持续明显强化(图2)。有研究[9-10]报道,对于HCC高危人群,这种“包膜”征象的诊断特异度为83%~96%,但敏感度不高,为43%~55%。即使没有扫描后期典型的“廓清”表现,只有动脉期明显强化和典型的“包膜”表现也可以高度提示 HCC[5,11](图 3),并且 MRI对“包膜”的显示优于CT[12-13]。

图1 病人男,56岁,HCC。T1WI上显示肝尾状叶一低信号(A)、T2WI上稍高信号(B)结节,DWI呈高信号(C),动脉期明显强化(D),门静脉期(E)和延迟期(F)廓清。

图2 病人男,48岁,HCC。T1WI上示肝左叶一低信号(A)、T2WI上稍高信号(B)结节,动脉期明显强化(C),门静脉期(D)和延迟期(E)廓清,并可见包膜延迟强化。
2 LI-RADS的提出
美国肝病研究会 (American Association for the Study of Liver Diseases,AASLD)、欧洲肝病研究学会(European Association for the Study of Liver Disease,EASLD)、亚太肝病研究学会(Asian Pacific Association for the Study of Liver Disease,APASLD)、 器官获取和移植网络 (Organ Procurement and Transplantation Network,OPTN)等组织制定了严格的HCC诊断标准,但这些标准中只强调了HCC的诊断,缺乏针对HCC征象术语的准确描述[14-16],不能为影像医生提供完整的指导。因此,美国放射学会(American College of Radiology,ACR)根据HCC的影像研究成果,基于专家共识发布了LI-RADS,旨在提高影像检查在HCC高危病人中的诊断效能,并进一步规范影像的解释标准[11]。该系统在2011年发布,并在2014年和2017年进行了2次更新。LI-RADS最初把病灶分为 5 类:LR-1(绝对为良性)、LR-2(可能为良性)、LR-3 (可疑 HCC)、LR-4 (可能为 HCC)、LR-5(肯定为 HCC)[11]。 2014 版新增了 LR-5us(us=超声)和 LR-5g(g=增长)的分类[17]。2017 版又新增了LR-NC分类,即无法分类的病灶;修改LR-5V为LR-TIV(静脉内肿瘤,tumor in vein)(图 4),使表达更加准确[18]。

图3 病人女,61岁,HCC。T1WI上示肝左外叶一稍低信号(A)、T2WI上稍高信号(B)结节,动脉期明显强化(C),门静脉期(D)和延迟期(E)廓清不显著,但可见包膜延迟强化。
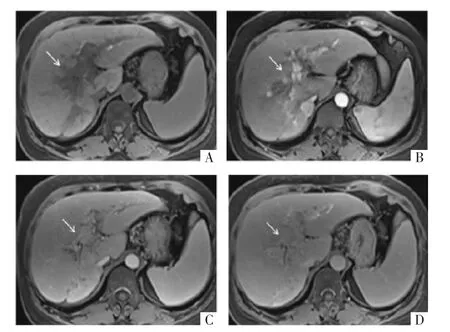
图4 病人女,49岁,HCC。T1WI上示门静脉主干及其肝内分支内低信号影(A),动脉期明显强化(B),门静脉期强化程度减低(C),延迟期呈低信号充盈缺损(D),诊断为门静脉内瘤栓。
3 LI-RADS中MRI辅助特征
LI-RADS中描述的辅助影像特征可以分为有利于良性诊断的和倾向于恶性诊断的特征,而后者又进一步被细分为非特异性恶性特征和HCC特异性征象[5,11]。
3.1 非特异性恶性特征
3.1.1 轻至中度T2高信号 轻至中度T2高信号高度提示恶性肿瘤[11]。在T2WI上,肝硬化结节和不典型增生结节(dysplastic nodules,DN)常表现为特征性的等或低信号(图5),因此该特征可用于肝硬化结节和DN与小HCC的鉴别,特别是当后者表现为没有廓清的富血供结节时。轻至中度T2高信号在HCC诊断中的特异度和阳性预测值分别为73%~100%和 72%~100%[10,19]。在 AASLD 标准中更是指出T2WI高信号可以提高HCC的检出率,特别是当结节直径<20 mm时,敏感度可从67.6%提高到79%[20]。Sofue等[21]评估了56例从LR-4升级到LR-5的病灶,分析其造成升级原因的MRI影像特征,其中轻至中度T2高信号和病灶增长有统计学意义。T2WI和DWI的高信号也可用于区分乏血供HCC和在肝胆期表现为低信号的DN[22]。但是值得注意的是,许多分化良好的HCC和一些小的、中度分化的HCC病灶在T2WI上可以表现为等或低信号,同时,一些转移瘤和肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)则可以表现为轻度T2高信号[5]。
3.1.2 扩散受限 由于HCC的细胞组织密集,在DWI上会出现扩散受限的高信号表现(图6)[23]。相反,良性结节通常与其周围组织呈现相似的微观结构,因此保留了自由水运动,在DWI上不出现扩散受限。另外,由于治疗引起的坏死和炎症,其DWI的扩散受限会不断减轻,而残存肿瘤组织则表现为持续的扩散受限[23],因此DWI还可以用于疗效评估。
一些研究者[24-25]比较了DWI和对比增强序列在HCC诊断上的敏感度,发现DWI对<20 mm病灶的敏感度较低,而病变>20 mm时,则与对比增强序列的敏感度相似。尽管如此,几乎所有报道均表明,DWI可以作为HCC的诊断标准之一,能提高常规MRI诊断的敏感度,且当两者联合使用时,其诊断敏感度最优[26]。值得注意的是,肝硬化时可能由于肝实质本身纤维化组织丰富而表现为DWI扩散受限,此时HCC在DWI上的高信号则不易显示[18]。另外,一些小病灶,特别是<20 mm的HCC,在 DWI上也很难表现出扩散受限。
3.1.3 病灶内乏脂 对于有HCC风险同时肝脏脂肪浸润的病人,如果可疑病变的脂肪含量低于背景肝脏,则是有利于HCC诊断的辅助特征(图7)。但这仅适用于脂肪肝背景的病人,同时还需要与残存肝岛相鉴别[3,8]。

图5 病人男,63岁,肝硬化。肝脏轮廓不规整,边缘不光滑,肝叶比例失调,可见T1WI上肝左外叶稍高信号(A)、T2WI上稍低信号(B)结节,动脉期强化不明显(C),门静脉期(D)、过渡期(E)呈等信号,肝胆期结节信号未降低(F),诊断为肝硬化结节。

图6 病人男,61岁,HCC。可见T1WI上(A)肝右叶一稍高信号、T2WI上(B)稍高信号结节,DWI上(C)呈高信号,ADC图上呈低信号(D),动脉期明显强化(E),门静脉期(F)、过渡期(G)、肝胆期(H)廓清。
3.1.4 病灶内乏铁 因为高级别DN和HCC细胞失去了浓缩铁的能力,因此当在铁过载的肝实质内出现乏铁的实性结节时则高度提示癌前病变或恶性肿瘤。与病灶内乏脂一样,该特征仅适用于铁过载的肝脏背景下。
病灶内乏铁不是HCC的特异性征象,它也可以在其他恶性肿瘤(如ICC)或非恶性过程(如融合性纤维化)中出现[5]。
3.1.5 晕环状强化 晕环状强化定义为病灶边缘的带状明显强化影。这种表现一般在动脉晚期或门静脉早期出现(图8)[11],代表对比剂从肿瘤动脉增强区域经引流血管向肿瘤周围实质的快速引流,肿瘤自身开始强化后几秒钟便可出现这一过程[5,11]。该特征也可以出现在转移瘤等其他富血供病变中,因此不是HCC的特异性征象。在一些动脉期呈弥漫性显著强化的病变中,“晕环状强化”和“包膜”可能不易区分。如果边缘强化在延迟期减低则提示“晕环状强化”;在延迟期增加则提示为“包膜”[11]。
由于晕环状强化一般存在于分化程度较低的病变中,因此也可预测预后。此外,有研究表明[27],大的、不规则或扭曲的晕环状强化可提示微血管的侵袭。HCC切除或射频消融治疗后出现的转移性结节或局部复发结节也可出现晕环状强化。

图7 病人女,59岁,HCC。T1WI上示肝左外叶一等信号(A)、T2WI上高信号(B)结节,同相位呈等信号(C),反相位结节信号未减低(D),其余肝实质信号减低,提示为脂肪肝,DWI上结节呈高信号(E),动脉期明显强化(F),门静脉期(G)、过渡期(H)、肝胆期(I)廓清。

图8 病人女,42岁,HCC。T2WI上示肝右叶(S7段)一稍高信号小结节(A),DWI上呈高信号(B),动脉期(C)、门静脉期(D)可见晕环状强化,延迟期廓清(E)。
3.1.6 直径增长小于阈值增长 LI-RADS中指出,阈值增长的定义是病灶直径至少增加5 mm,且符合以下3个条件之一者:①6个月内病灶直径增长≥50%;②6个月以上病灶直径增长≥100%;③2年时间内,新发肿物最大径≥10 mm。直径增长小于阈值增长是有助于HCC诊断的辅助特征。在测量时应在最清晰序列的病灶最大层面上取其最大直径。要注意避免在存在解剖学失真的影像上测量,如一般不选择动脉期影像,因为病灶边缘强化有可能会影响测量结果。
3.1.7 肝细胞/肝胆特异性对比剂 目前临床广泛使用的钆塞酸二钠 (Gd-EOB-DTPA;Gadoxetic acid disodium,Eovist®/Primovist®;Bayer Healthcare;商品名:普美显,德国拜耳公司)是肝胆特异性对比剂的代表。它具有高度的肝细胞特异性,主要通过有机阴离子转运多肽 (organic anionic transporting polypeptides,OATP)进行摄取,经一种叫多耐药相关蛋白 (multidrug resistance-associated proteins,MRP)的细胞膜转运蛋白排泄,而OATP-MRP通道蛋白的表达除了受多种转录因子的调控以外,与肿瘤细胞的生物学行为密切相关[28]。由于在肝癌发生过程中OATP表达降低,在肝胆期影像上大多数HCC表现为高信号强度的肝实质背景下的局限性低信号区[29-30]。
但还需注意以下几点:①10%~12%的HCC病灶,由于其分化良好,保留了足够的肝细胞和OATP表达,在肝胆期表现为高信号[5,29]。②一些良性病变可能存在“假性廓清”现象,这可能与肝胆特异性对比剂作为细胞外液对比剂使用时表现不理想有关。使用Gd-EOB-DTPA扫描时,一般没有传统的延迟期影像,而只是在门静脉期和肝胆期之间进行过渡期扫描,这一期相是门静脉期和肝胆期的重叠,也是其从细胞外液对比剂向细胞内液对比剂转换的阶段,这一期相由于肝实质背景的对比增强很明显,而使病灶呈现出相对低信号的“假性廓清”现象[6,30]。③由于晚期肝硬化肝细胞受损,影响背景肝对对比剂的摄取,使其与病变之间的信号强度差减小[12],造成早期HCC在肝胆期上不易显示。

图9 病人男,55岁,HCC。同相位上(A)示肝右叶一混杂信号结节,其内可见局部呈稍高信号(粗箭),反相位上(B)该处呈明显低信号(粗箭),提示病灶内含脂。T2WI上(C)示稍高信号结节,动脉期病灶明显强化(D),门静脉期(E)、延迟期(F)廓清,并可见包膜强化。
3.2 HCC特异性征象
3.2.1 病灶内含脂 病灶内含脂是指病灶内的脂肪浓度高于背景肝实质(图9)。可以利用同反相位影像观察病灶内是否含脂。虽然这一征象的敏感度(12%~37%)不高,特异度为 68%~91%[16],但在 HCC高风险人群中,可疑结节中的病灶内含脂常常提示HCC的诊断,或至少提示为癌前病变,临床应进行更密切的随访[8,11]。
由于病灶内含脂是早期HCC的特征,具有这一征象的病灶常常比不含脂的HCC病灶具有更长的进展周期,发生转移的风险也比后者小[8],因此这一征象具有一定的预后价值。但当HCC出现脂肪肝变异时则是例外,此时HCC病灶中会出现明显的脂肪成分,则代表晚期肿瘤分级的进展性癌症[8]。
3.2.2 结节中结节 结节中结节这一征象代表在DN中出现了进展性的HCC病灶。病灶内的“子结节”通常表现为典型HCC的强化特性,而周围分化更好的“母结节”通常在T1WI中呈等或稍高信号,在T2WI中呈等或低信号,动脉期强化不明显,延迟期可以无廓清,这是非典型HCC的表现(图10)。
3.2.3 马赛克结构 马赛克结构是指HCC病灶中出现随机分布的结节和分隔,结节通常由纤维分隔隔开,且其形状和大小以及信号强度、强化表现均不相同[8,11](图11)。在HCC高风险人群中,大多数具有马赛克结构的病变高度提示为HCC,特别是在大肿块型的HCC中,这一特征更具有特异性[31],有研究发现这一征象的诊断敏感度为31%~63%[32]。尽管异质性是许多肝脏病变的共同特征,但马赛克结构在其他肿瘤中却极为罕见。
3.2.4 出血 (血液产物) 在没有任何操作的情况下,病灶内或病灶周围出血也是HCC诊断的辅助特征,这可能与HCC的膨胀性生长有关[32]。病灶内的急性出血通常在T1WI上表现为不均匀的高信号区域,在T2WI上表现为低信号为主的混杂信号 (图12)。出血的不同时期的MR信号则各有不同。
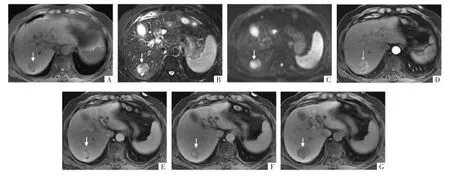
图10 病人男,54岁,HCC。T1WI上(A)示肝右后叶一稍低信号、T2WI上(B)稍高信号结节,结节内可见T1低、T2高信号子结节,DWI结节呈高信号(C),动脉期结节明显强化(D),母结节与子结节强化程度不同,门静脉期结节廓清不明显(E),过渡期(F)及肝胆期(G)子结节廓清,而母结节廓清不显著。

图11 病人女,60岁,HCC。T1WI上(A)示肝左叶一等信号、T2WI上(B)稍高信号肿块影,其内信号不均匀,动脉期不均匀强化(C),门静脉期(D)、延迟期(E)廓清,其内可见分隔(D、E,粗箭)。
4 小结
增强MRI已成为HCC风险人群常用的无创性诊断方法。动脉期明显强化和门静脉/延迟期廓清是HCC的典型表现,可以不需要病理组织学确认即可做出诊断。但当缺乏这一典型动态特征时,诊断HCC困难。此时,LI-RADS中的辅助特征可以进一步提供有用的附加信息,提高诊断的敏感度。这些辅助特征包括非特异性恶性特征(轻至中度T2高信号、DWI扩散受限、病灶中乏脂、病灶中乏铁、直径增加小于阈值增长和晕环状强化)及HCC特异性征象(病灶内含脂、结节中结节、马赛克结构和出血)。根据这些辅助特征还可以对HCC进行较准确的分级,国内外研究[2,33-35]也表明辅助征象指导下的结节分级评价具有较高的可信度和有效度。LI-RADS辅助特征为HCC的影像诊断和病灶分级提供了统一标准,是描述临床影像征象和诊断报告标准化的重要依据。

图12 病人男,62岁,HCC。T1WI上(A)示肝左叶一稍低信号、T2WI上(B)稍高信号结节,结节内可见高T1(粗箭)、混杂T2(粗箭)信号,提示结节内出血;动脉期结节强化(C),而出血区不强化,门静脉期(D)、过渡期(E)及肝胆期(F)病灶廓清。

