一株鸡毒支原体的致病性研究与药敏试验
高奎鹏 孙培明
一株鸡毒支原体的致病性研究与药敏试验
高奎鹏 孙培明*
(临沂大学农林科学学院 山东 临沂 276000)
为了对1株从鸡场分离到鸡毒支原体进行致病性的研究以及敏感药物的筛选。试验对20枚孵化5日龄的SPF鸡胚进行了两种不同浓度毒株的攻毒试验,观察鸡胚的死亡及剖检情况,并将死亡鸡胚卵黄壁上的支原体回收,进行9种常用药物的敏感性试验。结果表明:接种不同浓度均出现死胚,高浓度组鸡胚死亡率高达100%,而低浓度组的鸡胚死亡率为70%,剖检气囊有纤维素渗出,气管、支气管栓塞现象;药敏试验表明:两种毒株已对恩诺沙星和大观霉素等药物敏感性降低,而对泰妙菌素和妙达安两种药物敏感性较高。说明毒株的致病力较强,对子代造成了孵化率降低、弱雏并伴呼吸道病变的影响,但敏感药物对其具有明显的抑制作用。
鸡毒支原体 致病性 鸡胚卵黄囊接种 剖检 药敏试验
鸡毒支原体(MG)感染又称鸡败血支原体感染,由于其病程长,是鸡呼吸道病的一种,又称之为慢性呼吸道病(CRD),在鸡主要表现为慢性呼吸道症状、气囊炎等。其特征是咳嗽、流鼻液,呼吸时有啰音。本病是危害肉仔鸡生产的主要疾病[1]。随着养鸡规模加大、饲养方式改变和饲养密度提高,该病发病率越来越高,主要影响雏鸡生长、使成年鸡产蛋减少,造成养鸡业经济上的重大损失,危害性日益突出[2-3],本文对已分离到的两种毒株进行了致病性的研究及对支原体药物敏感性的试验,证实了毒株浓度对致病性的影响,并为临床防控提供参考依据。
1 材料与方法
1.1 材料
1.1.1 试验毒株 LJ,由山东省济南市某种鸡场病鸡体内,通过Fery培养液分离培养得到,经分子生物学鉴定为鸡毒支原体。
1.1.2 试验鸡胚 SPF鸡胚,由济南济南赛斯家禽科技有限公司提供。SPF鸡胚与全自动孵化箱用0.1%新洁尔灭消毒后,放入20枚胚体大小相等的健康鸡胚,孵化5d备用。
1.1.3 试验药品 取养殖场常用于治疗鸡毒支原体的药物替米考星(批号K0311805,含量89%)、泰妙菌素(批号110803008,含量99%)、妙达安(主要成分80%延胡索酸泰妙菌素,批号163085181,含量45%)、林可霉素(批号9912001,含量85%)、氟苯尼考(批号160252108,含量97%)、强力霉素(批号170407,含量98%)、恩诺沙星(批号100571296,含量99%)、左氧氟沙星(批号220832126,含量98%)和大观霉素(批号010272602,含量779u/mg)9种药物,均购自青岛华盛兽药股份有限公司
1.1.4 仪器 恒温培养箱(型号101-3B,上海景迈仪器设备有限公司);全自动孵化机(型号FHJ001,上海景迈仪器设备有限公司)
1.2 方法
1.2.1 支原体攻毒试验 本次试验为研究支原体的致病性,将试验按菌液浓度不同分为两大组A组和B组(表1)。A组10枚鸡胚,分为2组,每组5枚鸡胚,1组为试验组,卵黄囊接种[4]支原体菌液0.3ml,2组为对照组。B组10枚鸡胚,分为2组,每组5枚鸡胚,I组为试验组,卵黄囊接种用Fery培养液1:1000稀释的菌液,每枚0.3ml,II组为对照组。

表1 鸡胚分组情况
1.2.2 孵化 为防止相互干扰,将A组与B组接种后的鸡胚分别放在两个全自动孵化机内进行孵化,每日照蛋、观察死亡情况。
1.2.3 鸡毒支原体的回收 将孵化过程中死亡的鸡胚取卵黄壁,卵黄,气囊,气管、支气管分泌物浸泡于Fery液体培养液中,用无菌的组织剪剪碎卵黄壁、气囊、气管和支气管,浸泡20min后,用0.45μm的细菌滤器过滤于无菌的西林瓶中,放入恒温培养箱,待培养液变黄后,以鸡毒支原体与Fery液体培养液1:9的剂量传代至稳定备用[5-6]。
1.2.4 药品的处理 参照美国临床和实验室标准协会(CLSI)的标准进行药品浓度稀释,稀释后用0.22微米细菌滤器分别过滤药液备用。替米考星(含量89%)原粉0.2876g溶于200ml水中,-20℃保存备用,内含1280μg/ml。泰妙菌素(含量99%)原粉0.2586g溶于200ml水中,-20℃保存备用,内含1280μg/ml。妙达安(含量45%)原粉0.5689g溶于200ml水中,-20℃保存备用,内含1280μg/ml。林可霉素(含量85%)原粉0.3012g溶于200ml水中,-20℃保存备用,内含1280μg/ml。氟苯尼考(含量97%)原粉0.2639g溶于200ml水中,-20℃保存备用,内含1280μg/ml。强力霉素(含量98%)原粉0.2612g溶于200ml水中,-20℃保存备用,内含1280μg/ml。恩诺沙星(含量99%)原粉0.2585g溶于200ml水中,-20℃保存备用,内含1280μg/ml。左氧氟沙星(含量98%)原粉0.2612g溶于200ml水中,-20℃保存备用,内含1280μg/ml。大观霉素(含量779u/mg)原粉0.3286g溶于200ml水中,-20℃保存备用,内含1280μg/ml。
1.2.5 最低抑菌浓度测定 (1)颜色变化单位(CCU)的测定:取15支试管,每个试管先加入1ml Fery培养液,再向每组第1管内加入0.2ml菌液,按10倍倍比稀释至第14孔,第15孔做空白对照;重复3次,盖上试管塞,防治污染,37℃培养,每日观察结果,记录试管颜色变化,当变色试管不再增加后确定终点。将导致颜色改变的菌液最高稀释度看做为1CCU/ml[7]。(2)最低抑菌浓度(MIC)测定:将试验以药品名称分为9组,每组14支试管,无菌操作每个试管先加入1ml Fery培养液,再取0.4ml配置好的药液加入第一支试管,充分混匀后取出0.4ml至第二管,以此类推,等比稀释至第13管,第13管吸出0.4ml弃去,第14管为对照;再向每组1~13管中各加入回收后生长稳定的鸡毒支原体菌液5000CCU/ml。将试管放入培养箱,每日观察结果,记录试管颜色变化,当变色试管不再增加后确定终点。以抑制鸡毒支原体生长的抗生素的最高稀释度作为最低抑菌浓度[7]。
3 结果与分析
3.1 攻毒试验鸡胚的死亡情况
鸡胚攻毒试验后每天对鸡胚进行照蛋检查,并记录鸡胚的死亡情况见表2。
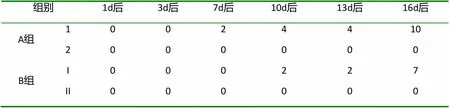
表2 鸡胚死亡总数
由表2可见:LJ组接种原液的鸡胚在接种7d后开始死亡,16d后(第21天),死亡率100%;而接种1:1000倍稀释过的菌液鸡胚10d后开始死亡,16d后(第21天),死亡率70%。
3.2 鸡胚的孵出和生长情况
(1)A组孵化21d后,试验组无鸡胚孵化成功;对照组孵出10只。(2)B组孵化21d后,试验泽孵出3只;对照组10只。
3.3 鸡胚的剖检情况
A组与B组鸡胚的在剖检过程中,未孵出鸡胚出现气管、支气管内有白色栓塞物,孵出弱雏死后剖检发现接种支原体的鸡胚其支气管和气囊均有纤维素渗出,根据H.W.Yoder将气嚢病理损伤判断,A组较为明显,均为3级;B组均为2级;对照组致死剖检均为0级。气嚢病理损伤计分结果参考:H.W.Yoder将气嚢病理损伤分为5级:(1)O级:气嚢正常,薄而透明;(2)1级:气嚢仅有稍增厚的灰色区或黄色渗出斑点;(3)2级:部分气嚢易见到灰至黄色渗出,有时出现泡沫,气嚢增厚;(4)3级;大部分气嚢增厚,布满大量黄白色干酪物;(5)4级:几乎整个气嚢布满黄白色干酪样渗出物,气嚢严重增厚[8-9]。
3.4 颜色变化单位(CCU)的测定结果
试管放入恒温培养箱7d后,变色试管不再增加,终点稀释浓度LJ为10-7,颜色变化单位为107CCU/ml。
3.5 最低抑菌浓度测定结果
试管放入恒温培养箱10d后,以抑制鸡毒支原体生长的抗生素的最高稀释度作为最低抑菌浓度,结果见表3。

表3 各种药物对毒株的颜色变化单位 (CCU/ml)
由于Fery培养液配制时因为加入了酚红而表现粉红色,若有支原体生长,则支原体利用培养液中的营养而产生一些酸性产物,液体的颜色则会由粉红色变成黄色,以此来判断培养液中是否有支原体生长。由表3可见:对于鸡毒支原体LJ来说,泰妙菌素与妙达安两种药物的MIC为最大,敏感性较高,而对恩诺沙星,大观霉素等药物敏感性降低。
4 讨论
(1)支原体疾病严重影响着鸡胚的孵化率,降低雏鸡的生长速度,使成年鸡产蛋率下降等不良影响,鸡支原体病发病慢,病程长,可与其他病原混合感染或继发感染,如大肠杆菌、新城疫、传染性支气管炎、传染性鼻炎等混合感染,很难根除,给养殖户带来很大经济损失[10]。(2)本试验采用养殖场分离到的支原体毒株LJ,经过SPF鸡胚的卵黄囊接种试验,根据鸡胚接种支原体的菌液浓度的不同,发现两组均出现死胚,高浓度组鸡胚死亡率高达100%,而低浓度组的鸡胚死亡率为70%,剖检发现气囊有纤维素渗出,气管、支气管栓塞现象,以接种鸡胚分别与对照组的鸡胚死亡情况和剖检情况可以做出分析,LJ致病力较强,对鸡胚的孵化率有很大影响,卵黄囊内的支原体可直接造成雏鸡的呼吸系统病变,尤其是在出壳前的1~2d,而且浓度越高,鸡胚死亡速率越高,病变越明显。(3)长期以来,防制鸡毒支原体感染时,人们常常使用不同的抗生素,其中应用最为广泛的药物是泰乐菌素、红霉素、喹诺酮类和氨基糖苷类等抗菌素,但由于疫苗的使用、抗生素的滥用等情况,防治效果已不确定。本试验结果显示,该株支原体对替米考星,林可霉素,恩诺沙星,左氧氟沙星,大观霉素敏感度已降低,对泰妙菌素,妙达安表现敏感较高,可做临床用药的借鉴依据。尽管体外药敏试验结果显示对部分药物敏感,但临床使用时不仅需要疫苗防疫和药物治疗,更需要包括加强饲养管理和生物安全等综合措施。
[1] 徐建义. 禽病防治(第2版)[M]. 北京: 中国农业出版社, 2014, 87-89.
[2] 雷元元,何生虎,王静等.鸡毒支原体病研究进展[J].农业科学研究,2014,35(3):39-42.
[3] 王育伟,岳华,张晓晖等.鸡毒支原体研究概况[J].动物医学进展,2016,37(7):106-110.
[4] 李舫. 动物微生物与免疫技术[M]. 北京: 中国农业出版社, 2014.
[5] 刘军军, 丁亮, 魏建忠等. F株鸡毒支原体疫苗对肉鸡生产性能的影响[J]. 中国生物制品学杂志, 2014, 27(1): 13-18.
[6] 丁亮. 鸡毒支原体F弱毒疫苗对肉鸡生长及免疫性能影响的研究[D]. 安徽农业大学: 合肥, 2011.
[7] 吴清民, 杨秀玉, 沈志强等. 鸡毒支原体的分离鉴定和最低抑菌浓度测定[J]. 中国预防兽医学报, 2003(4): 71-74.
[8] 甄永臣, 李慧琴, 马战涛等. 目前鸡慢性呼吸道病发生的特点及防治对策[J]. 河南畜牧兽医, 2004(9): 28-29.
[9] 沈瑞忠, 曲立新, 于康震等. 禽肺病毒的分离鉴定[J].中国预防兽医学报, 1999(1): 79-80.
[10] 隋兆峰, 张侃吉, 徐建义等. 山东地区鸡毒支原体分离鉴定及耐药性监测[J]. 中国家禽, 2016, 38(14): 51-54.
(2019–06–05)
山东省现代农业产业技术体系家禽创新团队项目(SDAIT-11-17)
S852.62
A
1007-1733(2019)09-0004-03

