钕掺杂氧化锰电极制备及电催化氧化脱氮
张 行,刘守清
(苏州科技大学 化学生物与材料工程学院,江苏 苏州215009;江苏省环境功能材料重点实验室,江苏 苏州215009)
随着经济的发展,水体中氨氮污染日益严重[1-2],因此,需要研究开发脱氮新技术。目前常用的脱氮方法有:微生物法[3]、折点氯化法[4]、离子交换法[5]、光催化氧化法[6]等。其中,利用电化学高级氧化法去除氨氮因其无需添加氧化剂、反应温和可控、无二次污染、能耗低、效率高等优点成为人们研究开发的热点[7]。自从Beer在1964 年成功研制Ti/RuO2电极以来,以金属钛为基体的金属氧化物阳极引起人们的注意。Kim 等[8-9]利用高温热解法制备了Ti/IrO2电极,研究了不同pH 值条件下氨氮在电极上的氧化机理。魏杰等[10]制备了Ti/SnO2-Sb2O3/Fe-PbO2电极通过氯离子间接氧化除去氨氮。Yao 等[11]利用铅高过电位的特点,通过电沉积法制备了Ti/PbO2电极,在较高过电位条件下研究了pH 值与脱氮产物之间的关系,有效地避免氧气析出,从而节省了能耗。进一步地,Wang 等[12]通过热解-电沉积联用法制备了Ti/SnO2+Sb/PbO2电催化电极,具有较好的脱氮效果。
锰作为过渡金属元素具有特殊的d 电子结构 (3d54s2),其可变的价态为电催化氧化氨氮提供了科学依据。Meng 等[13]制备了不同结构的锰氧化物,并通过循环伏安试验发现它们的催化活性顺序为:ɑ-MnO2>AMO(非晶态氧化锰)>β-MnO2>δ-MnO2。Abdallah 等[14]通过阳极电沉积法在 Pt 上沉积一层 δ-MnO2薄膜,并将该电极应用于电氧化甲基蓝染料。芦兆青[15]通过热解法和电沉积法制备了有Sb+SnO2中间层的钛基氧化锰电极Ti/Sb+SnO2/MnO2,并应用于电催化氧化苯酚。以上说明锰的氧化物具有较高的电催化活性,这也为氧化锰电催化氧化氨氮提供了可能。
在利用氧化锰作为电催化剂除去污染物的同时,人们发现氧气在氧化锰电极上的析出过电位比较小,即使低槽压下也容易析出氧气,从而增加了能耗。尽管利用铅掺杂也可以提高氧气的析出过电位,但是重金属铅毒性较大。因此,寻找过电位高、毒性小的掺杂元素具有十分重要的应用价值。
文章通过高温热解法,制备了稀土元素钕掺杂的氧化锰电极,研究了掺杂量、pH 值、槽电压对脱氮效率的影响,考察了电极的稳定性以及电催化反应机理。
1 实验部分
1.1 电极制备
1.1.1 电极预处理
(1)尺寸剪裁:将钛网(纯度>99.9%,菱形孔 2 mm×4 mm)剪裁成长宽厚为 30 mm×30 mm×1 mm 规格的“凸”型钛网如图1 所示,留出部分用于与导电线连接。
(2)表面处理:用200 目砂纸打磨电极表面,去除氧化物和污垢,再用400 目砂纸打磨,使钛网表面光滑、平整。
(3)热碱除油:将打磨后的钛网置于去离子水中超声1~2 min,然后转移至质量分数为40%的NaOH 溶液中,微沸处理2 h,去油;然后用去离子水洗净。
(4)草酸刻蚀:将(3)中的钛网置于质量分数为15%的草酸溶液中,微沸处理2 h;然后用去离子水洗净,在去离子水中超声1~2 min。

图1 预处理后的钛网电极
(5)吹干保存:用氮气吹干处理过的钛网,保存在无水乙醇中,防止钛网被氧化。
1.1.2 浸渍-热解法制备电极
(1)配制浸渍液:称取 wt 为 50%的 Mn(NO3)2溶液 8.945 7 g(0.025 mol Mn(NO3)2),按摩尔比 Mn∶Nd=100∶7 称取 0.767 1 g(0.001 75 mol)的 Nd(NO3)2·6H2O,加入无水乙醇做溶剂均匀搅拌 30 min,50 mL 容量瓶定容。待用。
(2)浸渍-预烘:将预处理的钛网,浸渍于步骤(1)中的浸渍液中1 min,取出室温晾干10 min,转移至鼓风干燥箱中在105 ℃下干燥2 h,至表面无明显液体。重复该操作2 次。
(3)高温晶化:将上述电极置于陶瓷坩埚中,在马弗炉中设定晶化温度为450 ℃,晶化时间为2 h,升温速度为5 ℃·min-1。待电极冷却至室温后即制得稀土元素Nd 掺杂的氧化锰电极,记为Nd-doped MnOx/Ti。按相同方法制备的未掺杂氧化锰电极为MnOx/Ti。
1.2 电催化脱氮实验
脱氮装置由稳压电源提供直流电,在恒温磁力搅拌器上控制体系温度在25 ℃左右,控制合适的搅拌速度,将所制备的电极为阳极,用导电铜线与电源正极相连,电源负极则与经预处理的等面积钛网相连,保持电极间距为20 mm,使电极有效部分完全浸没在溶液中。以不含有氯的 (NH4)2SO4为模拟氨氮废水,配制100 mg·L-1的(NH4)2SO4溶液;加入 0.1 mol·L-1的 Na2SO4增加溶液导电性,用 Na2CO3-NaHCO3(0.1 mol·L-1)缓冲液控制体系pH 值。
1.3 分析方法
氨态氮(NH4+-N)采取纳氏分光光度法测定392 nm 处的吸光度,以确定其含量[16]

氨氮去除率计算
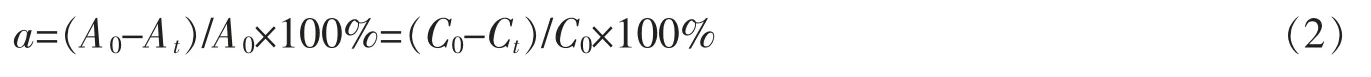
(A0和C0为初始氨氮吸光度和浓度,At和Ct为t 时刻氨氮吸光度和浓度)
对于硝态氮(NO3--N),测定NO3-在220 nm 处的吸光度进行定量[17]。
对于亚硝态氮(NO2--N),根据Griess 试剂分光光度法[18],在酸性环境下,亚硝酸盐与对氨基苯磺酰胺反应生成重氮盐,再与N-(1-萘基)-乙二胺反应生成稳定的红色物质,该物质在540 nm 处产生最大吸光度,以此定量检测硝态氮含量。
1.4 仪器与设备
X 射线衍射仪(型号为 X'Pert-Pro MPD X,Panalytical,Amsterdam,the Netherlands)用于表征材料的晶相结构。X 射线源是Cu-Kα 辐射波长为0.154 nm,管电压为40 kV,管电流40 mA。利用FEI TECNAI G20 200 kV 高分辨透射电子显微镜对电极材料的晶体结构进行测试,并通过EDX 能谱对电极材料中的元素进行分析。采用法国HORIBA Jobin Yvon 公司生产的拉曼光谱仪(型号为HR-800,激光波长为514 nm),对电极材料进行拉曼光谱表征。采用美国热电公司生产的光电子能谱仪(型号为ESCALAB 250 XI)表征电极材料中各元素的存在。
全封闭自动在线微量气体分析系统(Labsolar 6A,北京泊菲莱科技有限公司)用于测定电催化过程中所生成的氮气。实验前抽真空,然后充入氩气至1.0 atm。以气相色谱仪(GC-7806,北京仕为谱欣分析仪器有限公司)实时在线分析电催化过程中所生成的氮气。
2 结果与讨论
2.1 XRD表征
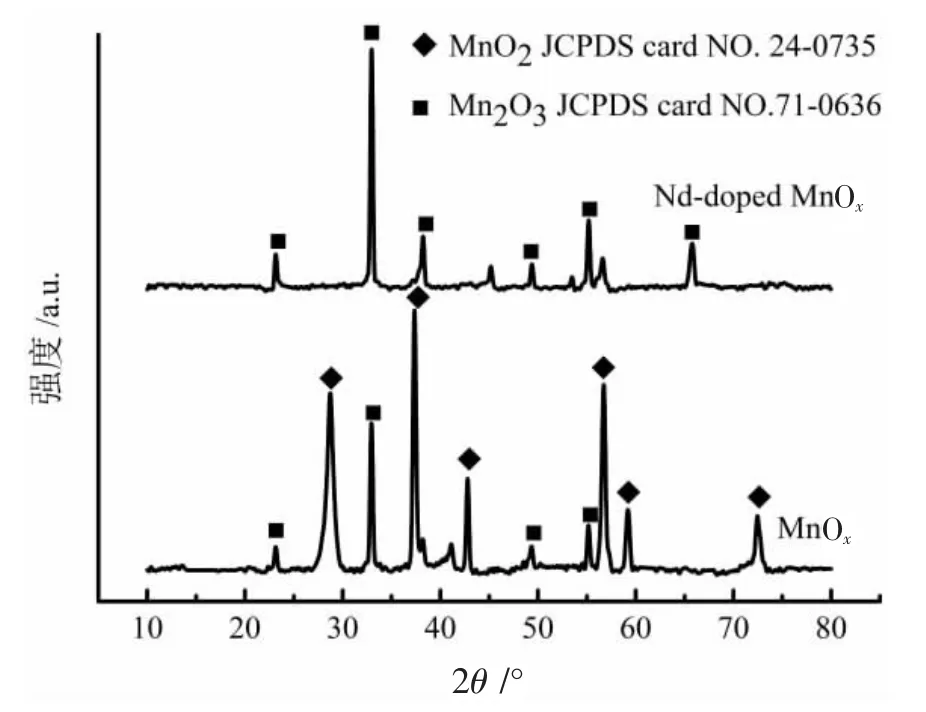
图2 MnOx 与Nd-doped MnOx 电极材料的X 射线粉末衍射图
图2 是 Nd-doped MnOx与 MnOx的 X 射线粉末衍射图。
由图2 可知:MnOx在 28.6°、37.3°、42.8°、56.5°、59.3°和 72.3°处,分别对应 β-MnO2(标准衍射图谱JCPDS card NO.24-0735[19]) (110)、(101)、 (111)、(211)、(220) 和 (112) 的晶面衍射;23.1°、32.9°和55.2°处的衍射峰分别对应Mn2O3(JCPDS card NO.71-0636[20]) (211)、(222)和(440) 的晶面衍射。这说明经过热解处理的电极材料中含有β-MnO2和Mn2O3两种晶型的氧化锰。经过Nd 掺杂后,原本在MnOx中存在的β-MnO2晶型的特征衍射峰消失,主要是Mn2O3的衍射峰,说明经过Nd 掺杂后,MnOx在热处理结晶时,β-MnO2受到了抑制,而有利于Mn2O3的生成。
根据Chung 等[21]的研究,利用强度参比法通过Jade 软件计算得:MnOx电极材料中β-MnO2和Mn2O3的质量比约为 87∶13,可得 Mn3+/Mn4+=0.16。Nd-doped MnOx电极材料中 β-MnO2和 Mn2O3的质量比约为 24∶76,可得Mn3+/Mn4+=3.48。说明Nd 掺杂后电极材料中Mn2O3是电极主体材料。此外,掺杂后XRD 峰型尖锐,说明其结晶较好,结晶度较高。按照Debye-Scherrer 公式

其中:D 为晶粒的直径;k 为晶粒的形状因子等于0.89;λ 为 X 射线的波长 0.154 nm;W 是衍射峰的半峰宽;θ为布拉格角。计算可得β-MnO2电极材料平均晶粒尺寸为34.4 nm;Nd 掺杂后Mn2O3电极材料的平均晶粒尺寸为48.6 nm,说明掺杂后晶粒尺寸增大了。
2.2 TEM表征
图3 是 Nd-d oped MnOx的 TEM 图和 EDX 表征图。
由图3A 可见,电极材料呈片状,晶粒大小为40 nm左右,与XRD 计算的结果一致。图3B 为电极材料的高分辨图,可以测得晶面间距 d=0.38 nm,此为 Mn2O3(211) 晶面的晶面间距; 而面间距 d=0.24 nm 则为 β-MnO2(101)晶面的晶面间距。这说明电极材料中含有β-MnO2和Mn2O3两种晶型,这与XRD 分析结果一致。图3C 为EDX 能谱测试,结果显示材料中含有Mn、O 和Nd 三种元素,说明Nd 成功掺杂。

图3 Nd doped MnOx 电极材料的 TEM 和 EDX 图
2.3 Raman表征
图4 是Nd-doped MnOx和MnOx电极材料的拉曼光谱图。
由图4 可知: 在650 cm-1处出现了Mn-O 的特征拉曼峰[22]。而 Nd 掺杂后,Mn-O 拉曼峰的强度减弱,发生宽化效应,且特征峰位置蓝移到646 cm-1,说明Nd 掺杂改变了Mn-O 键的键能。

图4 Nd-doped MnOx 和MnOx 电极材料的拉曼光谱图
2.4 XPS表征
图5 是Nd-doped MnOx电极材料的光电子能谱图。
由图5 可知,图5A 为 Nd-doped MnOx电极材料的XPS 电子能谱图,对比标准图谱可知材料中含有Mn、O和Nd 三种元素,这与EDX 能谱结果一致。图5B 和图5C中通过比较未掺杂的MnOx电极材料与掺杂了Nd 的MnOx电极材料中Mn2p 和O1s 的XPS 图谱,发现掺杂后峰位置向低能量区位移,发生红移。说明经过掺杂改性后电极材料中Mn 和O 的化学环境发生了改变,结合TEM 和Raman 的结果可以确定Nd 成功掺杂进入MnOx材料的晶格中。
分析 Mn2p 的高分辨 XPS 图(图5B),电子亲合能在 641.6、653.4 eV 处分别对应 Mn2p1/2 和 Mn2p3/2 的电子亲合能。根据 Wu 等[23]的研究锰可能存在 Mn3+和 Mn4+两种价态。而 Xiong 等[24]认为 Mn3+和 Mn4+的结合能分别为 641.4、642.4 eV,分峰结果表明,MnOx材料中 Mn3+∶Mn4+=1.43∶1,Nd-doped MnOx材料中 Mn3+∶Mn4+=1.88∶1。这说明经过Nd 掺杂后电极材料中Mn3+的含量增加了,即材料中Mn2O3的含量增加与XRD 表征计算的结果一致,这进一步证明了掺杂后Mn2O3是电极材料的主要晶型。
Nd3d 的电子亲合能为983 eV(图5D)对应Nd3d5/2 电子亲合能,参考Yuvakkumar 等[25]的研究结果,在晶格中 Nd3+取代原Mn4+的位置,但Nd3+的价态是+3,从而原MnO2转变为Mn2O3,增加了Mn2O3的相对含量。
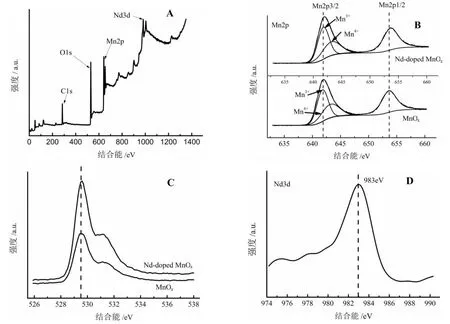
图5 Nd-doped MnOx 电极材料的光电子能谱图
2.5 Nd掺杂量对电极脱氮性能的影响
按前述方法制得如下Mn/Nd 摩尔比掺杂电极:Mn∶Nd=100∶1、Mn∶Nd=100∶3、Mn∶Nd=100∶5、Mn∶Nd=100∶7、Mn∶Nd=100∶9,并进行脱氮实验。室温下控制槽电压U=2.0 V,pH=9.1,其实验结果如图6 所示。
随着Nd 掺杂比例的提高,电极脱氮效率不断提高,当Mn∶Nd=100∶7 时,电极脱氨率最高,10 h 脱氮率达 77.3%。此后提高Nd 掺杂比例,脱氮率反而下降,说明最佳掺杂比例为:Mn∶Nd=100∶7。
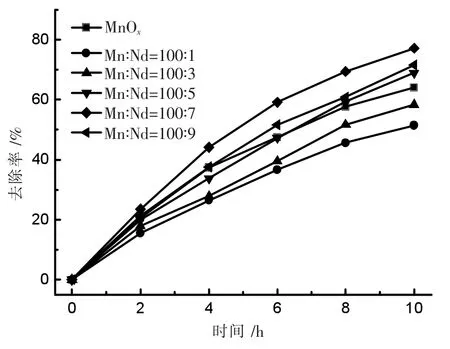
图6 Nd 掺杂比例对电极脱氮性能的影响
2.6 槽电压对电极脱氮性能的影响
以 Mn∶Nd=100∶7 制得的掺杂电极,分别考察槽电压为1.0、1.5 、2.0、2.5、3.0、3.5 V 时脱氮效率,结果如图7 所示,其中,图7A 为 Nd-doped MnOx/Ti 电极,图7B 为 MnOx/Ti 电极。
由图7A 可知,随着槽电压提高Nd-doped MnOx/Ti 电极脱氮率逐渐增大,当槽电压为2.5 V 时,电极脱氮效率达到82.1%,继续提高槽电压,其脱氮效率反而下降,可能的原因是发生了水的电解副反应。从图7B可以看出MnOx/Ti 电极最佳槽电压为2.0 V。从掺杂前后电极槽电压的变化可知,钕掺杂增加了氧气的析出过电位,从而有利于氨氮的降解,提高电流效率。
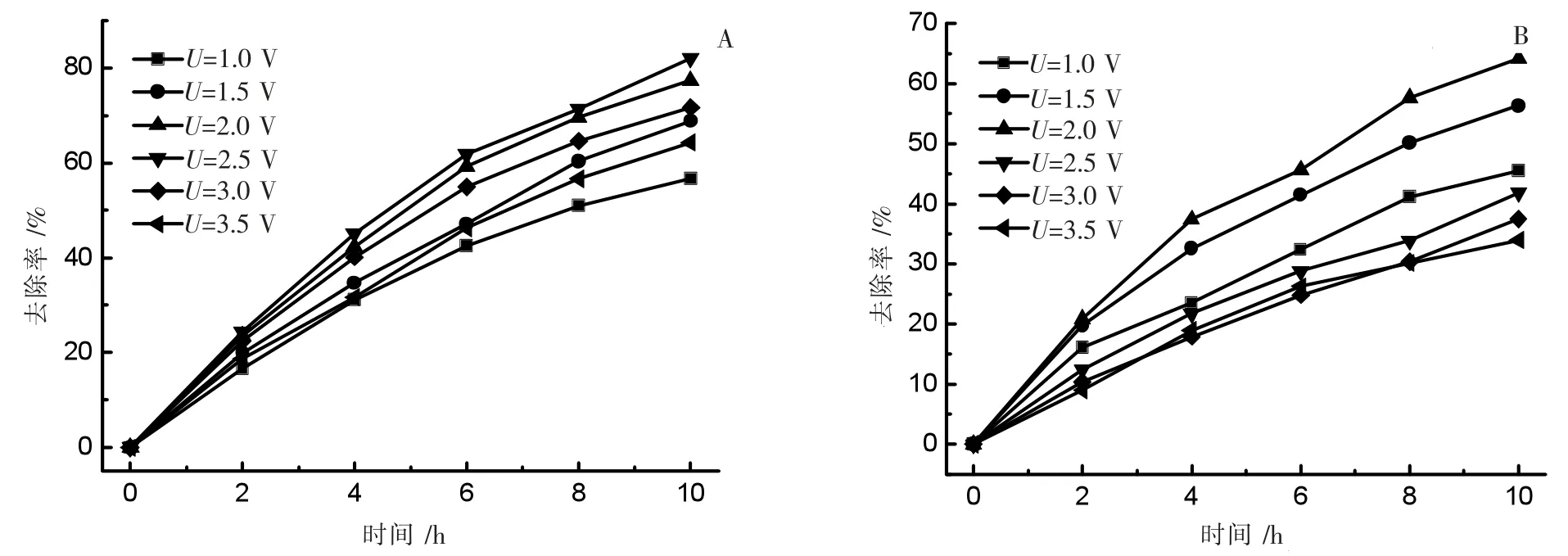
图7 槽电压对脱氮性能的影响
2.7 pH值对电极脱氮性能的影响
将溶液 pH 值调整为 7.0、9.1、9.5、10.1、10.5、10.8,控制槽电压为 2.5 V,其结果如图8 所示,其中图8A为 Nd-doped MnOx电极,图8B 为 MnOx电极。
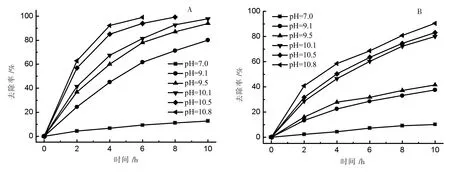
图8 pH 值对脱氮性能的影响
由图8 可知,当体系在中性条件下,氨氮几乎没有被氧化,而随着体系pH 值不断增大,脱氮效率不断增加。原因是NH4+转化为NH3,NH3更容易在电极表面被氧化,因此,脱氮率逐渐提高。在pH=10.8 时脱氮效果最好。
2.8 电极脱氮稳定性测试
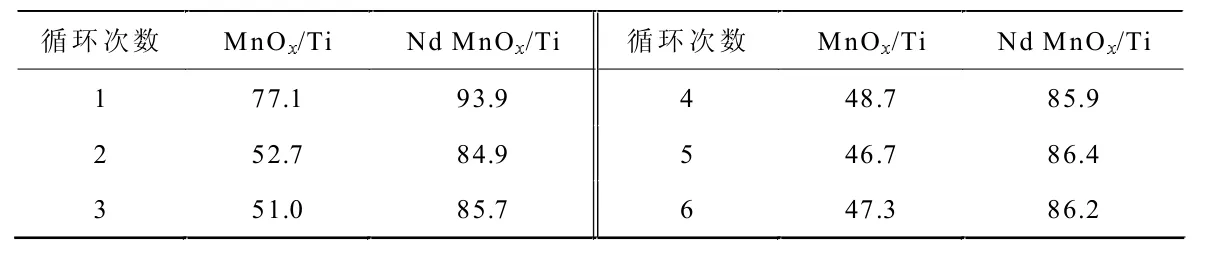
表1 MnOx/Ti 和Nd doped MnOx/Ti 电极脱氮稳定性比较
控制电解池槽电压U=2.5 V,体系pH值为 9.5。初始氨氮浓度为 100 mg·L-1的(NH4)2SO4,以 0.1 mol·L-1的 Na2SO4为支持电解质,电极间距保持2.0 cm,室温搅拌下记录反应10 h 内脱氮率循环实验6 次,实验结果见表1。
由表1 可知: 经过6 次循环脱氮实验,MnOx/Ti 电极的脱氮率迅速下降,由第一次的77.1%下降到第6次的47.3%,而Nd MnOx/Ti 电极的脱氮率第一次为93.9%,第6 次仍然保持为86.2%。Nd 掺杂后电极稳定性明显增强。
2.9 Nd-doped MnOx/Ti电极脱氮产物分析
根据前述分析方法,每隔2 h 分析检测氨态氮、硝态氮和亚硝态氮的浓度,结果如图9 所示。
由图9 可知,电催化反应过程中,氨氮浓度不断下降(曲线1)的同时,伴随着少量的硝态氮(曲线2)和亚硝态氮(曲线 3)的生成,10 h 时硝态氮含量为 1.11 mg·L-1,亚硝态氮含量仅为 0.31 mg·L-1。而电解过程中,氨氮主要转化为N2放出如图10 所示。
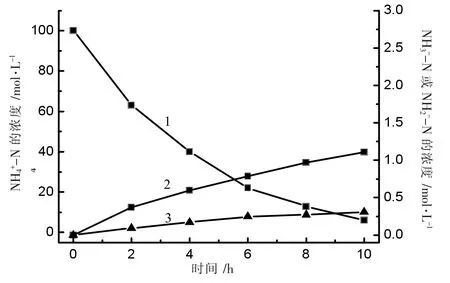
图9 Nd-doped MnOx 电催化过程中反应物与产物变化关系图
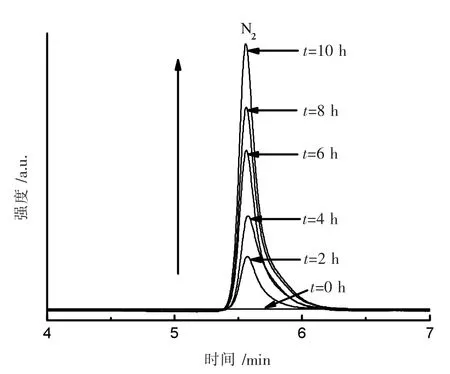
图10 Nd-doped MnOx 电催化产物的气相色谱图
3 结语
通过热解法制备得到了稀土Nd 掺杂的氧化锰电极材料,该材料可以电催化脱氮。结构分析表明,Nd 掺杂后电极材料中的β-MnO2受到抑制,其主要成分是Mn2O3,从而提高了析氧过电位。当槽电压为2.5 V,pH值为9.5 时,经过10 h 反应氨氮去除率可达93.9%。

