下调WRAP53基因表达对人食管鳞状细胞癌EC109细胞增殖和凋亡的影响
杨新彬 洪厚松 刘太省 张金野 饶旭光
广州医科大学附属肿瘤医院胸外科(广州510095)
食管癌是人类常见的一种消化道癌症[1],临床上食管癌患者就诊时以中晚期居多,并且食管癌淋巴结转移率及复发率高,临床进展较快,预后较差。检测早期食管癌发生、发展过程中的标志分子,鉴定可能应用于食管癌基因治疗的靶基因,是现在食管癌研究领域的热点[2-3],WRAP53 是最新发现的P53的自然反义转录本,同时证实了WRAP53 转录本能翻译成WRAP53 蛋白[4]。其在多种不同类型组织癌细胞中过度表达已被证实。食管癌组织中WRAP53的表达及其对食管癌细胞株增殖及凋亡的影响,国内外尚无研究报道,本研究前期在食管癌鳞状细胞癌细胞株及食管鳞癌癌组织中均检测到WRAP53 蛋白的表达[5]。本研究首次证明了下调WRAP53 基因表达抑制人食管鳞状细胞癌细胞株EC109 细胞的增殖和促进EC109 细胞的凋亡,进一步证实自然反义转录本WRAP53 参与食管鳞状细胞癌的发生、发展过程,是食管鳞状细胞癌治疗的潜在靶点。
1 对象与方法
1.1 研究对象人食管鳞癌细胞系EC109、EC9706、KYSE150、KYSE180,取自2008年3月至2011年7月行食管癌根治手术患者85 例,包括食管鳞状细胞癌组织以及切缘相对正常食管黏膜上皮组织。男60 例,女25 例,平均年龄(58.56 ± 8.54)岁,术后病理检查报告均为食管鳞状细胞癌。
1.2 主要试剂WRAP53 PolyClonal Antibody 购自Proteintech,rabbit beta-actin PolyClonal Antibody 购自Sigma,polyclonal secondary antibodies 购自Sigma,RIPA 裂解液购自碧云天生物技术研究所免疫组化染色试剂盒购自北京中杉金桥生物技术有限公司,DAB 显色试剂盒购自上海长岛生物技术有限公司。
1.3 方法
1.3.1 细胞培养人食管鳞状细胞癌细胞系EC109、EC9706、KYSE150、和KYSE180 贴壁培养于装有1640 培养基(含10%胎牛血清)的细胞培养瓶中,将细胞培养瓶放入37 ℃温度且含5%CO2水饱和的培养箱中。细胞贴壁长成单层后,加入0.25%胰蛋白酶消化细胞,传代培养。细胞达到一定数目约(2 ~4)× 107后,收取细胞,立即用于提取细胞总蛋白。
1.3.2 细胞总蛋白的提取使用碧云天生物技术研究所生产的RIPA 裂解液(1)人食管鳞状细胞癌细胞经传代培养后,用4 ℃预冷的PBS(pH 7.4)洗涤细胞2 次。(2)去净培养瓶中PBS 残液后,每个培养瓶加400 μL的RIPA 裂解液(含100 mmol/L PMSF),将培养瓶置于冰上裂解20 min,每5 min 摇动培养瓶1 次。(3)裂解完毕后收集细胞,将培养瓶中混合物转移至1.5 mL 离心管中。(4)将离心管继续置于冰上,裂解20 min。然后在4 ℃,12 000 ×g条件下离心5 min。(5)BCA 法测定总蛋白含量。
1.3.3 蛋白电泳收集细胞,提取总蛋白,Western Blot电泳,具体方法如下:细胞经PBS清洗两次,加入RIPA 裂解液后,冰上裂解20 min,在12 000 r/min,4 ℃条件下离心20 min,收集上清。调整各细胞蛋白总量相等,加入5×SDS蛋白上样缓冲液,在100 ℃条件下加热5 min,同时配制10%的分离胶和5%的浓缩胶。各孔加入等量的上样蛋白,恒压60 V,至样品进入分离胶,约30 min;恒压120 V,溴酚蓝至分离胶底部停止电泳约90 min。PVDF 膜先在甲醇中浸泡2 min,在转缓冲液中平衡5 min;进一步在半干转缓冲液中平衡15 min,在半干电转移仪中依次放入海绵垫、滤纸、PVDF 膜、凝胶、滤纸和海绵垫并压紧,恒压100 V 条件下转移120 min后,取出PVDF膜,置入含5%脱脂奶粉的TBS溶液,在室温下封闭30 min。加入用TBST 稀释的一抗(WRAP53,1∶500;beta-actin 1∶1 000),作用30 min后,PVDF 膜经4 ℃孵育过夜,分别用TBST 洗涤3 次,每次10 min,过氧化物酶标记的二抗室温作用2 h,再次用TBST 洗涤3 次,每次10 min。使用SantaCruz 公司化学发光试剂盒,按操作说明进行发光实验,在发光前1 min 混合A、B 液,使混合液与PVDF 膜蛋白面接触1 min 后,将膜置于暗盒中,加化学发光底物反应1 min,在暗室内加上底片,洗片显示目的条带。
1.3.4 免疫组织化学法(1)组织取材后固定、包埋蜡块,进一步切片和贴片、脱蜡水化。(2)置入3%的过氧化氢水溶液中浸泡10 min,去除内源性过氧化物酶,反复用蒸馏水冲洗3 次,使用高压抗原修复。(3)反复用PBS 冲洗3 次,甩干玻片上的液体,然后吸水纸吸干组织块边缘的液体,用10%正常山羊血清室温下封闭15 min。(4)滴加一抗后,于4°C 冰箱湿盒中孵育过夜。PBS 冲洗3 次,每次5 min,甩干玻片上的液体。(5)滴加二抗(生物素标记的山羊抗鼠抗兔抗体),室温孵育10 min,PBS液冲洗3 次,每次3 min。滴加辣根过氧化物酶(HRP)标记的链霉卵白素,室温条件下孵育10 min。(6)PBS 冲洗3 次,每次5 min,甩干玻片上的液体,滴加DAB 溶液2 min 后在显微镜下观察显色情况,用自来水终止显色,进一步苏木素染液染色5 ~10 min,自来水冲洗2 min;1%盐酸酒精分化约3 s,自来水冲洗1 ~2 min,淡氨水溶液浸泡45 s,自来水冲洗至细胞核深蓝,蒸馏水冲洗30 s。(7)梯度酒精脱水至切片清晰透明,中性树脂封片晾干,光学显微镜下图像摄影。
评分标准:A,按染色强度划分等级:0,无染色;1,弱染色;2,中度染色;3,强染色。B,按癌巢组织中的阳性细胞数划分等级:0,阴性;1,<10%;2,11% ~50%;3,51% ~80%;4,>81%。最后将A和B 分数相乘得出综合评分进一步分级:0,阴性表达;1 ~3 分,弱阳性表达;4、6 分,阳性表达;8、9、12 分,强阳性表达,本研究以4 分及以上作为WRAP53 阳性表达,4 分以下作为阴性表达。
1.3.5 MTT 法(1)处于对数生长期的EC109 细胞,胰酶消化后用含血清培养基稀释至5 × 104/mL重悬,接种到96孔板,每孔100 μL,培养24 h。(2)消毒PBS 洗3 次,设计4 个处理组,分别为细胞对照组(Normal 组,不进行转染)、空白对照组(Mock组,转染时加入不含siRNA的脂质体)、无义对照组(NC 组,以脂质体转染非特异性siRNA)、特异性siRNA处理组(siWRAP53-E5组),分别加入①含血清培养基;②单纯加转染试剂的含血清培养基;③加非特异性siRNA 和转染试剂的含血清培养基,终浓度为5 nmol/L。(3)加特异性siRNA和转染试剂的含血清培养基,终浓度为5 nmol/L,继续培养24 ~72 h。(4)常规培养24 后检测第1 批样品,吸去培养基,加入90 μL 无血清培养基,每孔加入10 μL MTT(5 mg/mL),轻轻混匀后在避光条件下继续培养4 h。(5)吸去培养基,每孔加入DMSO 100 μL,摇床上震荡10 min,使结晶充分溶解,在酶联免疫检测仪490 nm 处测量各孔的吸光值。(6)同时设置调零孔(DMSO),对照孔(新鲜培养基),每组设置5 个复孔,重复3 次。培养36、48、72 h的细胞用相同方法检测,以时间为横轴,光吸收值为纵轴作细胞生长曲线。
1.3.6 RNA 干扰RNA 干扰实验使用化学合成的小干扰RNA(small interfering RNA,siRNA)针对WRAP53 序列,siRNA 由上海吉玛公司合成,处理食管鳞状细胞癌细胞株EC109 细胞,使用HiPerFect Transfection Reagent,按照转染试剂操作规程,24 ~48 h 后收集细胞,检测转染效果。
1.4 统计学方法实验数据结果使用SPSS 13.0进行分析。在Excel 中计算均值±标准差,所有P值采用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 WRAP53 在食管鳞状细胞癌细胞系中的表达为阐明WRAP53 蛋白与食管鳞状细胞癌细胞之间的关系,本研究首先用Western Blot 检测不同来源的4 种食管鳞状细胞癌细胞株(EC109,EC9706,KYSE150 和KYSE180)中WRAP53 蛋白的表达情况。免疫印迹法检测显示靶蛋白的分子量为75 kDa,β-actin 作为内参照,分子量为43 kDa。在4 种来源不同的食管鳞状细胞癌细胞株中均检测出WRAP53 蛋白的表达,见图1。

图1 WRAP53 在4 种不同的食管鳞状细胞癌细胞株中的表达Fig.1 Expression of WRAP53 protein in four different ESCC cell lines
2.2 WRAP53 蛋白在食管鳞状细胞癌组织和正常食管黏膜上皮组织中的表达差异笔者使用免疫组织化学法检测85 例食管鳞状细胞癌组织和癌周正常黏膜上皮组织中WRAP53 蛋白的表达,结果显示,在食管鳞状细胞癌组织中WRAP53 主要定位于肿瘤细胞核上,显示黄色或者棕黄色染色,见图2。食管鳞状细胞癌组织阳性表达明显高于癌周正常黏膜上皮组织。65 例(76.5%)WRAP53呈阳性或强阳性表达,20 例(23.5%)WRAP53 呈阴性或弱阳性表达,而在癌周正常黏膜上皮组织中,仅22 例(25.9%)的样本呈阳性表达(χ2= 61.574,P<0.001)。

图2 WRAP53 蛋白在食管鳞状细胞癌组织上的表达Fig.2 WRAP53 protein expression in ESCC tissue
2.3 下调WRAP53 基因表达抑制人食管鳞状细胞癌细胞株EC109 细胞的增殖本研究用MTT 法在体外检测WRAP53 下调表达后对细胞分裂增殖的影响。细胞生长曲线(图3)显示,EC109 细胞的WRAP53 基因下调表达后,siWRAP53-E5 组的EC109 细胞增殖速率在转染后36、48、72 h 较3 个对照组明显下降(P<0.05)。但3 个对照组之间无明显差别(P>0.05),siWRAP53-E5 组的EC109 细胞24、36、48、72 h的增殖抑制率分别是(23.33 ±1.33)%,(29.91±2.19)%,(41.49±1.32)%和(36.01±1.72)%。
2.4 下调WRAP53 基因表达促进人食管鳞状细胞癌细胞株EC109 细胞的凋亡笔者运用免疫印迹法检测EC109 细胞WRAP53 表达下调后BAX 蛋白的表达,结果显示siWRAP53-E5 组BAX 蛋白表达升高(图4),以上结果表明WRAP53 表达下调促进食管鳞癌EC109 细胞的凋亡。
3 讨论

图3 MTT 法检测WRAP53 表达下调对食管鳞状细胞癌细胞株EC109 细胞增殖能力的影响Fig.3 Effect of siWRAP53-E5 on proliferation of EC109 Cells
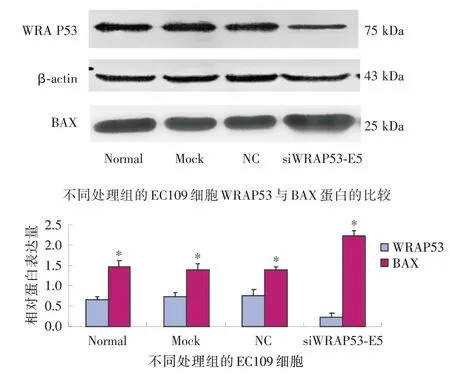
图4 免疫印迹法分析WRAP53 表达下调与凋亡蛋白的关系Fig.4 Effects of WRAP53 knockdown on apoptotic proteins
食管癌的发病机制复杂,针对食管癌正确选择合适的标志物或标志群,是早期诊断食管癌的关键。自然反义RNA 是近年肿瘤研究的新靶点,它与多种恶性肿瘤的发生发展有密切关系。对大多数自然反义转录本的研究,首先是通过研究自然反义转录本对正义转录本的调控,进一步影响正义转录本编码的蛋白而发挥各项功能,最近部分自然反义转录本被证实能直接编码蛋白而在肿瘤的发生、发展中起重要作用[5-10]。
抑癌基因p53 是迄今发现的与人类肿瘤研究相关性最高的基因,WRAP53 是最近被鉴定出来p53的自然反义转录本,WRAP53 基因在染色体17p13 上与p53 基因以“头对头”的方式重叠,对WRAP53的研究[4,11]开始主要集中于对p53的调控作用,p53 基因的反义序列WRAP53 可以调控内源性的p53 mRNA 水平,并且靶向作用于p53 mRNA的5′非翻译区进一步诱导p53 蛋白的表达,近来的研究证实WRAP53 直接参与肿瘤发生发展,有研究[6,12-13]表明WRAP53(也可表示为TCAB1 或WDR79)作为端粒酶蛋白能促使端粒酶聚集于卡哈尔体并且延长端粒的长度,端粒酶能通过增加染色体末端端粒的长度促进原始细胞和肿瘤细胞的增殖,2011年MAHMOUDI 等[7]检测不同癌细胞(U2OS、PC3、MCF-7、SK-N-AS、H1299、HCT116、HEK293、HeLa、Raji、BL41、EW36、ME-180、C33A、SW480、SW756、Saos-2)WRAP53 蛋白的表达比原始细胞高20 倍以上。YUAN 等[14]在肺腺癌组织中检测到WRAP53 蛋白过表达,本研究在不同来源的食管鳞状细胞癌细胞系(EC109、EC9706、KYSE150 和KYSE180)中均检测到WRAP53 蛋白的表达,同时,本研究检测到食管鳞状细胞癌组织中阳性表达明显高于正常食管黏膜上皮,WRAP53蛋白在食管鳞状细胞癌组织中过表达,提示WRAP53 蛋白的表达与食管鳞状细胞癌的发生相关。
自然反义转录本对肿瘤细胞的增殖有促进作用,PENG 等[15]报道AFAP1-AS1 在肺癌组织及细胞株中过表达,下调AFAP1-AS1的表达能抑制肺癌H1299 细胞增殖。FENG 等[16]研究显示,自然反义转录本PHBP1 在食管鳞状细胞癌组织中表达升高,下调PHBP1的表达使食管鳞状细胞癌细胞EC9706 和TE-1 细胞在G1~G0 期细胞周期停滞,进一步抑制细胞的增殖。PAN 等[17]研究发现通过RNA 干扰技术过表达MAPT-AS1 促进雌激素受体阴性乳腺癌MDA-MB-231 和MDA-MB-468 细胞的增殖,下调LncRNA MAPT-AS1 表达能抑制雌激素受体阴性乳腺癌MDA-MB-231 和MDA-MB-468 细胞的增殖,LncRNA MAPT-AS1 与雌激素受体阴性乳腺癌细胞的生长、侵袭相关。YUAN 等[14]研究表明WRAP53 下调能抑制肺腺癌A549 和SPC-A-1细胞的增殖,本研究证实WRAP53 蛋白在食管鳞状上皮基底层细胞、基底层上方细胞、乳头状增生细胞呈阳性表达[5],本研究进一步用特异性siWRAP53-E5 转染食管鳞癌细胞EC109 细胞,MTT实验检测WRAP53 表达下调对EC109 细胞增殖能力的影响,生长曲线显示与对照组相比,EC109 细胞增殖速率明显下降,在国内外首先证实了WRAP53 表达下调能抑制EC109 细胞的增殖,提示自然反义转录本WRAP53 与食管鳞状细胞癌肿瘤细胞增殖的相关性。
自然反义转录本在肿瘤细胞的凋亡中也起到重要作用,ZHANG 等[18]报道AFAP1-AS1 在肝细胞癌组织织过表达,下调AFAP1-AS1的表达能诱导肝细胞癌SMCC7721 和HepG2 细胞凋亡和细胞周期阻滞。MAHMOUDI 等[7]研究证实应用RNA 干扰技术下调WRAP53 表达能通过线粒体通路促进肿瘤细胞的凋亡,激活凋亡促进蛋白Bax/Bak的表达,减少线粒体膜的跨膜电位和细胞色素C的释放,凋亡抑制蛋白Bcl-2的过表达能阻断WRAP53表达下调导致的凋亡,同时还发现,肿瘤细胞比正常细胞对WRAP53 敲除引起的凋亡更敏感,进一步说明肿瘤细胞更依靠WRAP53的表达生存。BAX 是Bcl 基因家族中的一员,主要是通过加速线粒体中的细胞色素C(cyt-c)释放和增加Caspase酶的活性来促进肿瘤细胞凋亡[19]。本研究显示WRAP53 表达下调后促凋亡蛋白BAX 蛋白表达明显升高,抑制WRAP53 表达能促进食管鳞状细胞癌细胞株EC109 细胞的凋亡。
总之,WRAP53 蛋白在食管鳞状细胞癌组织中的表达较正常食管黏膜上皮组织中的表达升高,提示WRAP53 与食管鳞状细胞癌的发生、发展有一定相关性,WRAP53 表达下调能抑制食管鳞状细胞癌细胞株EC109 细胞的增殖,促进EC109细胞的凋亡。随着WRAP53 研究的进一步深入,自然反义转录本WRAP53 在食管癌中的作用机制进一步明确,为食管癌的治疗提供潜在可利用的分子靶点。

