配对相关同源框1蛋白在肝癌中的表达及其过表达对肝癌细胞侵袭转移的影响
卢沛林 尹东亮 尹润龙 林志强
东莞市人民医院普外科(广东东莞523000)
肝细胞癌(hepatocellular carcinoma,HCC)是一种具有高度转移,易复发等特性的恶性肿瘤,其发病率较高,治疗难度较大,占原发性肝癌的90%以上[1]。最新权威数据显示,我国肝癌发病率高居第三位,5年生存率仅为14.1%,远低于日本的60.3%和韩国的68.9%[2]。因此,寻找肝癌预后标志物以及进一步深入研究肝癌恶性进展的分子机制,对肝癌预后判断、治疗策略选择等均具有重要的指导价值。配对相关同源框1(paired related homoeobox 1,PRRX1)是一个新发现的上皮间充质转化诱导因子,参与肿瘤转移的调控。最近有研究显示,PRRX1的异常表达与各种肿瘤的不良预后显着相关,包括结肠癌[3]、乳腺癌[4]等。然而,PRRX1 对不同类型肿瘤的预后相关性截然不同。在结肠癌中PRRX1 高表达与患者预后差显著相关[3],而在乳腺癌[4]中则截然相反。然而,有关PRRX1 在肝癌中表达及其具体的临床意义的研究鲜有报道。本研究首先检测了PRRX1 蛋白在肝癌组织中表达情况,分析了其与肝癌患者临床病理参数的关系,然后在细胞水平研究了PRRX1 过表达对肝癌细胞侵袭转移的影响,旨在为肝癌的治疗和预后判断提供新的理论基础。
1 材料与方法
1.1 材料
1.1.1 组织标本收集2011年5月至2013年1月期间在东莞市人民医院肿瘤科收治并经手术切除的65 例原发性肝细胞癌患者癌组织标本及其对应癌旁组织标本。其中男42 例,女23 例;年龄25~76 岁,平均55.4 岁;临床病理TNM 分期为Ⅰ期18 例,Ⅱ期27 例,Ⅲ期15 例,Ⅳ期5 例。所有入选患者术前均未进行放疗、化疗或其他抗癌治疗,且术后经病理证实肝细胞癌。本研究使用的临床组织样本均获得患者同意及医院伦理委员会批准。
1.1.2 细胞及主要试剂人肝癌细胞株SMMC 7721 购自中国科学院细胞库;PRRX1 过表达质粒(pGMLV-PA1-PRRX1)构建及慢病毒(2.5×108TU/mL)购自吉满生物科技(上海)有限公司;CCK-8 试剂盒购自上海碧云天有限公司;Transwell 小室购自美国Corning 公司;Matrigel 基质胶购自美国BD公司;PRRX1 多克隆抗体购自美国Novus 公司;MMP-2、MMP-9、E-cadherin、Vimentin 和GAPDH 单克隆抗体均购自美国CST 公司;PrimeScriptTM RT Reagent Kit 及SYBR®Green PCR Kit 购自日本Ta-KaRa 公司。
1.2 实验方法
1.2.1 免疫组化检测肝癌组织中PRRX1蛋白表达所有标本进行均进行石蜡包埋、切片、脱水,3%H2O2封闭30 min,0.01 mmol/L 柠檬酸钠缓冲溶液高压修复15 min,山羊血清室温封闭30 min,滴加PRRX1 多克隆抗体4 ℃孵育过夜,洗涤后滴加生物素标记二抗室温静置30 min,DAB 显色3 min、苏木素复染、封片,拍照观察。根据细胞浆及细胞核出现的棕褐色颗粒样染色细胞数目和染色强度判定阳性表达情况。具体参考范丹等[5]评分方法:每个样本在400 倍镜下选择10 个阳性染色区域分别计算100 个肿瘤细胞,取其平均值计算阳性细胞百分率。评分标准如下:<5%,0分;5%~25%,1分;25% ~50%,2 分;>50%,3 分。染色强度判断:浅黄色,1 分;深黄色,2 分;棕褐色,3 分。总计分为二者计分之和,总计分≤2 为阴性或低表达,>2分为阳性或高表达。
1.2.2 细胞培养及感染复苏人肝癌SMMC7721细胞株于培养皿中并置于37 ℃、5% CO2的培养箱中培养、传代。取对数生长期的SMMC7721 细胞,以2 × 105/孔的密度接种于6 孔板中。设置对照组、空载组和过表达组,以复感染指数(MOI)值为50 加入感染培养基和病毒感染SMMC7721 细胞,感染8 h 后更换新鲜培养基继续培养,5 d 后采用qRT-PCR 和Western Blot 实验检测PRRX1 mRNA 和蛋白表达水平,确定感染效率。
1.2.3 CCK-8 法检测细胞活性调整3 组细胞浓度为2×103个/孔,各取100 μL 细胞悬液分别接种于96 孔板中,置于培养箱中培养12、24、48 和72 h。培养时间结束后,每孔加入10 μL CCK-8 溶液,37 ℃避光孵育1 h,使用酶标仪在波长450 nm 处读取OD值,细胞活力以测取得OD值表示。
1.2.4 qRT-PCR 检测细胞中PRRX1 mRNA 表达水平收集各组细胞,采用Trizol 法提取细胞总RNA,使用紫外分光光度计进行定量。根据Prime-ScriptTM RT Reagent Kit 将RNA 逆转录成cDNA,以cDNA 为模板使用SYBR®Green PCR Kit 进行PCR扩增,以GAPDH 为内参,采用2-△△Ct法计算mRNA表达量。引物序列,PRRX1 上游:5′-GCACAGGCGGATGAGAAC-3′,下游:5′-TCTTCTGAGTTCAGCTGGTCAT-3′;GAPDH 上游:5′-AGCCACATCGCTCAGACAC-3′,下游:5-GCCCAATACGACCAAATCC-3′。PCR条件为:95 ℃预变性1 min,94 ℃变性15 s,58 ℃退火20 s,72 ℃延伸45 s,共40 个循环,72 ℃延伸7 min。
1.2.5 Transwell 实验检测细胞侵袭时,需要提前将Matrigel 胶均匀平铺于上室,制成凝胶;检测细胞迁移时,上室不需要平铺Matrigel 胶,其余步骤一致。调整细胞浓度为1×105个/mL,上室接种200 μL 细胞悬液,下室加入500 μL 10%胎牛血清的培养液,置于培养箱中培养48 h。取出下室,洗涤、加入40 g/L 多聚甲醛固定,结晶紫染色,倒置显微镜下观察,选取5 个随机视野,统计视野中细胞数目,取平均值为侵袭或迁移的细胞数量。
1.2.6 Western Blot 实验收集各组细胞沉淀,加入细胞裂解液,冰上充分裂解30 min,4 ℃,12 000 r/min 离心25 min,收集上清,Bradford 法蛋白定量。取25 μg 蛋白进行SDS-聚丙烯酰胺凝胶电泳,并将蛋白转移至PVDF 膜上,5%脱脂牛奶室温封闭1 h,分别加入一抗,4 ℃孵育过夜。次日,洗涤后加入二抗,室温孵育1 h,加入适量ECL 超敏发光液,显影。
1.2.7 随访对纳入研究的肝癌患者进行为期5年的随访,开始时间为患者接受手术切除后即可起,随访最终截止时间为2018年1月13日。随访方式为门诊随访和电话随访相结合,平均每3 个月随访一次,患者死亡时间作为单个病例随访截止时间,中途失访3 例,失访患者按照存活病例纳入生存分析。
1.3 统计学方法采用SPSS 19.0 统计软件进行数据处理,数据采用()表示,多组间比较采用单因素方差分析,组间比较采用t检验。采用χ2检验分析PRRX1 蛋白表达与临床病理特征参数相关性;采用Kaplan-Meier 法进行生存分析,采用Logrank Test 进行生存曲线间比较;运用Cox 回归模型进行多因素生存分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 PRRX1蛋白在肝癌中的表达情况及临床病理特征分析免疫组化结果显示,PRRX1 蛋白在细胞核及胞浆中均有表达(图1)。据统计,PRRX1蛋白在肝癌组织中的阴性表达率为73.85%(48/65),在癌旁组织中的阴性表达率为18.46%(12/65),差异有统计学意义(P<0.001)。临床病理特征分析结果显示,PRRX1 蛋白阴性表达率与患者年龄、性别、肿瘤大小、血清AFP 含量、HBsAg、anti-HCV、肝硬化、肿瘤数目等临床病理特征参数无明显相关性(P>0.05),与血管侵犯、肝内转移、远端转移和TNM 分期等临床病理特征参数有显著相关性(P<0.05,表1)。Cox 回归模型分析显示血管侵犯、远端转移和PRRX1 阴性表达可以作为肝癌患者独立的生存预测因子(P<0.05,表2)。

图1 PRRX1 在肝癌组织和癌旁组织中的表达(×200)Fig.1 PRRX1 expression in hepatocellular carcinoma tissues and adjacent tissue(×200)

表1 PRRX1 蛋白表达与肝细胞癌患者临床病理参数的关系Tab.1 Correlation of PRRX1 expression with the clinicopathological features of patients with hepatocellular carcinoma 例(%)

表2 Cox 回归模型对肝细胞癌患者预后参数的多因素分析Tab.2 Multivariate analysis of prognostic parameters in patients with hepatocellular carcinoma by Cox regression analysis
2.2 PRRX1 蛋白阴性表达与肝癌患者预后的关系Kaplan-Meier 分析显示,PRRX1 蛋白低表达组患者中位生存时间为22.5 个月,PRRX1 蛋白高表达组患者中位生存时间为45 个月。Log-rank Test分析显示,PRRX1 蛋白低表达患者5年生存率显著低于PRRX1 蛋白高表达患者,差异有统计学意义(P<0.01,图2)。提示,PRRX1 低表达与肝癌患者预后差有一定的关联。

图2 PRRX1 蛋白表达与肝癌患者预后的关系Fig.2 Correlation of PRRX1 expression with the prognosis of patients with hepatocellular carcinoma
2.3 过表达PRRX1 对肝癌细胞SMMC7721 活力的影响Western Blot 分析结果显示,与对照组和空载组比较,过表达组PRRX1 蛋白表达显著增加(P<0.05,图3A)。qRT-PCR 结果显示,与对照组和空载组比较,过表达组PRRX1 mRNA 表达显著增加(P<0.05,图3B)。提示,PRRX1 过表达的SMMC7721 细胞株构建成功。采用CCK-8 技术检测感染后细胞活力,结果显示过表达组在感染后48、72 h 时其细胞活力显著低于对照组和空载组(P<0.05,图4)。
2.4 过表达PRRX1 对肝癌细胞SMMC7721 侵袭与迁移能力的影响Transwell 实验结果显示,与对照组和空载组比较,过表达PRRX1 可显著抑制SMMC7721 细胞的侵袭能力(P<0.05,图5);同时,Transwell 实验结果也显示,过表达组细胞迁移能力显著低于对照组和空载组比较(P<0.05,图6)。

图3 PRRX1 蛋白和mRNA 在感染后SMMC7721 细胞中的表达Fig.3 The expression of PRRX1 protein and mRNA in infected SMMC7721 cells

图4 CCK-8 检测感染后SMMC7721 细胞活力Fig.4 The cell viability of SMMC7721 cells after infection were detected by CCK-8 analysis
2.5 过表达PRRX1 对肝癌SMMC7721 细胞中侵袭转移相关蛋白表达的影响Western Blot 检测结果显示,与对照组和空载组比较,过表达PRRX1可显著下调MMP2、MMP9 以及间质表型标志物Vimentin 等蛋白的表达,并且同时可上调上皮表型标志物E-cadherin的表达(P<0.05,图7)。
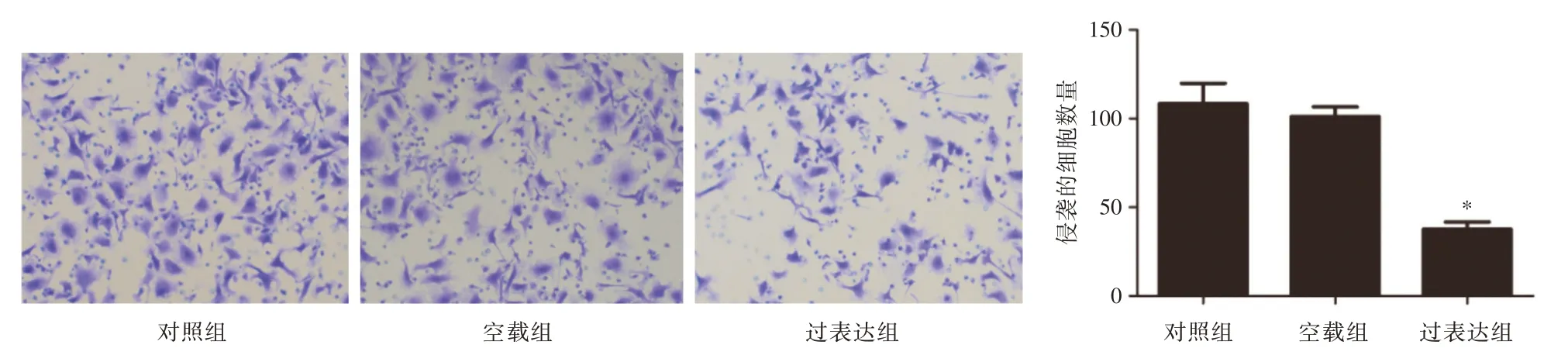
图5 PRRX1 过表达对SMMC7721 细胞侵袭能力的影响(×200)Fig.5 The effect of PRRX1 overexpression on the invasion ability of SMMC7721 cells(×200)
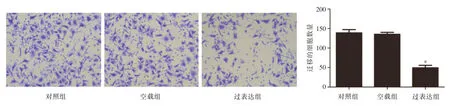
图6 PRRX1 过表达对SMMC7721 细胞迁移能力的影响(×200)Fig.6 The effect of PRRX1 overexpression on the migration ability of SMMC7721 cells(×200)

图7 PRRX1 过表达对MMP-2、MMP-9、E-cadherin 和Vimentin 蛋白表达的影响Fig.7 The effect of PRRX1 overexpression on the protein expression of MMP-2,MMP-9,E-cadherin and Vimentin
3 讨论
PRRX1 基因位于人1q24.2 染色体上,其编码的是一种由245 个氨基酸组成的分子量为27.3 kDa的小分子蛋白物质,该蛋白通过增加血清反应因子的DNA 结合活性起转录共激活的作用,可调节间充质前体细胞的分化[6]。作为转录因子,PRRX1 基因可参与多种生理机制的调控。例如,已证实PRRX1 是一种新的EMT 诱导因子,并且与多种类型肿瘤患者预后相关[3-4]。
GUO 等[7]对125 例胃癌患者癌组织及对应癌旁组织标本进行检测分析,发现PRRX1 在胃癌组织中呈现高表达,并且与肿瘤浸润的深度,EMT 标志物蛋白Vimentin、N-cadherin 和β-catein 表达呈正相关性。TAKAHASHI 等[3]研究显示,PRRX1 高表达与结肠癌患者预后较差相关。本研究结果显示,PRRX1 在肝癌组织中的阳性表达率显著低于癌旁组织,其表达水平与肝癌患者血管侵犯、肝内转移、远端转移和TNM 分期等参数有显著相关性,并且PRRX1 阴性表达肝癌患者5年生存率显著低于PRRX1 阳性表达肝癌患者。说明,PRRX1在肝癌中呈现低表达,并且患者预后差相关。这一研究结果与其他类型肿瘤中相关结果不一致,可能是由于肿瘤干细胞样特性诱导所致。有研究显示,由于干细胞样特性诱导,PRRX1 在不同肿瘤中的表达和功能可能存在差异[8]。另外,ZHU 等[9]研究也显示,在肺癌A549 细胞中抑制PRRX1 表达可增强肿瘤干细胞标志物表达,促进肿瘤干细胞样特性的获得,进而诱导EMT。进一步证实,PRRX1 在肝癌中表达与其他类型肿瘤表达结果不一致,可能是由于在肝癌中PRRX1 低表达获得了肿瘤干细胞样特性所致。
EMT 是上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程,在肿瘤侵袭和转移中发挥重要作用[10]。为了进一步探讨PRRX1 对肝癌侵袭转移的影响,本研究通过慢病毒介导PRRX1 过表达载体感染肝癌SMMC7721 细胞,成功构建PRRX1 过表达的SMMC7721 细胞株。结果显示,PRRX1 过表达可显著抑制SMMC7721 细胞侵袭和转移能力。提示,PRRX1 可能参与肝癌EMT的调控。E-cadherin 被认为是上皮表型标志物,Vimentin 则是间质表型标志物,二者表达变化被认为是EMT 过程的标志[11]。此外,MMP-2 和MMP-9 是基质金属蛋白酶(MMPs)家族中重要成员,参与细胞外基质和基底膜的降解,在恶性肿瘤的侵袭和转移中发挥重要作用[12]。本研究结果显示,PRRX1 过表达可显著抑制Vimentin、MMP-2和MMP-9 等蛋白的表达,促进E-cadherin 蛋白的表达。说明,PRRX1 过表达可抑制肝癌细胞EMT 过程。提示,PRRX1 可抑制肝癌细胞侵袭转移。ZHU 等[9]研究也表明,PRRX1 缺失可通过上调N-cadherin、Vimentin 表达及下调E-cadherin 表达诱导肺癌A549 细胞发生EMT,从另外一面证实PRRX1 也可抑制肺癌A549 细胞EMT 过程。然而又有研究[13]表明,PRRX1 可通过调节EMT 促进胰腺癌侵袭和转移。探究其原因,依旧可能是由于肿瘤干细胞样特性诱导,导致PRRX1 在不同类型肿瘤细胞中表达和功能存在差异。
综上所述,本研究证实PRRX1 在肝癌组织中低表达,其低表达与肝癌患者预后差相关,并进一步通过体外实验探讨了PRRX1 过表达可抑制肝癌SMMC7721 细胞的侵袭、迁移及EMT,阐明PRRX1在肝癌侵袭转移过程中扮演的重要作用。该研究对PRRX1 抑制肝癌侵袭转移的机制阐述还不够透彻,且并未发掘PRRX1 在肝癌发展进程中更多的功能,后续需要进一步深入研究。

