超声波协同复合酶法提取芦荟凝胶多糖工艺优化
张美霞,游玉明,郭瑶
(重庆文理学院林学与生命科学学院,重庆402160)
芦荟是百合科芦荟属肉质草本植物,在全世界范围内,大约有360 多种不同品种的芦荟分布在北美、亚洲、欧洲和非洲的干旱地区,其中库拉索芦荟无论在商业用途还是在治疗学研究中都是应用最广泛的一种[1]。芦荟所含糖类中具有重要生物活性作用的是多糖。经试验测试,新鲜凝胶中含多糖约为0.27%~0.5%。与其他植物多糖相比,芦荟多糖具有广谱的调节免疫、抗辐射、抗艾滋病病毒、抗溃疡、降血脂、降血糖、抗氧化等药理活性。目前尚未有因使用芦荟多糖而出现过敏反应的报道,且其本身的毒副作用小,因而是近年来芦荟研究的重点之一[2-5]。
目前,关于芦荟多糖的提取方法国内外已有较多报道,主要有热水浸提法、微波辅助法、超声波辅助法等[6-12]。但提取材料大多为芦荟全叶干燥后经粉碎制成的芦荟干粉,只针对新鲜芦荟叶凝胶中多糖的提取报道较少。超声波辅助提取法其基本原理主要是利用超声波的空化作用来增大物质分子的运动频率和速度,从而增加溶剂的穿透力,提高被提取成分的溶出速度[13]。该方法具有操作简便快捷、提出率高、速度快、提取物的结构未被破坏、效果好等特点,常用于提取植物内的有效成分。酶具有水解纤维素、原果胶和糖蛋白的作用,酶的高效性能够节约提取能源与时间,酶的专一性使得到的产物稳定,纯度、活性高[14];复合酶提取由于反应温和、操作时间短、成本较低等优势而逐渐被应用到多糖的提取研究中[15]。本试验将超声波和复合酶法进行有效结合,并利用响应曲面法优化其工艺技术参数,旨在探求超声波协同复合酶法提取新鲜芦荟凝胶多糖的最佳的工艺条件,为芦荟凝胶多糖的产业化提供参考。
1 材料与方法
1.1 材料
库拉索芦荟:重庆市永川区花鸟市场。
1.2 主要试剂仪器
纤维素酶(5×105v/g)、果胶酶(4×105v/g)、中性蛋白酶(1×106v/g):南宁庞博生物工程有限公司;葡萄糖、95%乙醇、苯酚、浓硫酸、丙酮、柠檬酸、氢氧化钠:济南东凯化工有限公司,均为分析纯试剂。
754 型紫外可见分光光度计:上海舜宇恒平科学仪器有限公司;RE-52AA 旋转蒸发器:上海雅荣生化仪器设备有限公司;PHILIPS HR2826 榨汁机:厦门智威尔贸易有限公司;TCL-16B 离心机:上海安亭科学仪器厂;SHZ-D(III)循环水真空泵:巩义市予华仪器有限责任公司;SB-5200-DIDN 超声波清洗器:宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 芦荟凝胶多糖的提取工艺
芦荟清洗→去皮取凝胶→打浆→5 000 r/min 离心30 min→冷藏过夜→超声波协同复合酶法提取芦荟凝胶多糖→灭酶→过滤→4 000 r/min 离心15 min→50 ℃浓缩→Sevag 法去蛋白→醇沉→3 000 r/min 离心10 min离心取沉淀→依次用95%乙醇、乙醚、丙酮洗涤沉淀→过滤→用水溶解→定容→测量[16-20]。
1.3.2 样品中芦荟凝胶多糖提取率的测定
参考苯酚-硫酸法测定超声波辅助协同复合酶法所提取的芦荟凝胶多糖的含量[21]。
1.3.2.1 标准曲线的绘制
葡萄糖标准液制备:精确称取105 ℃条件下干燥至恒重的葡萄糖100 mg,置100 mL 容量瓶中,加水溶解至容量瓶刻度。此标准溶液1.00 mL 含葡萄糖1.00 mg。
苯酚液制备:取苯酚100 g,加铝片0.1 g,碳酸氢钠0.05 g,蒸馏收集182 ℃馏分,称取此馏分10.0 g,加水150 g,置棕色瓶中备用。
标准曲线的绘制:吸取葡萄糖标准液0.25、0.5、1.00、2.00、2.50 mL,分别置于 50 mL 容量瓶中,加水定容。吸取上述溶液各2.00 mL,再加苯酚液1.00 mL,摇匀,迅速滴加浓硫酸5.00 mL,摇匀后放置5 min,置沸水浴中加热15 min,取出后冷却至20 ℃~25 ℃,于490 nm 处以水作参照测吸光度值,绘制标准曲线,并求得回归方程如下:y=0.057 3x-0.000 5,R2=0.999 1。
1.3.2.2 样品中芦荟凝胶多糖含量的测定
样品中芦荟凝胶多糖含量的测定:取芦荟凝胶多糖沉淀物于蒸馏水中配成溶液,过滤后摇匀,定容到200 mL,配成芦荟凝胶多糖贮备液,吸取多糖储备液5.00 mL,置于50 mL 容量瓶中,加水定容。吸取上述溶液2.00 mL,再加苯酚溶液1.00 mL,边摇边迅速滴加浓硫酸5.00 mL,放置5 min,置沸水浴加热15 min,迅速冷却至 20 ℃~25 ℃,于 490 nm 处测吸光度,同时做空白试验。将所测得的样品溶液的吸光度代入标准曲线方程,可得到芦荟凝胶多糖的质量浓度,并按方程(1)计算芦荟凝胶多糖的提取率[22-24]。
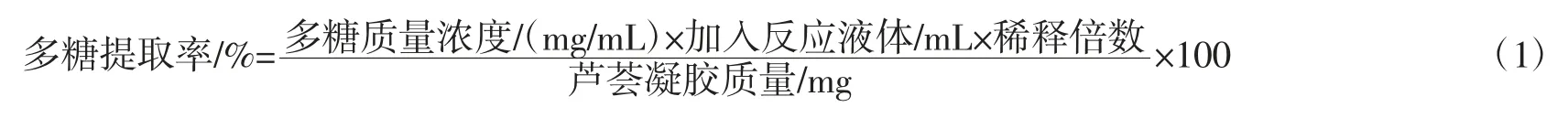
1.3.3 最佳协同方式的确定
在超声功率80 W、温度50 ℃、pH5.0,复合酶用量(果胶酶0.5%、中性蛋白酶2%、纤维素酶1.5%)的条件下研究4 种不同的协同方式对芦荟凝胶多糖得率的影响,灭酶条件为 90 ℃、30 s。
1)芦荟预处理后,先超声波处理20 min,加入复合酶,酶解60 min,灭酶,测多糖得率。
2)芦荟预处理后加入复合酶直接进行超声波处理20 min,灭酶,测多糖得率。
3)芦荟预处理后加入复合酶酶解60 min,灭酶,之后再进行超声波处理20 min,测多糖得率。
4)芦荟预处理后加入复合酶酶解60 min,之后再进行超声波处理20 min,灭酶,测多糖得率。
1.3.4 复合酶最佳配比的确定
1.3.4.1 单因素试验
取20 g 经预处理后的芦荟凝胶原液,超声功率80 W、温度50 ℃、pH5.0,分别添加果胶酶、中性蛋白酶和纤维素酶0.5%、1%、1.5%、2%、2.5%,在其他条件不变的基础上,研究果胶酶添加量、中性蛋白酶添加量和纤维素酶添加量对芦荟凝胶多糖提取率的影响。
1.3.4.2 正交试验优化复合酶配比
在单因素试验基础上,选取果胶酶添加量(A)、纤维素酶添加量(B)、中性蛋白酶添加量(C)这3 个因素,分别选取影响显著的3 个水平,采用L9(33)正交表设计正交试验,以芦荟凝胶多糖提取率为指标,优化复合酶配比,因素水平表见表1。
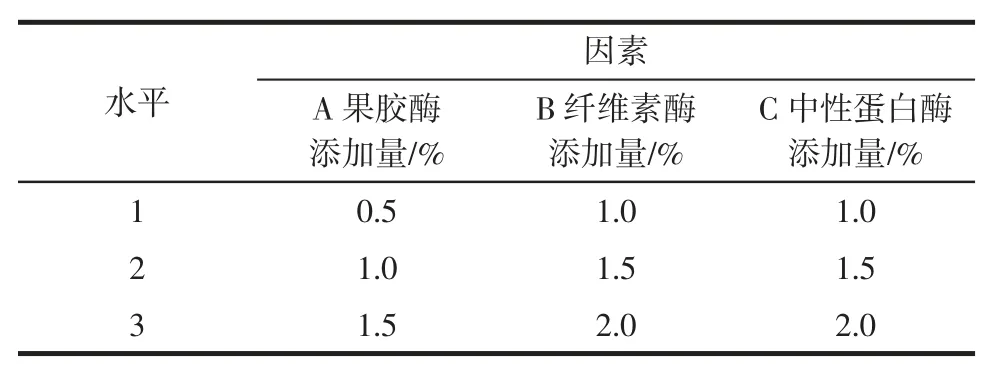
表1 复合酶因素水平表Table 1 Factors and levels of multi-enzyme
1.3.5 超声波协同复合酶法提取条件的确定
1.3.5.1 单因素试验
在其他条件相同的基础上,研究超声温度(45、50、55、60、65 ℃)、提取液 pH 值(4.0、4.5、5.0、5.5、6.0)、液料比[2∶1、3∶1、4∶1、5∶1、6∶1(mL/g)]、超声时间(20、30、40、50、60 min)对芦荟凝胶多糖提取得率的影响。
1.3.5.2 响应面分析优化
在单因素试验的前提下,采用Box-Behnken 设计方案,应用 Design-Expert 软件,选取超声时间(X1)、超声温度(X2)、提取液 pH 值(X3)这 3 个对芦荟凝胶多糖的提取率影响显著的因素为3 个独立变量进行响应曲面研究,并以+1、0、-1 分别代表各独立变量的水平,建立芦荟凝胶多糖提取率的二次多项式数学模型。因素水平见表2。
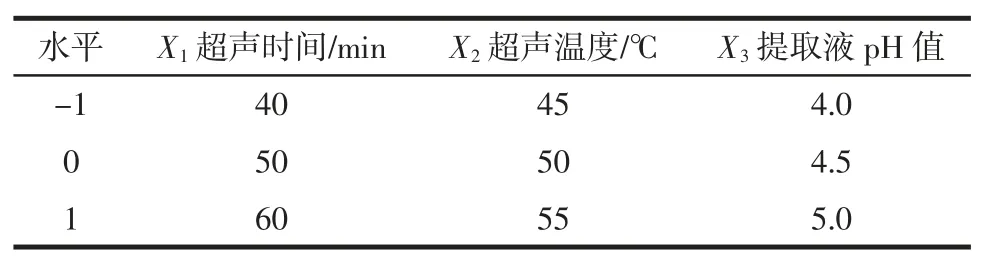
表2 Box-Behnken 因素水平表Table 2 Factors and levels of Box-Behnken design
2 结果与分析
2.1 最佳协同方式的确定
按1.3.3 中4 种协同方式分别试验,计算提取率。结果见表3。

表3 超声波协同复合酶法的不同协同方式对芦荟凝胶多糖得率的影响Table 3 The effects of different synergetic method of ultrasonic and ccomposite enzyme on the yield of aloe gel polysaccharides
表2 说明:(1)、(2)、(4)3 种处理方式所得芦荟凝胶多糖的提取率高于方式(3),说明超声波与复合酶法协同作用能够显著有效地提高芦荟凝胶多糖提取率;(1)、(2)、(4)3 种处理方式之间并无显著差异,即在复合酶协同超声波处理之前或之后额外的增加酶解时间并不能显著有效地提高芦荟凝胶多糖提取率,反而方式(2)效率更高,所以后续试验均采用协同方式(2)来进行。即芦荟预处理后加入复合酶直接进行超声波处理20 min,90 ℃、30 s 灭酶,测多糖提取率。
2.2 复合酶最佳配比的确定
2.2.1 复合酶单因素试验结果
果胶酶添加量、纤维素酶添加量、中性蛋白酶添加量对芦荟凝胶多糖提取率的影响如图1~图3 所示。
图1 表明:随着果胶酶的添加量的增加芦荟凝胶多糖的提取率先呈现上升趋势,在添加量为1.0%时最高,随着添加量的继续增加,提取率下降,所以选择果胶酶的添加量为1.0%。
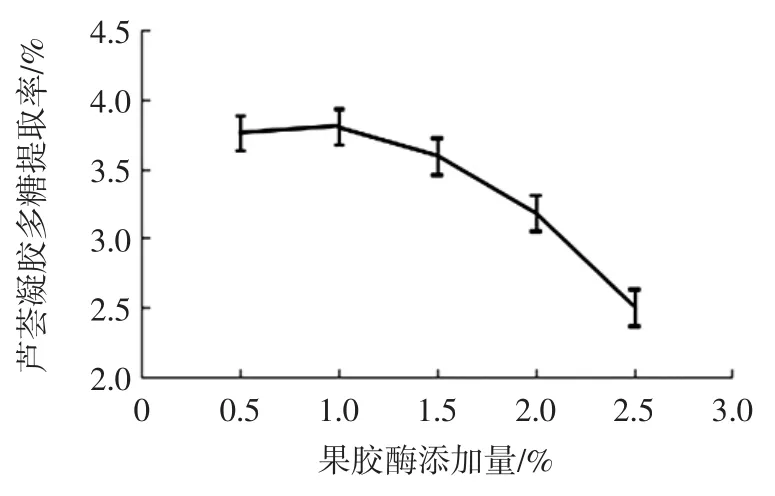
图1 果胶酶添加量对芦荟凝胶多糖提取率的影响Fig.1 Effect of pectinase addition on the extraction rate of aloe gel polysaccharides
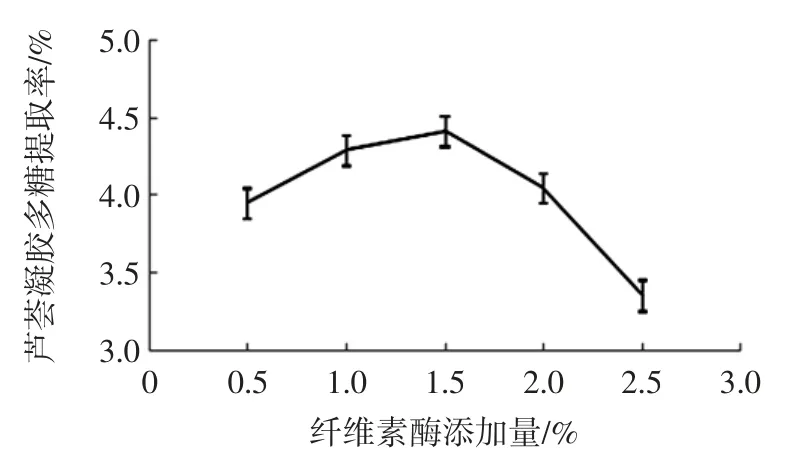
图2 纤维素酶添加量对芦荟凝胶多糖提取率的影响Fig.2 Effect of cellulase addition on the extraction rate of aloe gel polysaccharides
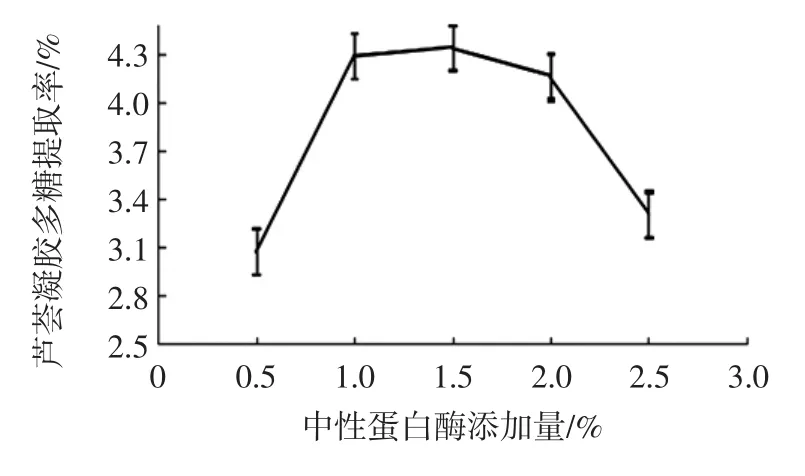
图3 中性蛋白酶添加量对芦荟凝胶多糖提取率的影响Fig.3 Effect of neutral protease addition on the extraction rate of aloe gel polysaccharides
图2 表明:随着纤维素酶添加量的增加,芦荟凝胶多糖提取率呈现先升高后下降的趋势,当用量达到1.5%时提取率可取最大值,所以纤维素酶用量选择为1.5%。
图3 表明:随着中性蛋白酶添加量的增加,芦荟凝胶多糖提取率表现出先升高后下降的趋势,当酶量小于1.5%时,中性蛋白酶在分解细胞结构的同时有利于多糖的浸出,当酶量大于1.5%,多糖提取率反而下降。由图可知,中性蛋白酶取1.0%~1.5%最好。
2.2.2 正交试验优化复合酶配比结果
通过正交试验来进一步确定复合酶的最佳配比,正交试验结果如表4 所示。
正交试验结果说明,这3 个因素影响芦荟凝胶多糖提取率的大小分别为A>B>C,即果胶酶>纤维素酶>中性蛋白酶,最佳配比组合为:A2B2C1,即果胶酶1.0%,纤维素酶酶1.5%,中性蛋白酶1.0%,经验证试验得芦荟凝胶多糖提取率为8.243%。
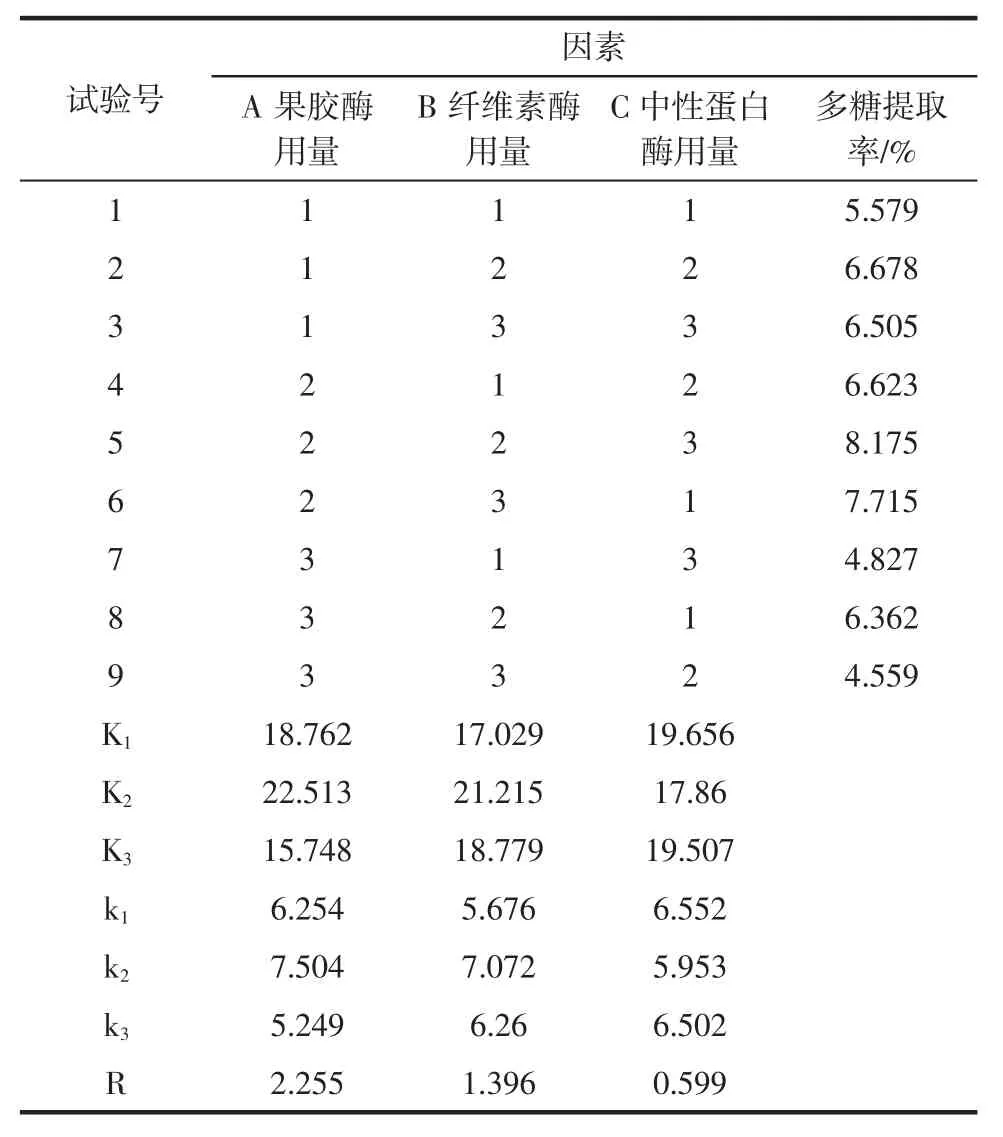
表4 复合酶配比正交试验结果Table 4 Results of orthogonal test for the multi-enzyme
2.3 超声波协同复合酶法最佳提取条件的确定
2.3.1 超声波协同复合酶法单因素试验结果
提取温度、提取液pH 值、液料比、提取时间对芦荟凝胶多糖提取率的影响,结果见图4~图7。
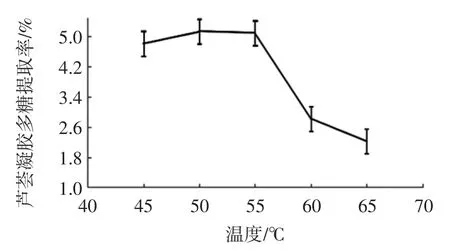
图4 提取温度对芦荟凝胶多糖提取率的影响Fig.4 The Effect of extraction temperature on the extraction rate of aloe gel polysaccharides
图4 可以看出,芦荟凝胶多糖提取率随着温度的升高呈现先上升后下降的趋势。当温度达到50 ℃时,多糖提取率最高,表明适当地提高温度可以提高酶的活性,促进酶对植物细胞壁的分解,有利于提取溶剂中易释放多糖,从而提高多糖提取率;当温度大于50 ℃时,随着温度的升高芦荟凝胶多糖提取率逐渐降低,这可能是由于超过一定温度时,温度的升高会导致酶活性的降低或酶部分失活。
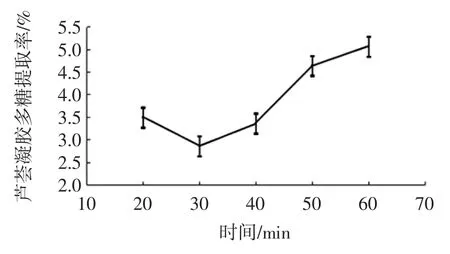
图5 超声提取时间对芦荟凝胶多糖提取率的影响Fig.5 The effect of extraction time on the extraction rate of aloe gel polysaccharides
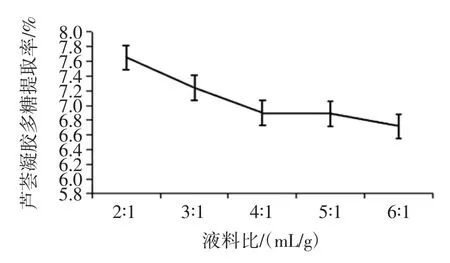
图6 液料比对芦荟凝胶多糖提取率的影响Fig.6 The effect of material-water ratio on the extraction rate of aloe gel polysaccharides

图7 pH 值对芦荟凝胶多糖提取率的影响Fig.7 The effect of pH on the extraction rate of aloe gel polysaccharides
由图5 可以看出,芦荟凝胶多糖提取率随超声时间的增加呈现先下降后上升的趋势,当超声时间达到30 min 时,芦荟凝胶多糖提取率最低,当超声时间大于30 min 时,提取率逐渐上升。
由图6 可以看出,当液料比大于 2∶1(mL/g)时,液料比的升高反而会使芦荟凝胶多糖提取率降低,而且提取液体积的过量增加会导致后续浓缩工序的负担过重,选择液料比为2∶1(mL/g)为较适宜液料比。
由图7 可以看出,当pH 值小于4.5 时,芦荟凝胶多糖提取率随着pH 值的升高而增大,说明合适地提高芦荟凝胶提取液的pH 值可以提高酶的活性,并能够促进酶对芦荟凝胶细胞壁的分解,有利于芦荟凝胶多糖的释放,提高多糖提取率,pH 值达到4.5 时提取率最高,当pH 值大于4.5 时,芦荟凝胶多糖提取率随着pH 值的升高而呈现降低趋势,这可能是由于超过了酶的最适pH 值而导致酶活性的降低。
2.3.2 响应面分析优化超声波协同复合酶法提取条件
2.3.2.1 响应面试验设计及试验结果
响应面试验结果见表5。

表5 响应面优化方案与试验结果Table 5 The methods and experimental results of response surface analysis
以芦荟凝胶多糖的提取率为响应值,通过Design-Expert.V8.0.6 软件对表5 数据进行四元二次回归分析,得到方程为:
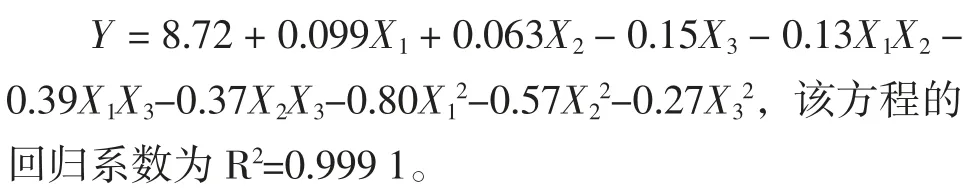
2.3.2.2 响应面方差分析与显著性检验
回归方程的各项方差分析见表6。
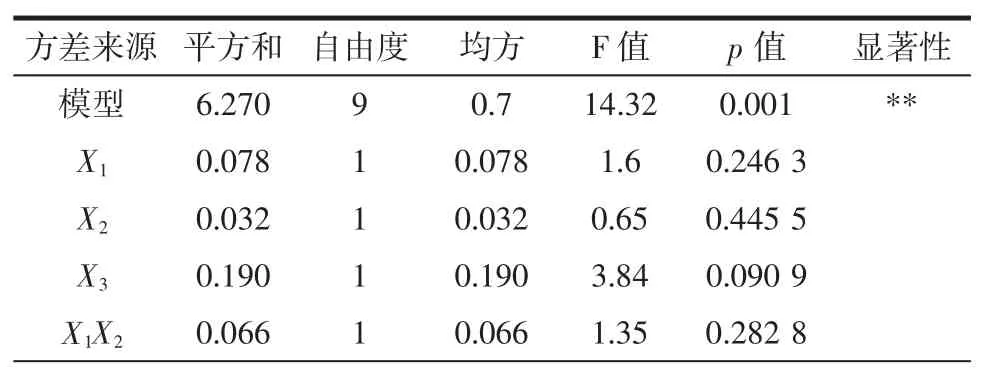
表6 回归模型的方差分析表Table 6 The anova table of regression model
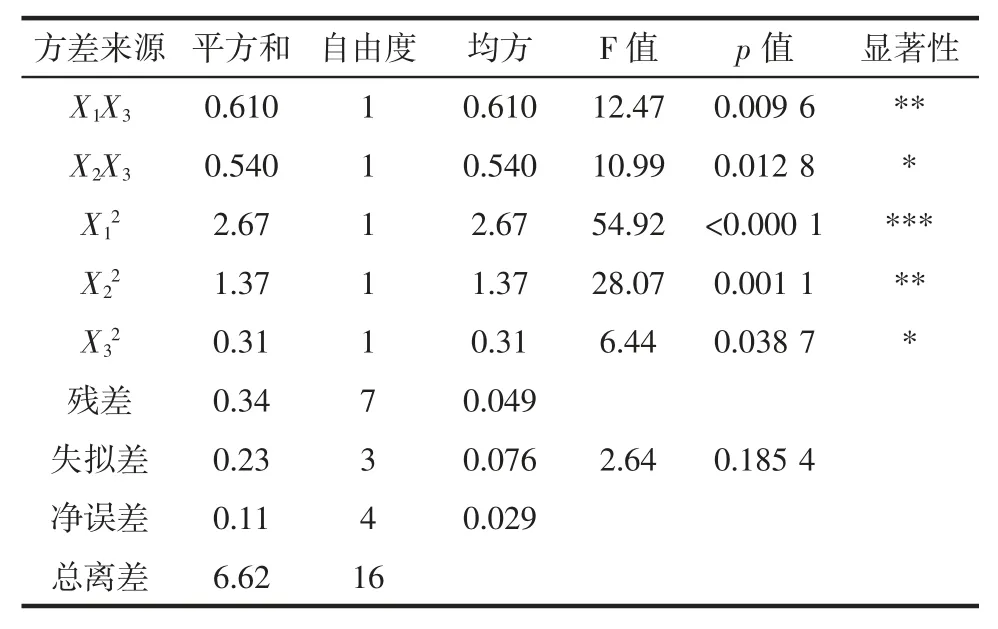
表6 回归模型的方差分析表Table 6 The anova table of regression model
回归模型的方差分析结果为F=14.32,对应的p<0.001,表明该模型极显著。p<0.05,失拟项不显著(p=0.185 4),模型显著(p=0.001 0)。
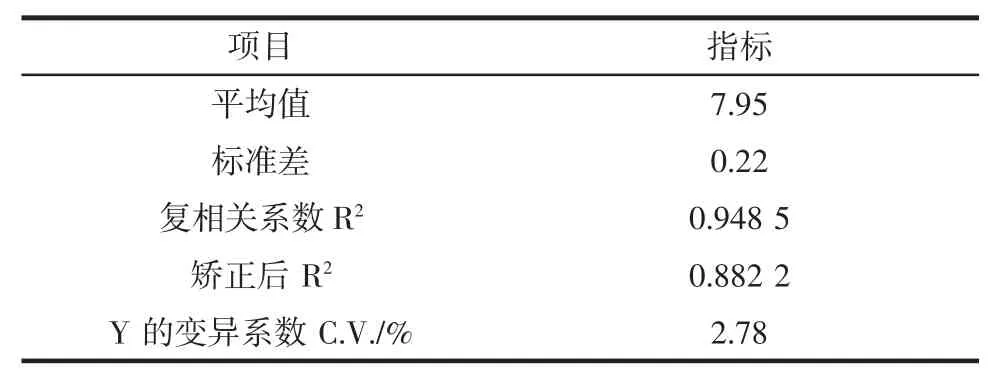
表7 为模型的显著性检验。
该回归方程确定系数R2=0.948 5,表明芦荟凝胶多糖提取得到的试验值与模型回归值有良好的一致性,即模型稳定并且与实际情况拟合度很好,可以客观地描述试验结果,校正系数R2=0.882 2,表明在多糖提取率总的变异中有88.22 %是由独立变量引起,11.78%与该模型不符。失拟项不显著,表明该模型能对最佳提取条件进行准确预测和分析。
2.3.2.3 响应曲面分析与优化
图8~图10 为相应的响应曲面图和等高线图。
从图中可以明显的看出各独立变量之间的交互作用对响应值的影响。响应面图曲面坡度陡峭程度及等高线的形状(圆形或椭圆)可以看出相应两个变量之间的交互作用是否显著。响应曲面坡度平缓和圆形的等高线表明交互作用较小,可以忽略;而响应曲面坡度陡峭和椭圆的等高线则表示交互作用较为显著或极其显著。由图8~图10 可以看出提取液pH 值对多糖得率的影响最显著,然后是超声时间和超声温度,这与方差分析的结果一致。
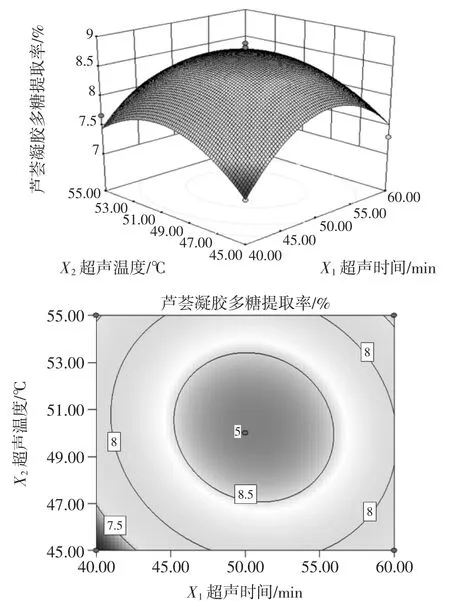
图8 超声时间与超声温度对芦荟凝胶多糖提取率影响的曲面和等高线图Fig.8 The response surface figure and contour plot of the impact of extraction time and temperature on the yield of aloe gel polysaccharides
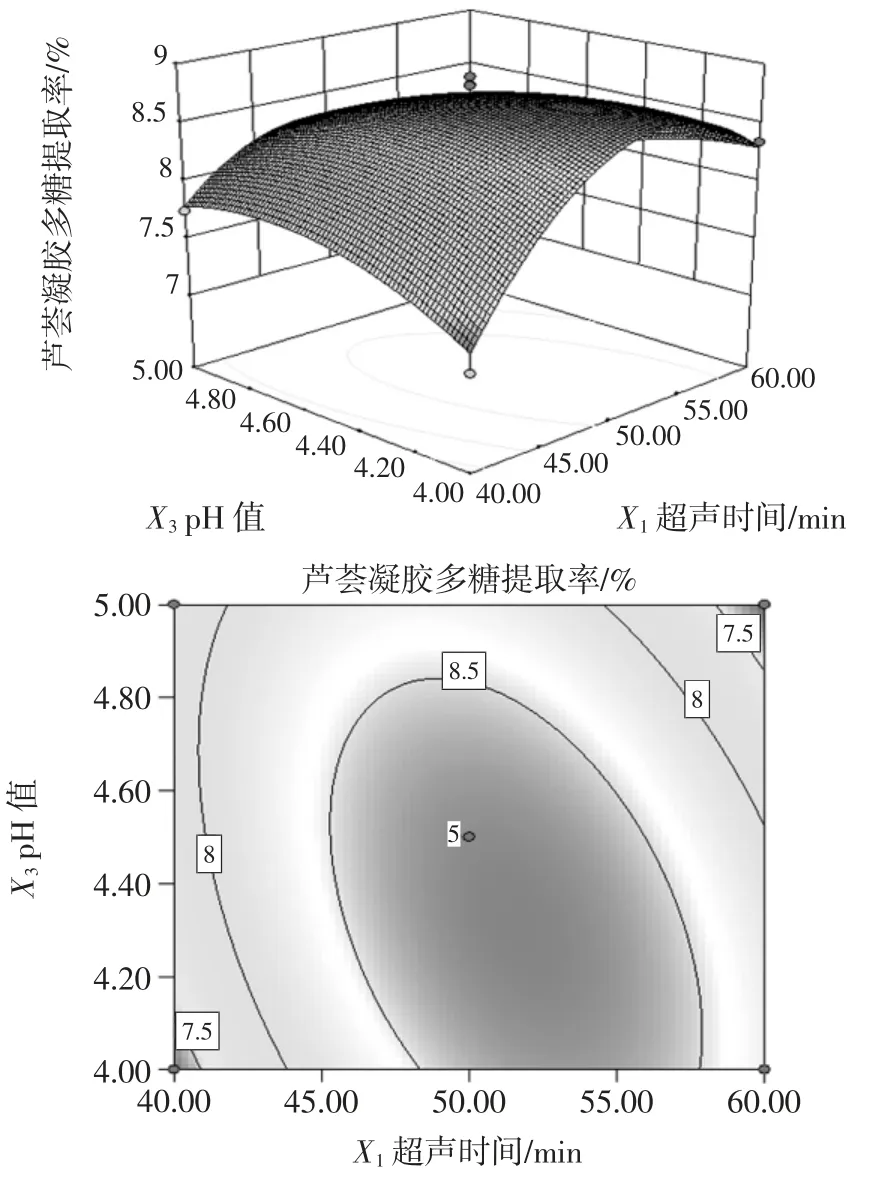
图9 超声时间与pH 值对芦荟凝胶多糖提取率影响的曲面和等高线图Fig.9 The response surface figure and contour plot of the impact of extraction time and pH value on the yield of aloe gel polysaccharides
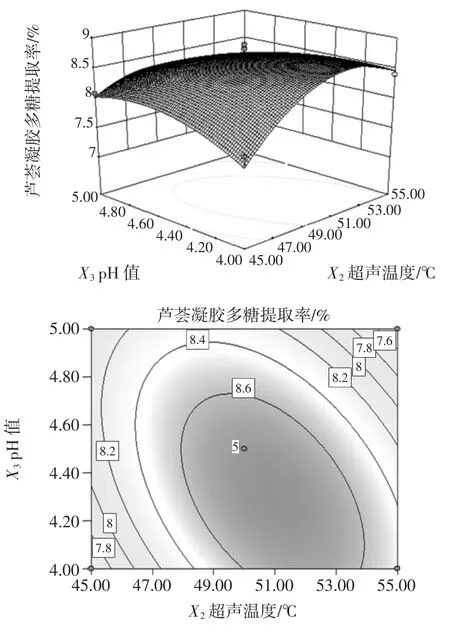
图10 超声温度与pH 值对芦荟凝胶多糖提取率影响的曲面和等高线图Fig.10 The response surface figure and contour plot of the impact of extraction temperature and pH value on the yield of aloe gel polysaccharides
由图8 可知,响应曲面坡度平缓,等高线椭圆的曲率较小,说明当提取液pH 值为4.50 时,超声时间与超声温度的交互作用对芦荟凝胶多糖提取率的影响不明显。并随着超声时间的增加,多糖提取率呈现先升高后下降的趋势。在超声时间为40min~60 min 时,超声温度从45 ℃~55 ℃时,对芦荟凝胶多糖提取率最有利。
由图9 可知,响应曲面坡度陡峭,等高线椭圆的曲率较大,说明当超声温度为50 ℃时,超声时间与提取液pH 值的交互作用对芦荟凝胶多糖提取率的影响高度显著。并在超声时间为40 min~60 min 时,提取液pH值由4 到4.5 时,芦荟凝胶多糖提取率可得到最大值。
由图10 可知,响应曲面坡度相对较为陡峭,等高线椭圆的曲率较大,当超声时间为50 min 时,超声温度与提取液pH 值的交互作用对芦荟凝胶多糖提取率的影响比较显著,当超声温度由45 ℃~55 ℃,提取液pH 值由4 到4.5 时,多糖提取率呈现上升趋势。
2.3.2.4 模型的验证
为得到最佳提取条件,在模型所拟范围内,对响应值方程求一阶偏导,得到提取率Y 取最大值8.781%时,X1、X2、X3所对应 的值分别 是 X1=51.80 min、X2=51.06 ℃、X3=4.22,为了验证响应曲面法的可靠性,通过上述最佳提取工艺参数来进行芦荟凝胶中多糖的超声波协同复合酶法提取试验,同时考虑到实际操作中出现的情况,将提取工艺参数修正为:超声提取温度51 ℃,提取时间52 min,提取液pH 值4.2,芦荟凝胶多糖的提取率为8.692%,其误差约为1.01%,在可接受范围内。
3 结论
本试验通过利用超声波协同复合酶法来提取芦荟凝胶多糖,试验表明超声波作用的同时进行酶解的协同方式不仅能增加多糖提取率,还能节约时间。通过试验确定其复合酶的最佳配比为:果胶酶1.0%,纤维素酶酶1.5%,中性蛋白酶1.0%;通过利用设计软件Design-Expert.V8.0.6 响应曲面法优化超声波协同复合酶提取芦荟凝胶多糖的最佳工艺参数为:超声温度为51 ℃,超声时间为52 min,pH 值为4.2。在此条件下芦荟多糖提取率平均值为8.692%。

