柠檬醛对酸腐菌线粒体形态和功能的影响
刘 淼,陶能国,许灵春,吴育藩,杨文蒿,敬国兴*
(湘潭大学化工学院,湖南 湘潭 411105)
2013年柑橘类水果全球产量超过1.23亿 t[1],柑橘果实具有很高的食用及营养价值。据研究报道,指状青霉(Penicillium digitatum)、意大利青霉(Penicillium italicum)和柑橘酸腐菌(Geotrichum citri-aurantii)是柑橘类水果中致病性最强的真菌[2-3],这些致病真菌通常通过伤口感染宿主[4],并在贮存过程中加速柑橘类水果的腐烂,从而导致果实丧失食用价值和经济价值。一些合成类真菌抑制剂对指状青霉和意大利青霉有很好的控制效果[5],但大多数对酸腐菌生长无明显抑制作用。Zhou Hai’en等[6]发现只有苯酚钠可以部分控制酸腐菌的生长,然而长时间使用化学抑制剂不仅对环境造成污染,还威胁人类健康[7]。因此,迫切需要开发更安全、更环保的替代产品,来有效控制柑橘果实采后病菌的污染。
精油源自植物且具有抗真菌的生物活性[8]。研究证明,精油可以有效地控制采后水果的真菌污染[9-10]。此外,Liu等[11]研究表明,百里香精油处理后酸腐菌菌丝生长发生改变。Zhou Hai’en等[6]发现,柠檬醛可以通过破坏酸腐菌细胞结构和菌丝体形态从而抑制其生长,但细胞膜被破坏后,有关细胞器损伤的进一步研究鲜见报道。
线粒体是一种重要的细胞器,可通过氧化磷酸化产生三磷酸腺苷(adenosine triphosphate,ATP),破坏其结构完整性促使生物体死亡[12]。大量研究报道,精油因其亲脂性可破坏细胞膜,从而抑制真菌生长[13-14]。李亚茹等[15]发现植物精油不仅可破坏线粒体膜、DNA修复系统等,还可影响氧化还原酶系和细胞能量代谢,最终导致细胞死亡。有研究报道精油通过破坏黄曲霉细胞膜完整性而导致胞内ATP泄漏,并抑制三羧酸循环(tricarboxylic acid cycle,TCA)中苹果酸脱氢酶(malate dehydrogenase,MDH)和琥珀酸脱氢酶(succinate dehydrogenase,SDH)活力[16]。类似地,Zheng Shiju等[17]发现经柠檬醛处理后指状青霉中不规则线粒体数量增加,且线粒体中柠檬酸合酶(citrate synthase,CS)、α-酮戊二酸脱氢酶(α-ketoglutarate dehydrogenase,α-KGDH)、异柠檬酸脱氢酶(isocitrate dehydrogenase,ICDH)、琥珀酸脱氢酶(succinate dehydrogenase,SDH)活力明显降低。本课题组前期研究结果表明,柠檬醛对酸腐菌的最小抑菌剂量(minimum inhibitory concentration,MIC)为0.5 μL/mL,最小杀菌剂量(minimum fungicidal concentration,MFC)为1.0 μL/mL[6]。本研究将探讨MIC和MFC柠檬醛处理对柑橘酸腐菌线粒体形态和功能的影响,以期为柠檬醛在柑橘果实采后品质保持方面的实际应用提供理论依据。
1 材料与方法
1.1 材料、试剂与培养基
供试菌株保存于湘潭大学生物技术和食品工程系,马铃薯葡萄糖培养基(potato dextrose broth,PDB)培养4~5 d(28 ℃),孢子浓度用血细胞计数器调整为5×106CFU/mL。
柠檬醛(纯度>95%) 美国Sigma-Aldrich公司;ATP、二磷酸腺苷(adenosine diphosphate,ADP)和一磷酸腺苷(adenosine monophosphate,AMP)(纯度≥98.5%) 美国Sigma-Aldrich公司;CS、α-KGDH、ICDH、SDH、MDH活力和CA含量检测试剂盒(分析级)北京索莱宝科技有限公司。
PDB:100 g马铃薯煮沸后用4 层纱布过滤,再加入10 g葡萄糖,定容至500 mL。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:100 g马铃薯煮沸后用4 层纱布过滤,再加入10 g葡萄糖和10 g琼脂,定容至500 mL。
1.2 仪器与设备
LC-20AT高效液相色谱(high performance liquid chromatography,HPLC)仪 日本Shimadzu公司;Quanta-200扫描电子显微镜(配有喷金程序Polaron) 美国FEI公司;Cary 60紫外分光光度计 美国Agilent公司;TDL5A离心机 长沙英泰仪器有限公司。
1.3 方法
1.3.1 线粒体的提取
将供试菌株接种于PDA培养基,于28 ℃培养5~7 d,用6 mm圆形打孔器取2 个菌斑,接种于100 mL PDB培养基,在28 ℃、150 r/min条件下振荡培养。选取培养48 h的PDB培养基,加入柠檬醛使其终添加量分别为0.5 μL/mL和1.0 μL/mL(即MIC和MFC),以不加柠檬醛为空白对照,28 ℃分别培养0、30、60 min和120 min。将处理好的菌丝体于4 ℃、4 000 r/min条件下离心15 min,过滤后待提取线粒体用。
线粒体提取参照罗曼等[16]的方法,取1.0 g菌丝体(液氮充分研磨),加入2 mL提取液(含20 mmol/L HEPE-Tris、250 mmol/L甘露醇、10 mmol/L KCl、5 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)和20 mmol/L MgCl2,pH 7.2),然后用120 目尼龙布过滤。滤液于4 ℃、4 000 r/min条件下离心15 min,取上清液于12 000 r/min离心15 min,弃去上清液即得线粒体。
1.3.2 SEM观察线粒体表面形态
参照Zheng Shiju等[17]的方法,采用扫描电子显微镜(scanning electron microscopy,SEM)观察线粒体表面形态。将线粒体置于体积分数3%的戊二醛溶液(0.1 mol/L磷酸缓冲液配制,pH 7.0)中,4 ℃保存24 h。样品再依次在体积分数为30%、50%、70%和95%的乙醇溶液中梯度脱水20 min,最终在纯乙醇中处理45 min。超低温冰箱冷冻保藏2 h后真空干燥6~8 h。
将干燥的样品通过喷金程序(60 s、1.8 mA、2.4 kV)涂上薄层(20~30 nm)金属膜作为导电介质。所有样品用SEM于15 000倍下观察。
1.3.3 HPLC法分析ATP、ADP、AMP含量
采用HPLC法分析样品中ATP、ADP、AMP含量。参照Dai Ruihua等[18]的方法,具体操作步骤如下:取0.3 g菌丝体与10 mL超纯水混匀后加入柠檬醛使其终剂量分别为0、0.5 μL/mL和1.0 μL/mL,处理0、30、60、120 min后取10 mL酸腐菌菌丝体悬浮液以8 000 r/min、4 ℃条件离心30 min,上清液用于测定胞外ATP、ADP、AMP含量,管底菌丝体用于测定胞内ATP、ADP、AMP含量。胞外ATP、ADP、AMP含量的测定采用热提取法,将上述上清液放入离心管并加入5 mL 100 ℃沸腾的2 mmol/L MgSO4提取液,摇匀,在沸水浴中保温10 min后于冰浴中冷却,4 ℃、4 000 r/min离心10 min后取上清液待测。胞内ATP、ADP、AMP含量测定前,先采用热提取法进行提取,操作步骤同上,再用液氮破碎10 min,同样条件下离心10 min,取上清液待测。
HPLC条件:色谱柱Inertsil ODS-SP C18柱(250 mm×4.6 mm,5 μm);流动相为0.05 mol/L KH2PO4-K2HPO4缓冲溶液(内含1 mmol/L EDTA,pH 6.0)-甲醇(97.5∶2.5,V/V);洗脱时间为12 min;流速为1.0 mL/min;检测温度为25 ℃;检测波长为259 nm;进样体积为20 μL。
1.3.4 TCA循环中酶活力及CA含量的检测
取待测样本,按试剂盒说明书操作步骤,用分光光度法分别对CS、α-KGDH、ICDH、SDH和MDH活力以及柠檬酸(citric acid,CA)含量进行检测。其中α-KGDH、ICDH和MDH的检测波长均为340 nm,CS、SDH和CA的检测波长分别为412、600 nm和545 nm。
1.4 数据处理与分析
采用SPSS 16.0软件的单因素方差分析进行数据处理,最小显著性差异小于5%的数据认为具有显著性影响。采用Origin 8.5和Excel 2010软件对所得数据进行图表绘制。
2 结果与分析
2.1 柠檬醛处理对酸腐菌线粒体表面形态的影响

图1 酸腐菌线粒体SEM图(×15 000)Fig. 1 Scanning electron micrograph of mitochondria in G. citri-aurantii (× 15 000)
由图1可知,SEM结果显示,添加柠檬醛培养120 min时,对照组中线粒体形状规则、形态丰满、表面光滑(图1A),但随着柠檬醛剂量的增加,线粒体表面变得粗糙、形状不规则,在MFC(1.0 μL/mL)柠檬醛处理下,线粒体出现坍塌并破裂(图1C)。
2.2 柠檬醛处理对酸腐菌胞内和胞外ATP、ADP和AMP含量的影响

图2 柠檬醛处理对酸腐菌胞内(A)和胞外(B)ATP含量的影响Fig. 2 Effect of citral on the contents of intracellular (A) and extracellular (B) ATP in G. citri-aurantii
如图2所示,培养0~120 min内MIC和MFC柠檬醛处理组胞内ATP含量明显下降(图2A),30 min时显著低于对照组(P<0.05)。相反地,MIC和MFC柠檬醛处理组胞外ATP含量随着培养时间的延长而增多,且120 min时胞外ATP含量(0.42 μg/g和0.63 μg/g)显著高于对照组(0.33 μg/g)(图2B)。
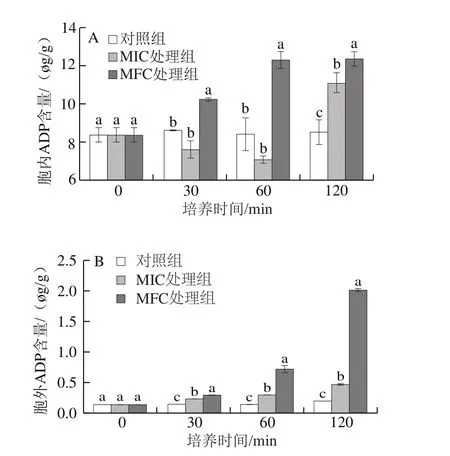
图3 柠檬醛处理对酸腐菌胞内(A)和胞外(B)ADP含量的影响Fig. 3 Effect of citral on the contents of intracellular (A) and extracellular (B) ADP in G. citri-aurantii
由图3可知,培养0~60 min内,MIC柠檬醛处理组胞内ADP含量呈下降趋势,但60 min后开始上升,120 min时胞内ADP含量增加至11.07 μg/g,MFC柠檬醛处理组胞内ADP含量在整个培养过程呈上升趋势(图3A),且显著高于对照组(P<0.05)。MIC和MFC柠檬醛处理组中,胞外ADP含量在整个培养过程呈上升趋势,且显著高于对照组(P<0.05)(图3B)。

图4 柠檬醛处理对酸腐菌胞内(A)和胞外(B)AMP含量的影响Fig. 4 Effect of citral on the contents of intracellular (A) and extracellular (B) AMP in G. citri-aurantii
由图4A可知,在整个培养期间菌丝体胞内AMP含量呈下降趋势,在培养120 min时MFC柠檬醛处理组含量仅为3.86 μg/g,显著低于对照组(7.24 μg/g)(P<0.05)。MIC柠檬醛处理组与对照组胞外AMP含量无显著差异(P>0.05),而MFC柠檬醛处理组胞外AMP含量在整个培养过程中呈上升趋势,且在培养60~120 min时MFC柠檬醛处理组AMP含量迅速增加,显著高于对照组和MIC柠檬醛处理组(P<0.05)(图4B)。
2.3 柠檬醛对酸腐菌TCA循环中关键酶活力和CA含量的影响
如图5A所示,CS活力经柠檬醛作用后被显著抑制,培养120 min时,MIC和MFC柠檬醛处理组CS活力分别仅为对照组的47.64%和46.11%。如图5B、C所示,柠檬醛处理后α-KGDH和ICDH的活力受到抑制,培养120 min时MIC和MFC柠檬醛处理组的α-KGDH活力分别为13.65 U/g和6.24 U/g,显著低于对照组(34.84 U/g);培养120 min时,对照组中ICDH活力为5.78 U/g,分别是MIC(2.49 U/g)和MFC(2.08 U/g)柠檬醛处理组活力的2.32 倍和2.78 倍。

图5 柠檬醛处理对酸腐菌CS(A)、α-KGDH(B)和ICDH(C)活力的影响Fig. 5 Effect of citral treatment on the activity of CS (A), α-KGDH (B)and ICDH (C) in G. citri-aurantii

图6 柠檬醛处理对酸腐菌SDH(A)和MDH(B)活力的影响Fig. 6 Effect of citral treatment on the activity of SDH (A) and MDH (B)in G. citri-aurantii
由图6可知,柠檬醛处理后SDH和MDH的活力显著降低,而对照组中2 种酶的活力基本保持不变。培养120 min后,MIC和MFC柠檬醛处理组的SDH活力分别为5.17、3.65 U/g,均显著低于对照组(14.07 U/g)(P<0.05);类似地,与对照组相比,MIC和MFC柠檬醛处理组中MDH活力也相应降低了80.89%和85.61%。

图7 柠檬醛处理对酸腐菌CA含量的影响Fig. 7 Effect of citral treatment on the content of citric acid in G. citri-aurantii
由图7可知,MIC和MFC柠檬醛处理组中CA含量整体呈下降趋势,而对照组基本保持不变。随着培养时间延长,柠檬醛处理组中CA含量持续降低,120 min时MIC和MFC柠檬醛处理组中CA含量分别为2.96 μmol/g和1.06 μmol/g,显著低于对照组(P<0.05)。
3 讨 论
有研究报道精油可以通过影响线粒体功能来发挥其抗真菌活性[19-21],Perina等[22]发现百里香精油可破坏链格孢菌的细胞壁和细胞质膜,从而进一步破坏线粒体。类似地,Romagnoli等[23]证明孔雀草精油可改变灰霉菌内膜系统,导致其核膜溶解和线粒体退化。Park等[14]证明,柠檬醛可改变毛藓菌属真菌线粒体的形态,并极显著抑制菌丝的生长。本研究中,SEM结果清楚地表明,柠檬醛破坏酸腐菌的线粒体形态,添加柠檬醛培养120 min时,MIC组线粒体出现坍塌,MFC组的线粒体形态出现不可逆转的破裂。与Zheng Shiju等[17]研究结果相似,柠檬醛可破坏指状青霉线粒体膜,且高浓度柠檬醛处理可使其线粒体结构坍塌。因此,柠檬醛可能通过对线粒体结构的破坏来抑制酸腐菌生长。
生物体中能量的生成与线粒体结构和功能有关,Pinto等[24]指出纤毛苔草精油可明显抑制酵母细胞线粒体酶活力和能量的生成。Turgis等[25]报道芥子精油处理后大肠杆菌和伤寒沙门氏菌胞内ATP含量减少,且细胞膜完整性和内环境稳态遭到破坏。本研究结果表明,柠檬醛处理后酸腐菌线粒体膜被破坏且胞内ATP含量下降,胞外ATP含量增加,这些结果证明胞内ATP可通过损伤的细胞膜向细胞外泄漏,此现象与Burt[26]的研究结果一致,该研究中蜡样芽孢杆菌经香芹酚处理后胞内ATP含量显著下降,胞外ATP含量显著增加。
除对ATP合成的影响外,精油处理还可加速ATP转化为AMP、ADP[27]。本研究中柠檬醛处理120 min后酸腐菌中胞内和胞外ADP的含量均呈显著上升趋势(P<0.05),初步推测柠檬醛损伤线粒体的结构造成ATP合成受损,ATP分解释放能量维持菌丝体存活,从而导致ADP含量上升。但AMP与ADP含量的变化趋势并不一致,柠檬醛处理后胞内AMP含量下降,推测ATP分子中β-和γ-磷酸基团中的高能键水解程度高于α-和β-磷酸基团之间的高能键,故短时间内ATP未直接水解为AMP而导致ADP大量积累。且柠檬醛处理组中线粒体膜损伤导致胞内AMP泄露至胞外,故培养60 min后胞外AMP大量积累。
Huang等[28]研究证明,抑制α-KGDH活力可减少NADH+H+的生成,氢供体的缺乏导致ATP合成减少。本研究中,柠檬醛处理抑制酸腐菌中CS、ICDH、SDH、MDH、α-KGDH的活力,该类酶活力降低可减少TCA循环中NADH+H+和呼吸链中ATP的合成,导致线粒体功能受损而抑制柑橘类宿主真菌的生长。
本研究结果表明,柠檬醛处理可破坏酸腐菌线粒体形态,MIC处理使线粒体结构严重坍塌,MFC处理则破坏了线粒体膜的完整性,从而导致胞内ATP、ADP和AMP泄漏至胞外。此外,柠檬醛可破坏线粒体功能,降低CS、α-KGDH、ICDH、SDH、MDH活力及CA含量。这些研究结果进一步证实了柠檬醛通过破坏酸腐菌线粒体形态和功能进而抑制其生长。

