银耳多糖与结冷胶复配体系的流变及凝胶特性
刘婷婷,杨嘉丹,曹宸瑀,张艳荣,*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.农业农村部食用菌加工技术集成科研基地,吉林 长春 130118)
银耳多糖(Tremella fuciformispolysaccharide,TFP)来源于银耳子实体、孢子、发酵液中分离纯化得到的带有分支的杂多糖[1],具有抗肿瘤[2]、抗氧化[3]、降低血脂[4]、促进伤口愈合[5]、增强免疫力[6]等功效。目前,TFP的研究主要集中于生物活性和提取工艺方面[1,7],对于其在食品中改善产品质构特性等方面的研究也有少量报道。Zhang Yakun等[8]研究发现,TFP可以增加蛋白的凝胶强度,提高产品的持水力和硬度;卢玉容等[9]发现,通过添加适量TFP可缩短发酵时间,改善低脂酸奶的持水力和质构,提升低脂酸奶的感官品质。
结冷胶(gellan gum,GG)是由少动鞘鞍醇单胞菌(Sphingomonas paucimobilis)合成的胞外多糖[10]。近年来,学者们做了大量关于GG应用于食品和生物医药工业的研究。作为凝胶剂,GG具有良好的稳定性,且耐酸、耐高温、热可逆以及用量少[11],但同时GG凝胶质地脆性大,并且受阳离子浓度影响,从而限制了GG在食品工业中的应用。因此,在很多的实际应用中,通常将2 种甚至多种亲水胶体复配使用来改变单一亲水胶体在实际生产应用中的缺陷,进而起到替代食品原料、改善质构、创造复合结构和控制缩水性的作用[12]。研究发现GG与其他亲水胶体(魔芋胶、果胶等)具有良好的复配性能[12-15]。
目前,有关TFP和GG相互作用的研究还鲜见报道。本实验利用流变仪和质构仪等研究TFP、GG以及两者按不同质量比复配后体系的流变、凝胶及持水特性,以期拓宽TFP的应用范围,提高产品营养价值,同时减少食用胶使用量,为我国新型食品的开发提供理论指导。
1 材料与方法
1.1 材料与试剂
TFP为实验室自制,具体方法为:称取一定量银耳粉,按液料比50∶1加入蒸馏水,在微波功率400 W下提取2 h,提取液经脱蛋白、浓缩、醇沉、冷冻干燥后即为TFP。
GG(食品级) 浙江中肯生物科技有限公司。
1.2 仪器与设备
DHR-3流变仪 美国TA公司;TA.XT Plus质构仪英国Stable Micro Systems公司;CT15RT多功能冷冻高速离心机 天美(中国)科学仪器有限公司;DIKW-4双列四位电热恒温水浴锅 北京中兴伟业仪器有限公司;IR Prestige傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 日本岛津公司;ALTO 2500高分辨率扫描电镜冷冻传输装置 美国Gatan公司;JSM 6301F扫描电子显微镜 日本JEOL公司。
1.3 方法
1.3.1 样品的制备
以蒸馏水配制不同质量浓度(0.4、0.8、1.2、1.6、2.0 g/100 mL)的TFP溶液和GG溶液,以及不同质量比(1.6∶0.4、1.2∶0.8、0.8∶1.2、0.4∶1.6)的TFP/GG复配体系,将上述溶液及复配体系置于75 ℃恒温水浴锅中充分加热,搅拌混合物直至完全溶解,将蒸发掉的水分用75 ℃的蒸馏水进行补充至混合时的初始体积。将制备好的样品于4 ℃条件下贮存18 h后进行质构特性分析。
1.3.2 流变特性的测定
将制备好的样品置于流变仪测试平台上,采用直径40 mm平行板测量,每次测试均需更换样品。
静态流变性测定:温度75 ℃,测定在剪切速率为0.1~1 000 s-1内样品表观黏度(η)的变化,并用Power-Law数学模型进行拟和。
动态黏弹性测定:温度75 ℃,扫描应变1%,测定在角频率为0.1~100 rad/s内样品储能模量(G’)和损耗模量(G”)的变化。
在TFP和GG复配体系频率扫描的线性黏弹区域,G’和G”随角频率的变化可按方程(1)、(2)[16]进行拟合。

式中:n’和n”分别为G’和G”的相关系数;ω为角频率;K’是每个正弦剪切变形周期储存和恢复的能量;K”是在1 Hz条件下每个正弦剪切变形周期损耗的以热量形式散失的能量。
触变性测定:温度75 ℃,剪切速率先从0.1 s-1增加到1 000 s-1,之后立即以同样的变化速率从1 000 s-1下降到0.1 s-1,记录整个过程中各样品溶液剪切应力的变化情况。
1.3.3 凝胶强度的测定
采用质构仪测定凝胶破裂所需的最大力,即为凝胶强度[17]。测定条件:P/0.5圆柱形探头,测前速率和测中速率为1.00 mm/s,测试探针上升速率为10.00 mm/s,位移10.00 mm,触发力5.0 g。每组实验平行3 次。
1.3.4 凝胶质构的测定
采用质构仪对不同条件下制备的凝胶进行质地剖面分析。测定条件:P/36R不锈钢圆柱形探头,测前速率和测中速率均为1.00 mm/s,测试探针上升速率为10.00 mm/s,压缩程度30%,触发力5.0 g。每组实验平行3 次。
1.3.5 凝胶持水性的测定
将约1 mL不同条件下制备的凝胶体系加入到塑料离心管中,待其凝胶后,10 000 r /min离心15 min,吸去上层水,按式(3)计算持水力(water holding capacity,WHC)。

式中:m0为空离心管质量/g;m1为离心前装有凝胶的离心管质量/g;m2为吸去上层水分后的离心管质量/g。每组实验平行3 次。
1.3.6 凝胶的FTIR分析
参照李晋等[18]方法,称取由2 g/100 mL TFP溶液、GG溶液及不同质量比复配体系制备的凝胶粉末2 mg,加入200 mg烘干至恒质量的KBr,置于研钵中研磨均匀,用电动压片机压片,在4 000~400 cm-1范围进行FTIR扫描。
1.3.7 低温扫描电子显微镜观察凝胶结构
采用配备冷冻传输装置的扫描电子显微镜进行凝胶结构观察。取约1~3 mm3的凝胶放置到样品保持器中,并迅速在液氮(-210 ℃)中冷却,随后将样品转移到冷冻传输装置上(-150 ℃),-90 ℃升华5 min以除去暴露在凝胶表面的冰。最后对样品溅射镀金,在温度-150 ℃、加速电压15 kV条件下进行分析。
1.4 数据处理与分析
实验数据采用Excel 2010软件绘图,采用SPSS 16.0软件通过Duncan’s法进行多组样本间差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 不同质量浓度TFP溶液、GG溶液和不同质量比TFP/GG复配体系的静态流动性
在75 ℃下,各样品表观黏度(η)在剪切速率0.1~1 000 s-1之间的变化如图1所示。所有质量浓度的TFP溶液、GG溶液,以及所有比例的TFP/GG复配溶液的表观黏度均随剪切速率的增加而降低,表现出剪切变稀的假塑性[19]。在相同剪切速率下,TFP溶液和GG溶液表观黏度随着质量浓度的增加而增加,TFP/GG复配溶液表观黏度随着TFP比例的增加而增加。将曲线拟合为幂律方程η=kγn-1,式中η为表观黏度,γ为剪切速率。其中,k是稠度指数,k越大,液体越黏稠。n是流动行为指数,也称为假塑性指数,即若n=1,流体为牛顿流体;n<1,流体被归类为假塑性流体;n>1,则为胀塑性流体[20]。


图1 不同质量浓度TFP溶液(A)、GG溶液(B)和不同质量比对TFP/GG复配体系(C)的表观黏度(η)Fig. 1 Shear rate dependent viscosity (η) of TFP solutions (A), gellan solutions (B) at different concentrations and on TFP/GG mixtures at different mass ratios (C)
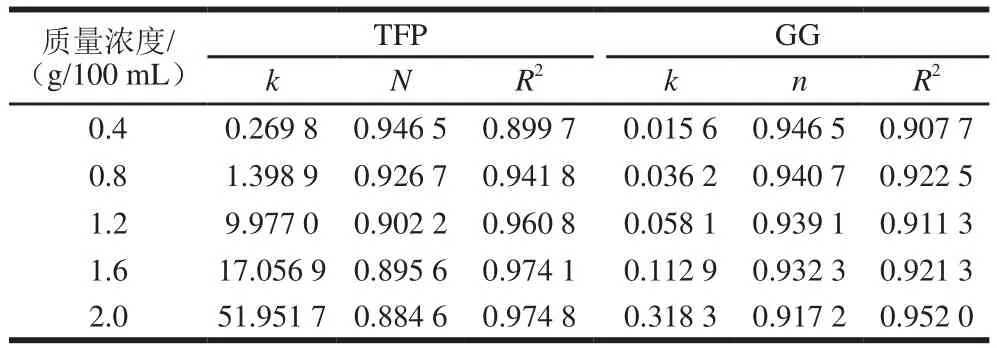
表1 不同质量浓度TFP溶液和GG溶液的幂律模型拟合参数Table 1 Fitting parameters for the power law models of TFP and GG solutions at different concentrations

表2 不同质量比TFP/GG复配体系的幂律模型拟合参数Table 2 Fitting parameters for the power law models of TFP-GG mixtures at different mass ratios
由表1可知,随着质量浓度的增大,TFP溶液和GG溶液的稠度指数逐渐增加,流动行为指数逐渐降低,说明质量浓度越高,溶液的黏稠性越大,假塑性也越强。质量浓度为0.4 g/100 mL的TFP溶液和GG溶液的稠度指数最小,流动行为指数最大,最接近于牛顿流体。
由表2可知,TFP/GG复配溶液流动行为指数在0.882 1~0.917 2之间,表明TFP/GG复配溶液是假塑性流体。且在共混状态下,TFP/GG质量比为1.6∶0.4时,流动行为指数最小,说明此时的流动性最好。剪切稀化现象对食品加工过程有重要影响,在物料体系中通过添加TFP,可改善其流变性能,使其适宜于高剪切速率下加工,改进物料输送和灌注工艺,使能量消耗减少,易于加工成型[17]。
2.2 不同质量浓度TFP溶液、GG溶液和不同质量比TFP/GG复配体系的动态黏弹性
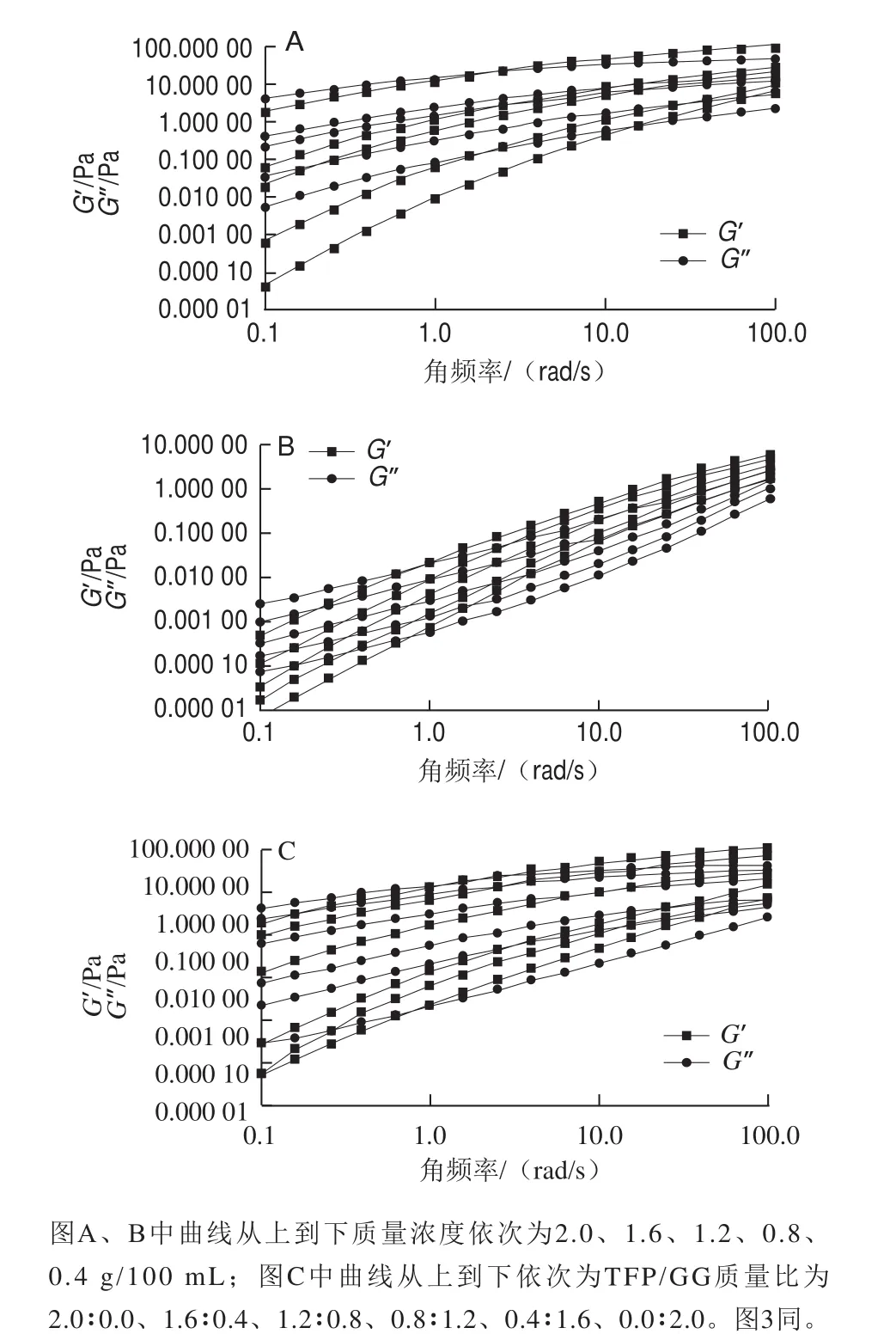
图2 不同质量浓度TFP溶液(A)、GG溶液(B)和不同质量比TFP/GG复配体系(C)的动态流变学特性(75 ℃)Fig. 2 Dynamic rheological properties of TFP solutions (A) and GG solutions (B) at different concentrations, as well as their mixtures at different mass ratios (C) (75 ℃)
凝胶体系的动态黏弹性与其实际应用性能直接相关。储能模量G’能反映黏弹性物质的类固体性质即弹性和刚性,而损耗模量G”能反映黏弹性物质的类液体性质即黏性和流动性[21-22]。如图2A、B所示,TFP溶液和GG溶液G’和G”随角频率的增加而增加,且不同质量浓度下均为G”先高于G’,角频率达到一定值后G’高于G”,GG溶液的曲线交点低于TFP溶液。其原因可能是TFP、GG的分子构象、分子链间作用力以及分子质量的不同所致[17]。
如图2C所示,TFP/GG复配体系的G’和G”也随角频率的增加而增加,在低频率下G’小于G”,体系以黏性为主;角频率达到一定值后G’大于G”,此时体系以弹性为主,呈现一定的弱胶性。而G’和G”曲线的交点随着TFP比例的增加表现出先增大后减小的趋势,这说明TFP对复配体系的动态黏弹性影响较大,在适当质量比下可提高复配体系的黏性和流动性。

表3 不同质量浓度TFP溶液G’和G”随角频率的变化Table 3 Variation in G’ and G” of TFP solutions with different concentrations as a function of angular frequency

表4 不同质量浓度GG溶液G’和G”随角频率的变化Table 4 Variation in G’ and G” of GG solutions with different concentrations as a function of angular frequency

表5 TFP/GG复配体系G’和G”随角频率的变化Table 5 Variation in G’ and G”of TFP-GG mixtures with different mass ratios as a function of angular frequency
通过公式(1)、(2)对各样品体系线性黏弹区域的数据进行拟合,计算得到的参数如表3~5所示。从动态流变数据可以看出,随着质量浓度的增加,TFP溶液和GG溶液的n’和n”减小,而K’和K”增大,说明样品溶液的黏性增强,这与静态流变性的分析结果一致。
由表5可以看出,随着TFP质量比例的增加,TFP/GG复配体系的n’从0.270 80降至0.115 90,n”从0.199 40降至0.068 80,说明复配体系的弹性增强;而K’和K′随着TFP比例的增加而增大,这可能是由于TFP的增稠性提高了TFP/GG复配体系中连续相的黏弹性[20]。以上结果表明,TFP质量浓度对TFP/GG复配体系的动态流变性质起到决定性的作用。
2.3 不同质量浓度TFP溶液、GG溶液和不同质量比TFP/GG复配体系的触变性

图3 不同质量浓度TFP溶液(A)、GG溶液(B)和不同质量比TFP/GG复配体系(C)的触变性(75 ℃)Fig. 3 Thixotropic curves of TFP solution (A), GG solution (B) at different concentrations, as well as their mixtures at different mass ratios (C) (75 ℃)
由图3可知,各样品溶液剪切应力上升过程与下降过程不重合,在曲线下方形成了明显的触变环,这表明体系属于触变体系。TFP溶液的触变环面积随质量浓度的变化较小(图3A),而GG溶液、TFP/GG复配溶液的触变环面积随GG质量浓度的增加而增大(图3B、C)。触变环面积大小反映触变性的大小,若触变环面积大,则表示此体系经外力作用后黏度变化大,外力撤除后,体系恢复到未经外力作用状态所需的时间长,该过程即触变性反应物料经长时间剪切后在静止时重新稠化的过程[23-24]。食品制作过程中希望触变环面积越小越好,这样有助于食品保型,易于食品的加工制作。添加TFP可以改善GG的触变性,因此在食品中应用时可以根据不同情况使用不同质量比的TFP/GG复配体系。
2.4 不同质量浓度TFP溶液、GG溶液和不同质量比TFP/GG复配体系的凝胶性和质构特性

表6 不同质量浓度TFP溶液、GG溶液和不同质量比TFP/GG复配体系的质构特性Table 6 Textural characteristics of TFP solutions, GG solutions at different concentrations, as well as their mixtures at different mass ratios
质构特性对于固体食品尤为重要,因为加工过程中其质地比液体食品更容易改变[25]。由表6可知,随着TFP比例的增加,复配凝胶的凝胶强度、硬度、咀嚼性和回复性降低。由此可见,TFP的添加明显降低了复配凝胶的硬度,这种现象在GG和其他多糖复配的研究中也有报道[15,26],因此,在复配体系中,凝胶硬度主要来自于GG的网络结构,而不是聚合物的重排,GG是决定凝胶硬度的关键性因素[27]。
另外,各比例TFP/GG复配凝胶的弹性和黏性均大于单独使用的GG凝胶,当复配质量比为1.6∶0.4、1.2∶0.8、0.8∶1.2、0.4∶1.6时,其凝胶弹性为28.15%、35.77%、38.08%、43.87%,均高于GG凝胶。说明TFP与GG分子间的缠绕使其复配体系形成了质地更优的弹性凝胶,为开发凝胶类食品提供参考依据。GG溶液和TFP/GG复配体系均可形成良好的凝胶结构。
2.5 不同质量浓度GG凝胶和不同质量比TFP/GG复配凝胶的持水性
由图4可知,GG凝胶持水力能随GG质量浓度的增加而增加(图4A),TFP/GG复配凝胶均呈现良好的持水力(图4B),均大于90%,且随着TFP比例的增加而增加,均优于GG持水性能。由此可知,TFP可以显著提高复配体系的持水性能,其原因可能是当TFP穿插在TFP/GG复配凝胶体系中时,与GG形成了良好的凝胶网络结构[28],有利于将TFP/GG复配体系应用于凝胶类食品制作当中。

图4 不同质量浓度GG凝胶(A)和不同质量比TFP/GG复配凝胶(B)的持水性Fig. 4 Water-holding capacity of GG gels at different concentrations (A),and TFP/GG gels (B) at different mass ratios
2.6 TFP凝胶、GG凝胶及不同质量比TFP/GG复配凝胶的FTIR分析

图5 TFP凝胶、GG凝胶和不同质量比TFP/GG复配凝胶的FTIR图Fig. 5 FTIR spectra of gel TFP gel, GG gel and TFP/GG gels at different mass ratios
由图5可见,TFP凝胶的FTIR谱图中的主要表现为3 202 cm-1和2 926 cm-1的吸收峰,分别来自糖类分子O—H和C—H的伸缩振动[29]。1 643 cm-1和1 416 cm-1处的吸收峰分别对应于糖醛酸中C=O振动和C—O伸缩振动[30]。1 026 cm-1和1 250 cm-1处的吸收峰分别是由于糖环中的C—O—C伸缩振动和C—H可变角振动[31]。806 cm-1处的吸收峰为α-型吡喃糖的C—H弯曲振动或硫酸盐组中的C—O—S[30,32]。对于GG凝胶,其在2 926、1 159、1 029 cm-1和611 cm-1处观察到主要吸收峰。
TFP凝胶和TFP/GG复配凝胶的特征吸收峰位置基本相同,复配凝胶中随着TFP比例的增加,峰的振幅相应增加。在3 202~3 288 cm-1区域间O—H伸缩振动变化不大,说明氢键作用力在复配体系中不占主导作用,可能是TFP与GG之间的静电作用。随着TFP比例的减小,复配凝胶吸收峰由1 643 cm-1(1.6∶0.4)轻微红移,分别移动至1 614、1 604、1 614 cm-1和1 599 cm-1,表明有序结构增加[33]。与GG凝胶吸收峰(2 926 cm-1)相比,质量比为1.6∶0.4、1.2∶0.8、0.8∶1.2、0.4∶1.6复配凝胶吸收峰分别转移至2 854、2 856、2 854 cm-1和2 911 cm-1低波数段,表明—CH2基团更可能与其他侧链相互作用。此外,质量比为1.6∶0.4、1.2∶0.8、0.8∶1.2、0.4∶1.6复配凝胶中的硫酸盐基团分别转移至1 147、1 149、1 139 cm-1和1 148 cm-1。这些结果表明TFP与GG之间发生相互作用,导致聚电解质复合物的形成。
2.7 TFP凝胶、GG凝胶及不同质量比TFP/GG复配凝胶的微观结构

图6 TFP凝胶、GG凝胶及不同质量比TFP/GG复配凝胶的微观结构(2 000×)Fig. 6 Microstructure of TFP gel, GG gel and TFP/GG gels at different mass ratios (2 000 ×)
由图6可知,不同质量比TFP和GG复配的各凝胶微观结构具有明显差异。TFP凝胶微观结构均一,孔隙排列整齐规律,呈立体多边形蜂窝状(图6A),这主要是水合作用下TFP分子间交联的结果。随着GG比例的增加(图6B~E),复配凝胶结构发生明显变化,孔隙变大,立体蜂窝状结构逐渐削弱;当GG比例增加至1.6∶0.4(图6E)时,复配凝胶的微观结构变得十分致密,呈现出连续的丝状和片状结合的聚集体,表明TFP和GG之间具有很好的相容性和交联性;这与质构分析及持水性的分析结果一致。图6F显示,GG凝胶结构主要是由丝状链和小颗粒组成的网状平面,扫描电子显微镜下没有观察到立体的空间结构。综上可知,复配体系中,TFP和GG分子之间存在相互作用,且可以形成良好的凝胶网络结构。
3 结 论
本实验对不同质量浓度(0.4、0.8、1.2、1.6、2.0 g/100 mL)的TFP溶液、GG溶液及不同质量比(1.6∶0.4、1.2∶0.8、0.8∶1.2、0.4∶1.6)的TFP/GG复配体系的流变和凝胶特性进行研究,结果表明,TFP对复配体系的动态流变特性有决定性作用,TFP可以降低复配凝胶的硬度及弹性,有效提高其持水性能。因此,可在食品加工中添加适当比例的TFP/GG复配混合物,来满足不同产品对黏稠度、凝胶及持水特性的需求,在提高产品营养价值同时还可减少食用胶的使用量,提升产品品质,拓宽TFP的应用范围。

