PCR技术在水产动物疾病检测中的应用
李伟哲,刘 露,张 辉,肖 勤
( 1.河北农业大学 生命科学学院,河北 保定 071001; 2.河北农业大学 海洋学院,河北 秦皇岛 066003 )
聚合酶链式反应(PCR)是一种体外扩增特异DNA片段的分子生物学技术[1]。1985年,美国学者Mulis等首创了PCR技术,并由美国PE-Cetus公司进一步开发研制[2]。PCR技术的最大特点为可将微量的基因片段短时间内进行指数扩增,并具有较高的灵敏度和特异性,可对目的基因进行快速检测,因此,其应用领域不断扩大。目前,PCR技术已广泛地应用于医学检测[3]、环境监测[4]、转基因食品[5]、水产养殖[6]等多个领域。随着PCR技术的发展,以常规PCR技术为基础,根据需求不同,又衍生出多种新型PCR技术,如多重PCR[7]、实时荧光定量PCR[8]、巢式PCR等[9]。这些技术在病原菌快速检测方面,特别是在多种病原菌的同时检测、分型鉴定,以及定量检测方面均优于其他技术。各类PCR技术已广泛应用于动物临床疾病诊断,为其在水产动物疾病检测中的应用提供了相应的技术基础。
随着我国水产养殖业的规模持续扩大[10],集约化程度不断提高,我国水产养殖动物病害频繁暴发,其致病微生物在水产养殖中已达200种以上[11]。常规的水产动物疾病检测手段在其灵敏度方面还有欠缺,难以用于对微量致病微生物的快速检测。近年来,国内外很多学者对PCR技术在水产动物致病微生物检测及实际生产中的应用进行了大量的研究[12]。笔者基于此,对各类PCR技术在水产动物检测中的应用进行了综述,并对新型PCR技术在该方面的发展趋势进行了展望。
1 常规PCR
常规PCR是根据目的核苷酸序列设计引物,扩增其特异性片段,并进行电泳分析[13]。目前,PCR技术已应用于多种细菌的诊断及样品检测。2001年Altinok等[14]以鲁氏耶尔森氏菌(Yersiniaruckeri)的16S rRNA保守序列设计引物,应用PCR技术,在虹鳟(Oncorhynchusmykiss)血样中成功检测出了该细菌,实现了对鲑科鱼类红嘴病的快速检测。2009年,文万侥等[15]建立了基于PCR技术的河流弧菌(Vibrioftuvialis)快速检测体系,特异性良好,其灵敏度可达9.3×103cfu/mL。随后,姚东瑞等[16]建立了一种哈维氏弧菌(V.harveyi)的PCR检测体系,该体系可用于快速诊断由此细菌所引起的水产动物疾病。蒋依依等[17]根据诺卡氏菌(Nocardiaseriolae)的16S~23S转录间隔区(Intergenic spacers, ITS)序列设计特异性引物,建立了诺卡氏菌的PCR快速检测体系,具有较好的特异性。同时该 PCR 体系也具有较高的灵敏度,对 DNA 模板的检出限可达5 pg/μL,该方法比传统细菌鉴定更为灵敏、高效。黄冠军等[18]基于柱状黄杆菌(Flabobacteriumcolumnare)保守性毒力基因即硫酸软骨素裂解酶基因的一段保守序列,建立了柱状黄杆菌的常规PCR检测体系,具有较好的检测特异性,对靶标 DNA的检测灵敏度为pg级,对柱状黄杆菌的检测灵敏度为1.25×103cfu/mL。
除细菌外,PCR技术对病毒的检测也在水产动物疾病防治中得到了应用。例如孙新颖等[19]将不同地区得到的白斑综合征病毒核酸样本通过设计特定引物,对ORF14/15、ORF23/24、ORF75、ORF94以及ORF125片段进行PCR扩增,通过测序来分析不同样本的缺失及变异差异。结果显示,白斑综合征病毒在中国不同地区存在一定程度的变异, 其在序列中的缺失、重复单元数目以及单核苷酸多态性的差异较为明显。随后Simrouni等[20]利用PCR技术对不同地区的白斑综合征病毒的ORF94序列进行了分析对比,证实在8个不同国家白斑综合征病毒的该片段都存在一定程度的变异,且白斑综合征病毒的变异存在不同来源,主要为饲料和仔虾。把握好这两点因素可避免对虾产业造成重大经济损失。常规的PCR技术操作简单,可特异性的快速检测细菌和病毒,但为满足多层次、快速、精准的检测需求,又衍生出多种新型PCR技术[21]。
2 多重PCR
多重PCR是在同一PCR反应体系中,加入多对不同特异性引物,同时扩增出多个目的基因片段的PCR技术,其优点是可同时对多种病原微生物进行检测或鉴定。

在病毒检测方面,Tsai等[26]建立了可同时检测白斑综合征病毒和桃拉综合征病毒的多重PCR检测体系。以3个引物组,按3∶1∶1的比例混合扩增桃拉综合征病毒,白斑综合征病毒和凡纳滨对虾(Litopenaeusvannamei)基因组。结果表明,在没有病毒感染的情况下,仅有一条片段进行了扩增;在被白斑综合征病毒或桃拉综合征病毒感染的样本中,出现了两条扩增片段;在同时感染两种病毒的情况下,所有3种扩增片段可同时被检测到,该结果对白斑综合征病毒和桃拉综合征病毒的同时检测有一定指导意义。2014年刘飞等[27]针对6种对虾病毒,包括白斑综合征病毒、传染性皮下及造血组织坏死病毒、肝胰腺细小病毒、桃拉综合征病毒、对虾杆状病毒和传染性肌肉坏死病毒分别设计引物,成功进行了多重PCR检测。
在病毒的分型检测方面,多重PCR是首选技术之一。曾伟伟等[28]针对草鱼呼肠孤病毒Ⅰ、Ⅱ、Ⅲ型毒株的保守区域分别设计3对引物,建立了草鱼呼肠孤病毒三重反转录PCR(RT-PCR)体系。该方法对Ⅰ、Ⅱ、Ⅲ型草鱼呼肠孤病毒的检测限分别为260、190、230 拷贝的病毒量。该方法可特异性的检测各种类型的草鱼呼肠孤病毒, 且具有较高的敏感性。
以上研究充分证明,多重PCR技术具有较常规PCR省时、简便且试剂消耗少等优点,在实际检测中具有一定的应用价值。但在检测过程中也存在着不足,若有极少量外源性DNA污染,就可能会出现假阳性结果。另外,多对引物同时扩增时,若试验条件控制不当,很容易导致进行非特异性扩增。
3 实时荧光定量PCR
实时荧光定量PCR (FQ-PCR)是通过监测PCR 反应过程中所加入荧光基团的荧光信号,利用已知含量的标准品绘制标准曲线,对未知样品进行定量分析的一种核酸定量技术。近几年来,实时荧光定量PCR技术受到了广泛关注[29-31]。该方法可实时监控整个PCR过程,通过标准曲线对未知模板进行定量分析,很好的解决了PCR只能定性而不能定量的问题。实时荧光定量PCR包括探针型和非探针型两类。
探针型是在加入一对引物的同时加入一个特异性的荧光探针,该探针为两端分别标记一个报告荧光基团和一个淬灭荧光基团的一段,并与靶序列形成互补的寡核苷酸序列,通过探针的荧光强度指示扩增量,实现了荧光信号的累积与PCR产物同步。实时荧光定量PCR工作原理见图1[29]。随着各种新探针技术的不断涌现,韦信贤等[32]总结了目前常用的实时荧光定量PCR探针(表1)。

图1 TaqMan荧光探针工作原理[29]
非探针型则通常利用染料来指示扩增量,特异性较探针型稍低,但试验操作简洁方便。非探针型工作原理见图2[29],双链嵌合荧光染色Ⅰ可以结合到双链DNA上面,随着PCR过程的进行,结合的双链嵌合荧光染色Ⅰ染料分子逐渐增多,所检测到的荧光信号亦相应增强,从而实现实时定量检测。
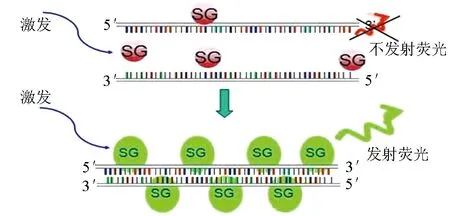
图2 双链嵌合荧光染色Ⅰ工作原理[29]
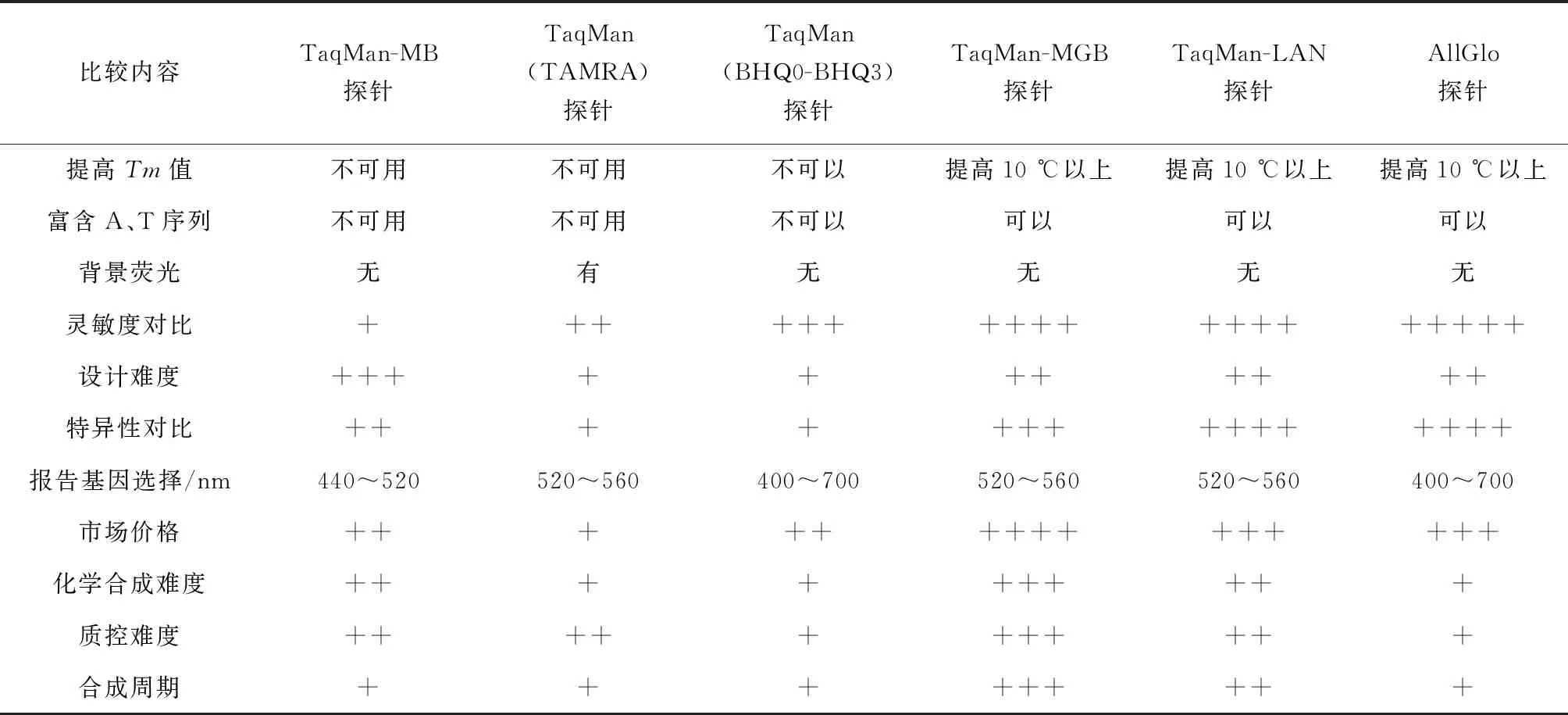
表1 目前荧光定量PCR常用探针比较[32]
注:“+”代表程度的强弱或难易.
目前,实时荧光定量PCR技术已成功应用于水产病毒的检测。Liu等[33]建立了传染性肌肉坏死病毒的实时荧光定量PCR反应体系,该方法可检测到传染性肌肉坏死病毒质粒cDNA可低至1拷贝/μL,且不与其他病毒产生交叉反应,具有很好的灵敏度和特异性。Liu等[34]根据虾肝肠胞虫(Enterocytozoonhepatopenaei)的SSU rDNA序列设计了一对特异性引物,建立了虾肝肠胞虫的实时荧光定量PCR反应体系,其灵敏度可达8.3×101拷贝/μL,较传统PCR方法,该法还有可快速检测大批量样本的优点。Kumar等[35]建立了一种检测灵敏度低至12 拷贝/μL的斑节对虾杆状病毒实时荧光定量PCR反应体系,该体系可以有效地用于斑节对虾杆状病毒的定量检测,且与传染性皮下及造血组织坏死病毒、白斑综合征病毒和肝胰腺细小病毒无交叉反应。该方法还可通过对虾排泄物的检测来判断亲体中低水平的斑节对虾杆状病毒感染状况,可见其灵敏度之高。刘宝彬等[36]采用实时荧光定量PCR技术对天津大港地区采集的108尾凡纳滨对虾进行检测。结果表明,传染性皮下及造血组织坏死病毒阳性检出率100%,每微克对虾组织DNA 的病毒拷贝数为103~107;虾肝肠胞虫阳性检出率为49.1%,每微克对虾组织DNA的拷贝数为103~105。最终通过对病毒载量指数相关性分析证实,该批虾患病为传染性皮下及造血组织坏死病毒和虾肝肠胞虫的混合感染所致,充分体现了该方法可实时监测并对大量样品准确定量的优点。
在实时荧光定量PCR与其他检测方法的对比中,Poulos等[37]利用原位杂交、免疫组织化学、常规反转录PCR和实时荧光定量PCR 4种方法检测桃拉综合征病毒时指出,实时荧光定量PCR是检测桃拉综合征病毒晚期慢性感染疾病的最佳选择。Pooljun等[38]建立了一种检测虾偷死野田村病毒的实时荧光定量PCR检测体系。结果表明,实时荧光定量PCR检测灵敏度可达1 拷贝/μL,而常规PCR与巢式PCR最低检测限分别为10 000拷贝/μL和100拷贝/μL,与常规PCR及巢式 PCR相比,实时荧光定量PCR灵敏度显然更高。Jin等[39]对平板计数法和实时荧光定量PCR两种定量检测方法进行了评价,其中实时荧光定量PCR对虾副溶血弧菌的灵敏度约为58 cfu/mL,与标准平板计数方法相比,实时荧光定量PCR的定量结果显示出良好的统计学相关性(r2=0.96)。付小哲等[40]针对传染性脾肾坏死病毒的开放读码框ORF007基因设计特异性引物,建立了实时荧光定量PCR体系。结果表明,实时荧光定量PCR测定的病毒拷贝数与细胞病变效应法测定的病毒滴度具有良好的线性关系,实时荧光定量PCR法可替代细胞病变效应(CPE)法应用于定量测定传染性脾肾坏死病毒疫苗抗原含量,大大缩短了疫苗制备的时间。这些充分说明了该法的优越性。目前,实时荧光定量PCR特异性良好、灵敏度较高、速度快,但试验成本较高,需要特殊的热循环仪和试剂,操作过程较为复杂,从而限制了其广泛的应用。
4 巢式PCR
巢式PCR(Nested PCR)是同时使用两对PCR引物扩增目的片段,第一对引物和普通PCR相似,第二对引物位于第一次PCR扩增片段的内部。其优点在于第二轮PCR产物几乎或完全没有因引物特异性弱而造成非特异性扩增,特异性非常高。
目前,巢式 PCR也已广泛应用于水产动物疾病的检测,李晨等[41]以急性病毒性坏死病毒全基因组序列中的保守区段设计引物,建立了巢式 PCR检测体系,成功检测出栉孔扇贝(Chlamysfarreri)中的急性病毒性坏死病毒。高文辉等[42]在牡蛎疱疹病毒3个变异株全基因组序列比对的基础上,筛选出牡蛎疱疹病毒基因组中高度保守的DNA聚合酶基因片段,建立了巢式PCR检测体系。结果表明,该方法能稳定地检出100 拷贝/μL的病毒DNA,且不与其他海水养殖动物常见的病原发生交叉反应,具有较高特异性,适用于牡蛎疱疹病毒不同变异株的检测。王紫燕等[43]分别以巢式 PCR和常规PCR来检测白纹伊蚊(Aedesalbopictus)幼虫体内的白斑综合征病毒,结果表明,相比于常规PCR,巢式 PCR的灵敏度与扩增效率更高。另外,Kim等[44]依据pGEM-T载体中的氨苄西林抗性基因设计引物,建立了鲤春病毒的巢式 PCR检测体系。结果表明,与常规PCR相比,巢式 PCR可降低假阳性现象,提高鲤春病毒检测准确性,但在实际应用中该技术仍存在重复性较差、条件要求较高等不足之处。
5 反转录PCR
反转录PCR(RT-PCR)又称为逆转录PCR,其原理是以RNA为模板,通过反转录酶将RNA转录为cDNA,再对cDNA进行扩增,从而检测目的基因。在水产养殖中,存在大量由RNA病毒感染的疾病。张奇亚[45]总结了水产动物病毒中RNA病毒的种类(表2)。
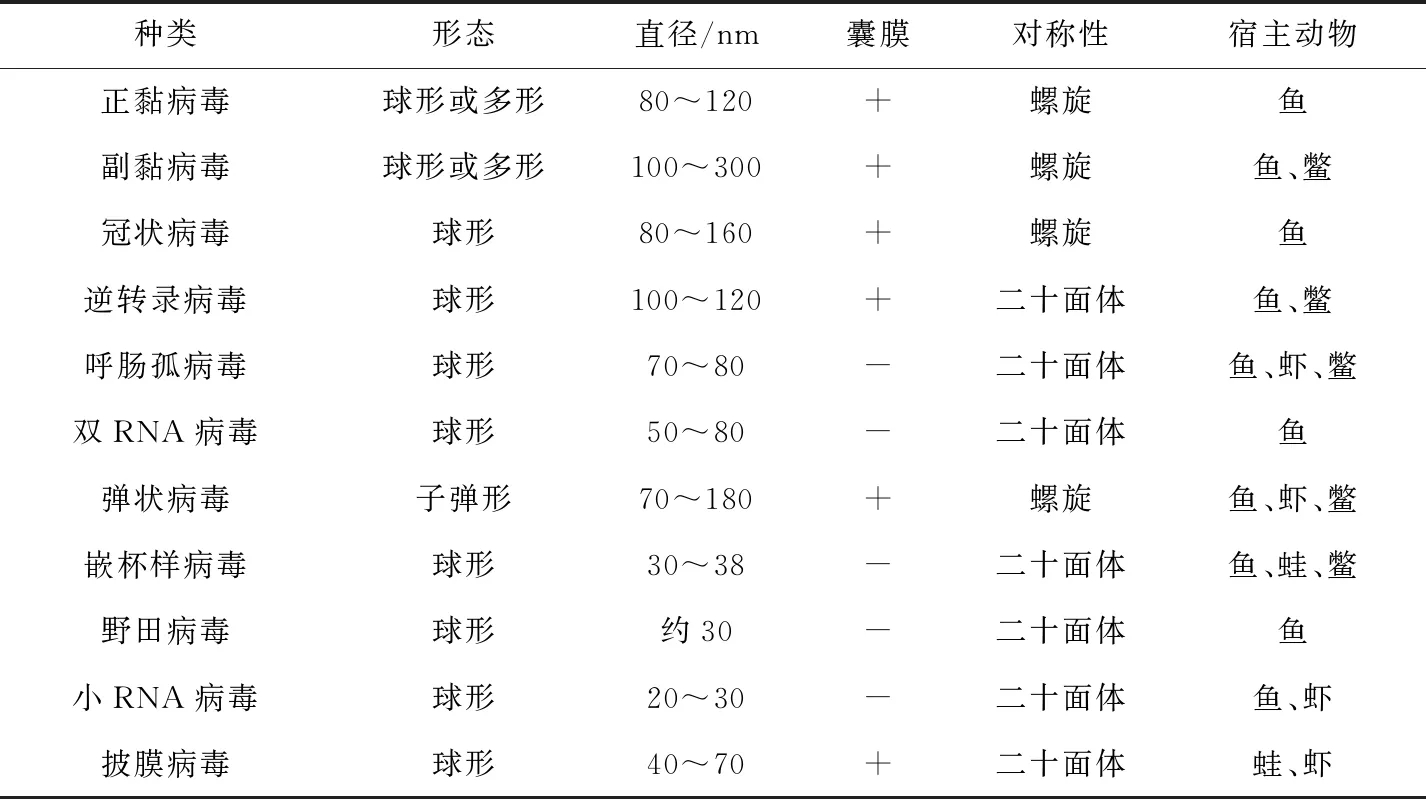
表2 水生动物RNA病毒属及形态结构特征[45]
注:“+”代表有囊膜,“-”代表无囊膜.
反转录PCR技术是检测RNA病毒的主要方法。Xie等[46]建立了多重反转录PCR体系,同时从虾中检测出桃拉综合征病毒、白斑综合征病毒和传染性皮下及造血组织坏死病毒3种病毒。说明该方法同样适用于多种RNA病毒的同时检测。2014年Yuasa等[47]成功检测出位于复制阶段的锦鲤疱疹病毒。随后Shimahara等[48]以鲤春病毒的G蛋白基因设计引物,建立了反转录PCR检测体系。其检测极限为7.1×102拷贝/μL,且该方法不仅适用于检测病毒悬浮液中所提取的RNA,同样可鉴别存在于鱼组织中的RNA。2018年Hwang等[49]基于病毒性出血性败血症病毒核衣壳基因序列设计引物,建立了病毒性出血性败血病病毒4种基因型的反转录PCR检测体系。并应用于来自韩国褐牙鲆(Paralichthysolivaceus)的病毒性出血性败血病病毒的鉴定。另外,基于反转录PCR技术,Kim等[50]设计了5对针对病毒性出血性败血病病毒核蛋白(N)基因的引物,建立了一种新型循环反转录PCR(cRT-PCR)体系,其灵敏度优于细胞培养法、实时荧光定量RT-PCR法的检测。以上说明RT-PCR技术已开始广泛应用于水产动物RNA病毒的检测中。
但在实际应用中RNA容易降解,易导致扩增失败或产生非特异性产物。此外,RNA提取过程以及反转录过程中也容易导致假阴性的结果出现。针对这一问题,Kiatpathomchai等[51]以黄头病毒的开放阅读框架3序列(编码gp64蛋白)设计了两对引物,以虾的血淋巴为样本,溶于10%的柠檬酸钠混合进行反转录PCR检测,有效减少了因RNA降解所产生的影响。
6 数字PCR
数字PCR(dPCR)也称单分子PCR,是近年来核酸定量的新方法,其中微滴数字PCR(ddPCR)最为常见。其检测过程主要包括PCR扩增和荧光信号分析两部分(图3)[52]。在PCR反应前,将样品分散至几万个单元反应室中,使每个单元中只存在单个DNA分子。在荧光信号分析阶段,采用终端检测,对每个反应单元的荧光信号进行采集,然后计数得到样品的原始浓度。与实时荧光定量PCR不同的是,整个数字PCR过程不需要设计标准曲线,且具有更高的特异性和重现性,可以实现真正意义上的绝对定量。
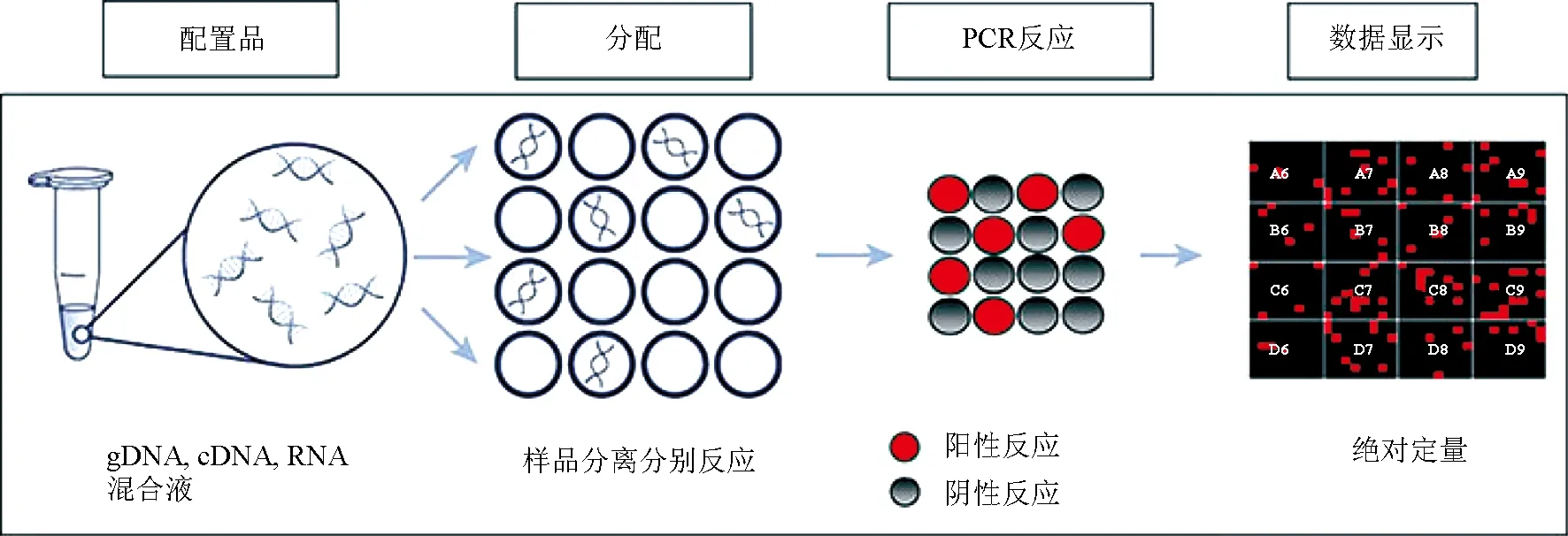
图3 数字PCR原理[52]
Jia等[53]比较了反转录数字PCR(RT-ddPCR)与逆转录定量PCR(RT-qPCR)两种方法对13个不同区域的传染性造血器官坏死病毒毒株的测定。结果表明,反转录数字PCR虽然检测灵敏度与检测范围弱于反转录定量PCR,但其相关性可达到69.4%~100%。郝中香等[54]以ORF6基因设计鲤疱疹病毒Ⅱ型引物,建立了数字PCR检测体系。结果显示,数字PCR的检测灵敏度较荧光定量PCR高5倍,且重复性较高,适合于鲤疱疹病毒Ⅱ型的快速检测和病原流行病学调查。赵欣等[55]对鲤疱疹病毒Ⅱ型的进一步研究显示,数字PCR及荧光定量PCR两种方法线性关系和特异性均良好。但与荧光定量PCR相比,数字PCR具有更高的重复性,且在临床样品检测中,数字PCR技术的阳性检出率为76.67%,荧光定量PCR技术的阳性检出率为73.33%,表明数字PCR技术在鲤疱疹病毒Ⅱ型实际检测中具有一定的优势。
这些试验数据充分证明数字PCR能实现灵敏、准确的绝对定量,且数字PCR能够有效避免常规PCR抑制剂苯酚、氯化钠、铁离子等的影响[56]。但其耗材成本高、试验通量少,不能实现操作智能化,仪器定价高,成为该技术推广使用的一大难题。
7 PCR与其他技术的联用
PCR不仅可以单独用来检测病原体, 也可与其他技术相结合从而充分发挥其优点。Di等[57]将PCR与ELISA联用对贝类中副溶血弧菌进行了检测。其主要利用ELISA方法代替电泳检测PCR扩增产物,与电泳相比,PCR-ELISA的检测灵敏度提高了100倍。张蕾等[58]将PCR与纳米免疫磁分离技术(Nano-IMB)结合,建立了一种针对副溶血弧菌的反转录PCR快速检测方法。纳米免疫磁珠在菌体浓度为103cfu/mL时,对副溶血弧菌的捕获率达到74%,将纳米免疫磁珠与反转录PCR技术相结合,检测副溶血弧菌的灵敏度可达140 cfu/mL,在食品基质添加试验中,其检测限为2 cfu/25 g样品,该技术具有很好的应用价值和应用前景。尹伟力等[59]建立了一种可同时检测桃拉综合征病毒、黄头病毒的液相芯片技术。该方法以桃拉综合征病毒的衣壳蛋白CP2基因和黄头病毒的非结构蛋白N基因设计特异性引物并标记生物素,探针氨基化修饰,荧光编码微球偶联后与桃拉综合征病毒、黄头病毒反转录PCR产物杂交,并用液相芯片仪器检测荧光信号。该方法最低检测限可达100 pg/μL,与白斑综合征病毒、鲤春病毒、传染性皮下及造血组织坏死病毒等均无交叉反应,与常规PCR 技术相比,由于液相芯片检测体系通过激光检测核酸杂交微球的集合体,有效避免了多种核酸扩增产物的相互干扰,提高了灵敏度。另外Xu等[60]建立了多重PCR与高效液相色谱(HPLC)联合快速检测方法(mPCR-HPLC),可同时检测副溶血弧菌、霍乱弧菌、创伤弧菌(V.vulnificus)等。该方法特异性良好,灵敏度可达10 cfu/mL,可用于定量监测样本中目标菌的动态变化。
各种技术的联用,通过充分发挥其各自优点,实现了提高灵敏度、特异性及检测通量的目的,形成了常规方法无法比拟的优势。但是在实际应用上还略显不足,因此PCR技术与其他技术的创新联用还需进一步的开拓与发展。
8 结论与展望
PCR技术目前在水产动物疾病检测方面,已经得到了广泛应用,很多新型的衍生技术如多重PCR、实时荧光定量PCR、巢式PCR等也有初步应用。另外,PCR与其他技术如酶联免疫吸附、纳米磁性微球免疫分离、高效液相色谱等的联用,也得到了进一步的发展。在实际临床样品检测中,应针对不同检测方法的特点进行合理选择,在应用中不断积累经验,优化各种方法,才能使PCR技术在水产疾病检测领域具有更广泛的应用。随着PCR相关技术的发展及其与其他技术的联用,在未来的水产动物疾病检测领域,PCR技术将向着易操作、低成本、高灵敏度、高特异性及自动化的趋势发展,并将以其特有的优势在水产动物疾病诊断中发挥更大的作用,推动水产养殖业健康发展。

