尼罗罗非鱼MyD88基因的表达及多克隆抗体制备
张永德,林 勇,潘传燕,冯鹏霏,陈晓汉,罗洪林
( 广西水产科学研究院,广西水产遗传育种与健康养殖重点实验室,广西 南宁 530021 )
与多数脊椎动物一样,硬骨鱼也具有先天性免疫和获得性免疫系统,以消除入侵的病原体,先天性免疫被认为是对抗病原体的主要组成部分[1]。先天性免疫反应是由生殖细胞编码的模式识别受体(PRRs)通过识别外来刺激的保守病原体相关分子模式(PAMPs)来启动宿主免疫反应的,如细菌细胞壁的脂多糖或肽聚糖、真菌的β-1,3-葡聚糖细胞壁、病毒的双链RNA以及受损细胞释放的内源性分子等[2-3]。在已知的模式识别受体中,Toll样受体(TLR)在识别微生物病原体相关分子模式中起关键作用,并触发下游信号级联,激活参与调节免疫相关基因表达的转录因子,包括促炎细胞因子[4]。Toll样受体的细胞内Toll/IL-1受体(TIR)结构域将通过Toll/IL-1受体二聚化结合多个下游信号配体并激活核因子κB(NF-κB)[3]。在这些配体中,髓样分化因子(MyD88)蛋白是除TLR3外介导大多数TLR活化的关键和保守的信号蛋白之一[5]。
MyD88蛋白是哺乳动物和鱼类TLRs信号转导途径的关键因子,在脊椎动物和无脊椎动物中具有共同的结构特征,包括具有短接头区的N-端死亡结构域(DD)和C-端TIR结构域[4]。其C-端TIR结构域能够与TLR相互作用,而N-端DD结构域能够与IL-1受体相关激酶4(IRAK4)相互作用,IRAK4又反过来募集IRAK1或IRAK2形成Myddosome信号复合物,激活NF-κB和丝裂原活化蛋白激酶(MAPK)信号的传导[6-7]。目前,已在许多无脊椎动物和脊椎动物中克隆鉴定了MyD88基因,包括哺乳动物[8-9]、禽类[10-11]、两栖动物[12]、爬行动物[13]、鱼类[14-17],以及一些无脊椎动物[18-21]。MyD88蛋白作为配体蛋白在先天性免疫中的潜在作用已在模式动物中得到证明。如MyD88基因敲除小鼠易受病毒和细菌感染[22-24]。MyD88基因突变体斑马鱼(Daniorerio)更容易受到迟钝爱德华氏菌(Edwardsiellatarda)和鼠伤寒沙门氏菌(Salmonellatyphimurium)的感染[25]。
罗非鱼(Oreochromis)是我国的主导水产养殖品种,然而近些年,罗非鱼养殖时常受疾病的困扰,尤其是链球菌病已成为威胁罗非鱼产业发展的一个主要问题[26-27]。疾病在危害罗非鱼养殖的同时,也加重了药物的滥用[28-29]。因此,了解宿主与病原的相互作用,以及罗非鱼的免疫反应机制等对于开发有效治疗、预防措施及减少药物的使用至关重要。然而,罗非鱼免疫相关研究仍然较薄弱,其抗细菌侵袭的免疫机制尚未完全明确。目前对于罗非鱼免疫相关因子及其在免疫信号通路中的作用研究尚处起步阶段。本研究对尼罗罗非鱼(O.niloticus)MyD88基因进行原核表达,通过免疫大耳兔制备抗罗非鱼MyD88蛋白特异性抗体,为深入研究罗非鱼MyD88蛋白的功能、TLR信号通路及先天性免疫系统的分子机制提供了基础材料。
1 材料与方法
1.1 材料
重组质粒pET-B2m(由pET-28a改造而来)、表达宿主B21(武汉金开瑞生物公司);DNA聚合酶、蛋白marker、限制性内切酶BamHⅠ和SalⅠ(美国Fermentas公司);In-Fusion® HD Cloning Kit(Clontech公司);DNA回收试剂盒、质粒提取试剂盒(天根生物技术公司);异丙基-β-D-硫代半乳糖苷(IPTG)(Merck公司);弗式完全佐剂、弗氏不完全佐剂(美国Sigma公司);聚偏氟乙稀膜(PVDF)(ThermoFisher公司);羊抗兔-HRP抗体(美国Jackson公司);亲和层析柱料(美国GE Healthcare公司)。
1.2 方法
采用DNAstar软件对MyD88蛋白的抗原指数和细胞表位等进行预测分析,采用在线分析工具ExPASy中的ProtScale(https:∥web.expasy.org/protscale/)预测MyD88蛋白质疏水性,TMHMM server v.2.0(http:∥www.cbs.dtu.dk/services/TMHMM-2.0/)对MyD88蛋白序列进行跨膜区预测。
1.2.2 目的基因的扩增
根据尼罗罗非鱼MyD88基因序列(美国国立生物技术信息中心登录号:KJ130039),利用Primer Premier 5.0软件设计MyD88基因PCR引物,上下游引物序列分别为P1:5′-TCCACTGGGTTCTCGGACTATGGCATGTGCAGATAGC-3′,P2:5′-TAAGGCCGCACTCGAGCACCACCGGCAGGCT CAGGGCTTTT-3′。合成尼罗罗非鱼MyD88基因序列,以此为模板进行PCR反应,100 μL反应体系包括:TaqDNA聚合酶(5 U/μL) 1.0 μL,10×Taq Buffer 10.0 μL,dNTP(10 mmol/L) 2.0 μL,上下游引物(10 μmol/L)各5.0 μL,模板DNA 2.0 μL。PCR扩增程序为:94 ℃预变性4 min;94 ℃变性45 s,52 ℃复性45 s,72 ℃延伸45 s,28个循环;最后72 ℃延伸10 min。PCR产物经1.2%琼脂糖凝胶电泳检测并切胶回收。
1.2.3 原核表达质粒的构建
将载体pET-B2m采用SalⅠ与BamHⅠ双酶切处理,然后采用同源重组的方法将目的片段与载体连接,构建重组质粒pET-B2m-MyD88,转入大肠杆菌(Escherichiacoli)B21;筛选阳性克隆,提取质粒进行PCR扩增,1.2%琼脂糖凝胶电泳检测,并送生工生物工程(上海)股份有限公司测序。序列采用DNAstar MegAlign软件包进行比对分析,以确定基因正确插入载体。
1.2.4 目的基因的小量表达
将测序鉴定正确的重组质粒转入表达菌B21,取30 μL过夜培养的菌液接入3.0 mL LB培养基中,37 ℃振荡培养至600 nm吸光度为0.6,其余培养液添加甘油置于-80 ℃,作为菌种备用。取部分菌液作为对照组,剩余菌液加入IPTG诱导剂至终浓度0.5 mmol/L,两组菌液继续37 ℃振荡培养3 h;然后取菌体1 mL,10 000 r/min离心30 s,收获沉淀,用100 μL 1% SDS重悬,混匀,100 ℃处理10 min。最后10 000 r/min离心10 min,取上清液进行SDS-PAGE检测分析。
再各称取5 g未经过改性处理的丝瓜络纤维分别加入4个250 mL磨口烧瓶中,分别加入50 mL 0.5 mol/L 的 K2Cr2O7、 CoSO4、 KMnO4、 CuSO4溶液,浸泡1.5 h后,再放在转速为200 r/min的磁力搅拌器上,搅拌0.5 h后,取出溶液,转移到烧杯中,供比色用。
1.2.5 蛋白表达与破菌检测
取保存的菌种20 μL转接入20 mL液体LB培养基,过夜培养后取2 mL菌液加入含2000 mL的LB培养基中,37 ℃振荡培养至600 nm吸光度约0.6,降低温度至30 ℃;加入IPTG诱导剂至终浓度0.5 mmol/L,30 ℃继续振荡培养3 h。收集发酵液,7300 r/min离心10 min收集菌体。将菌体悬浮于40 mL预冷的NTA-0缓冲液中,冰浴超声波破碎细菌,13 000 r/min、4 ℃离心30 min,收集上清液以及沉淀。取少量样品进行SDS-PAGE检测。
1.2.6 包涵体蛋白的纯化
将收集的沉淀加入Ni-NTA树脂层析柱中,流速控制为0.5 mL/min,收集穿柱液体。以10倍柱床体积的NTA-0 Buffer冲洗,然后分别用10倍柱床体积的NTA-20、NTA-60、NTA-200、NTA-500缓冲液洗脱,收集各洗脱峰,取少量洗脱液进行SDS-PAGE电泳检测。纯度达到要求的组分,置于透析袋中,4 ℃以1×PBS透析,最后4 ℃超滤浓缩透析产物。
1.2.7 多克隆抗体的制备和鉴定
将纯化的重组蛋白与等容积弗氏完全佐剂乳化后,以500 μg/只的剂量免疫2只日本大耳兔,皮下多点注射。每只兔子免疫5~6次,每次免疫间隔14 d,并检测免疫效价,待抗体表达恒定后,采血分离血清,于-20 ℃冰箱保存备用。
1.2.8 免疫效价的ELISA检测
以重组MyD88蛋白作为抗原(2 μg/mL),按100 μL/孔加入苯丙乙烯到96孔反应板中进行抗原包被,4 ℃过夜;用PBST洗液洗3次,2%卵清蛋白于室温封闭0.5 h,再洗涤3次后,将待检血清按1∶2000、1∶4000、1∶8000作二倍梯度稀释至1∶8 192 000,然后各取100 μL加入96孔板,以空白血清作为阴性对照。37 ℃温育1 h后,PBST洗涤3次,加入HRP标记的羊抗兔IgG(1∶5000)溶液100 μL/孔,37 ℃温育45 min,PBST洗涤5次;每孔加入TMB显色液100 μL显色20 min,最后加入50 μL H2SO4终止反应液,以酶标仪测定450 nm的吸光值。阳性反应的最大稀释度为待测样品的效价。
1.2.9 Western blot检测
将纯化的重组蛋白分别取25 ng和10 ng经SDS-PAGE电泳后,200 mA湿法转PVDF膜60 min,将膜用PBST洗3次,每次5 min,然后浸没于封闭液中37 ℃封闭2 h。加入兔抗血清(稀释度体积比为1∶1000),于摇床37 ℃孵育1 h,PBST洗涤3次,每次5 min。然后加入羊抗兔-HRP二抗(1∶10 000倍体积稀释),37 ℃孵育1 h,取等体积的ECL试剂A液、B液混合滴于膜正面,于暗室反应2 min,取出胶片立即浸入显影液中显色1 min,浸入定影液中定影1 min,晾干,标定Marker后,拍照分析MyD88蛋白抗血清的特异性。
1.2.10 抗体纯化
采用Protein G亲和层析柱进行抗体纯化。将收集的抗血清与等体积2×PBS缓冲液混合后上样,用10倍柱体积以上的PBS洗涤,至流出液无蛋白检出,加入2倍柱体积0.1 mol/L柠檬酸(pH2.7)洗脱,收集洗脱产物,测定280 nm吸光度估算抗体浓度;采用1 mol/L Tris调节洗脱产物pH至中性,用10 ku超滤管将样品浓缩至所需体积,纯化浓缩后的抗体经稀释后,SDS-PAGE电泳检测,-20 ℃保存备用。
2 结果与分析
2.1 MyD88蛋白疏水性及跨膜区分析
MyD88基因编码蛋白由288个氨基酸组成,疏水性分析结果显示,MyD88蛋白平均疏水性为-0.149,序列中含有较多的亲水性氨基酸,亲水性区段主要为:27~37、52~68、71~82、88~123、125~152、171~181、185~194、202~210、215~227、237~244、249~258、264~273(图1),序列亲水性较好。疏水性氨基酸丙氨酸、半胱氨酸、异亮氨酸、亮氨酸、甲硫氨酸、苯丙氨酸和缬氨酸分别占编码的6.60%、4.51%、4.86%、10.76%、3.13%、3.82%和7.64%。跨膜区分析结果显示,MyD88蛋白无典型的跨膜区,MyD88蛋白的288个氨基酸均位于细胞膜表面,降低了跨膜区疏水性氨基酸对蛋白折叠的影响,易于表达和纯化。
2.2 MyD88蛋白的抗原性分析
采用Protean模块中的的Jameson-Wolf方法预测MyD88蛋白的抗原指数,发现MyD88蛋白序列具有丰富且分布均匀的抗原表位位点,其中抗原指数较高的区段为:3~12、52~65、71~82、88~123、125~152、170~181、185~194、202~210、215~227、237~244、249~258、264~273(图2)。这些区段并且具有强的表面可及性和亲水性位点,因此利用该蛋白制备抗体具有较强的可行性。

图1 MyD88蛋白的疏水性分析
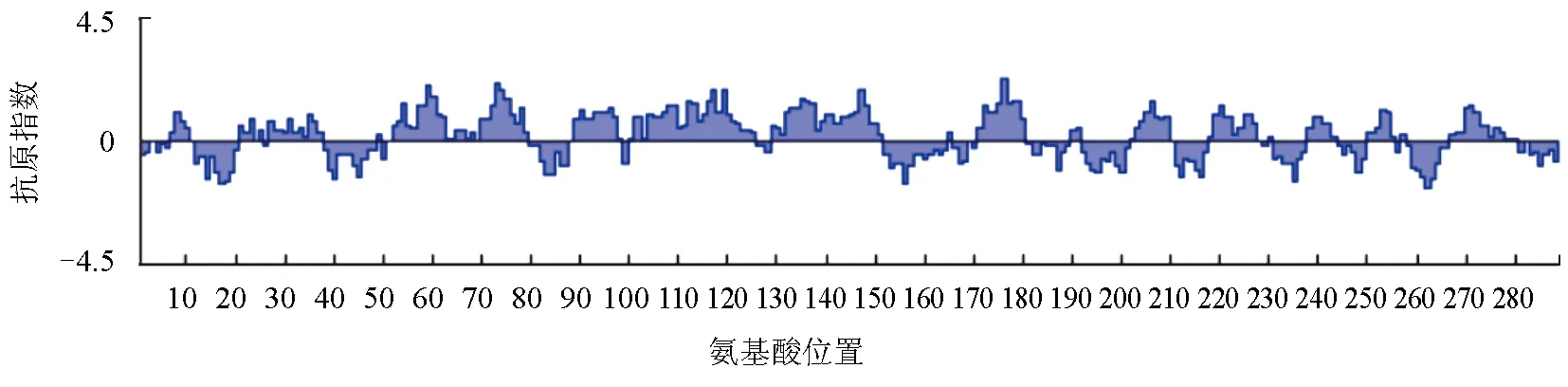
图2 MyD88蛋白的抗原性分析
2.3 MyD88蛋白同源性分析
同源性分析结果显示,尼罗罗非鱼MyD88蛋白与兔MyD88蛋白(XP_010751574.1)序列的同源性高达81.60%。从同源性分析及抗体制备要求来看,作为多抗免疫原,MyD88蛋白应该具有较高的免疫原性。
2.4 MyD88基因表达载体的构建与鉴定
以pET-B2m-MyD88质粒为模板,PCR扩增MyD88基因,经1.2%琼脂糖凝胶电泳检测,获得1条864 bp的目的片段(图3),该片段大小与预期结果一致。经测序与序列比对分析,确定MyD88基因已正确插入载体pET-B2m中,载体构建成功。

图3 尼罗罗非鱼MyD88基因原核表达载体的PCR检测1.DL2000 plus DNA Marker; 2.MyD88基因扩增产物.
2.5 小量诱导表达
将重组质粒pET-B2m-MyD88转化大肠杆菌B21感受态细胞后,经IPTG诱导表达与SDS-PAGE检测,结果发现,诱导表达的菌株在48.9 ku处出现显著表达条带(图4),与MyD88重组蛋白的预期大小一致。

图4 MyD88蛋白的小量诱导表达电泳检测M.蛋白质Marker; 1.未诱导的菌株; 2.诱导表达的菌株.
2.6 重组蛋白的表达与鉴定
对重组蛋白进行大量诱导表达,经菌液裂解及SDS-PAGE电泳后,上清液与沉淀均在48.9 ku处出现1条蛋白条带,且沉淀中蛋白的含量显著高于上清液中蛋白的含量(图5)。

图5 尼罗罗非鱼MyD88蛋白的大量表达M.蛋白质Marker; 1.上清液中的MyD88蛋白; 2.沉淀中的MyD88蛋白.
2.7 蛋白的提取与纯化
大肠杆菌表达的重组MyD88蛋白主要以包涵体存在。细菌经裂解与离心沉淀、重悬后,加入Ni-NTA树脂层析柱中进行纯化,纯化产物10倍稀释后,经SDS-PAGE电泳,结果显示,在48.9 ku处有1条清晰的带纹(图6)。
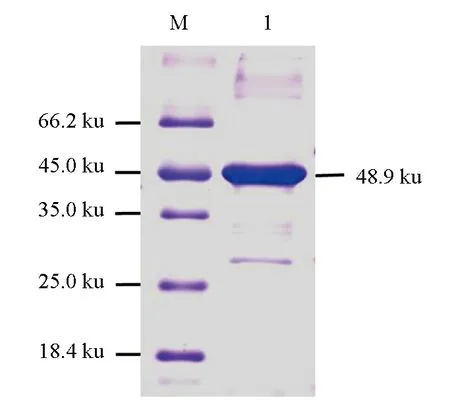
图6 MyD88重组蛋白纯化产物的SDS-PAGE分析M.蛋白质Marker; 1.纯化的MyD88重组蛋白.
2.8 MyD88蛋白血清抗体的免疫效价
抗原采用pH 9.6的碳酸盐缓冲液分别包被,ELISA法分别检测重组MyD88蛋白免疫的日本大耳兔抗体效价。结果显示,多克隆抗体的效价为1∶2 048 000(图7),该重组蛋白可以诱导日本大耳兔产生良好的免疫反应,且抗体效价较高。
2.9 Western blot检测
纯化的样品蛋白Western blot检测结果见图8。在泳道的48.9 ku位置,25 ng和10 ng重组蛋白均出现1条清晰的与阳性血清反应蛋白条带,其中25 ng蛋白条带更清晰,而免疫前阴性血清对照组在相应位置未见明显的条带,表明MyD88抗血清具有特异的反应特性。

图7 尼罗罗非鱼MyD88蛋白多克隆抗体效价的ELISA曲线
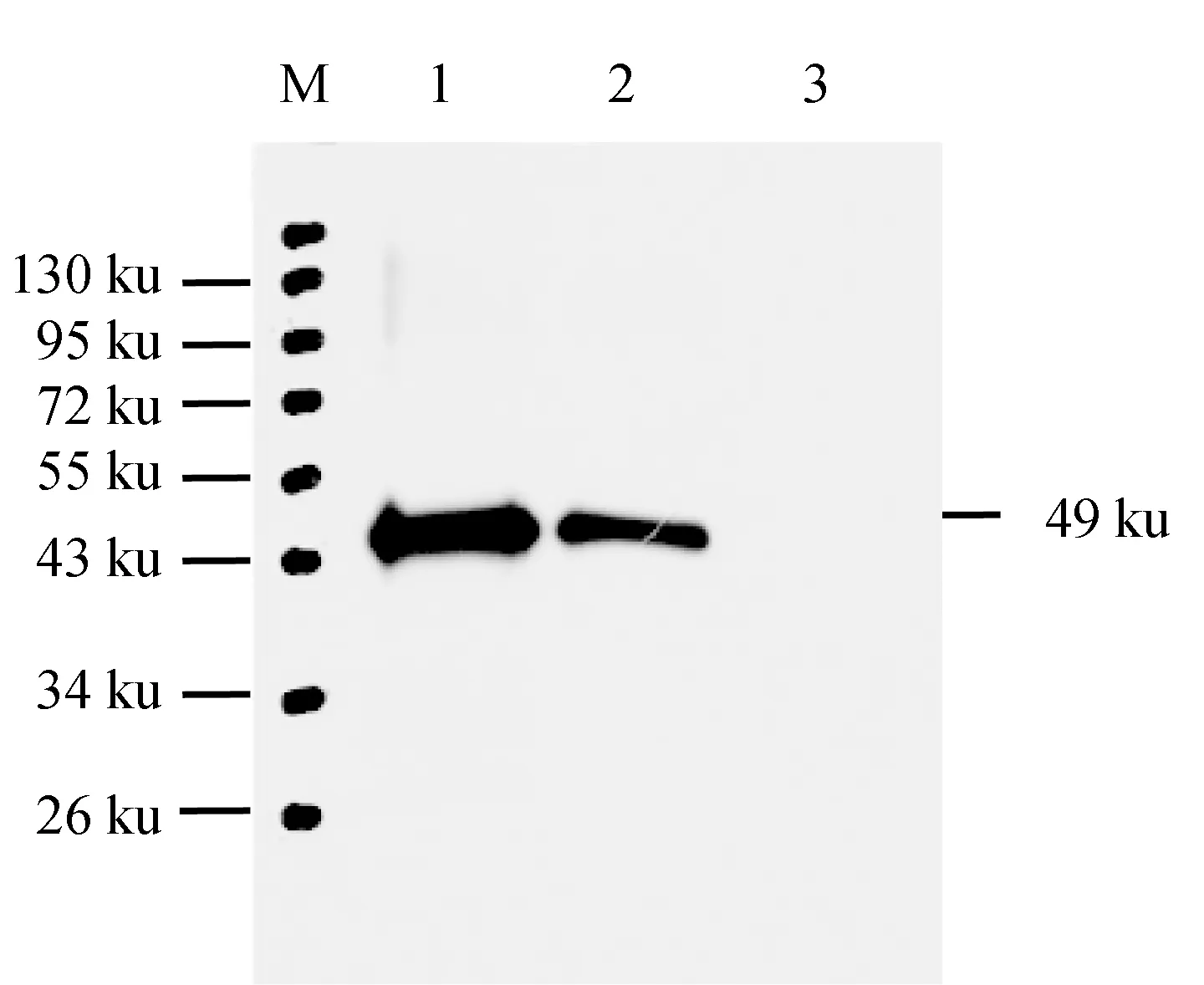
图8 MyD88蛋白多克隆抗体特异性的Western blot检测M.蛋白质Marker; 1.25 ng纯化的重组蛋白; 2.10 ng纯化的重组蛋白; 3.阴性对照组.
2.10 抗体纯化
将收集到的抗血清采用Protein G亲和层析柱进行两次纯化,纯化的抗体经4倍稀释后,进行SDS-PAGE检测,结果在约50 ku和25 ku处各出现1条清晰条带(图9),片段大小与抗体重链与轻链大小符合,纯化效果较好。经纯化的抗体质量浓度达10 mg/mL以上,纯度约95%。
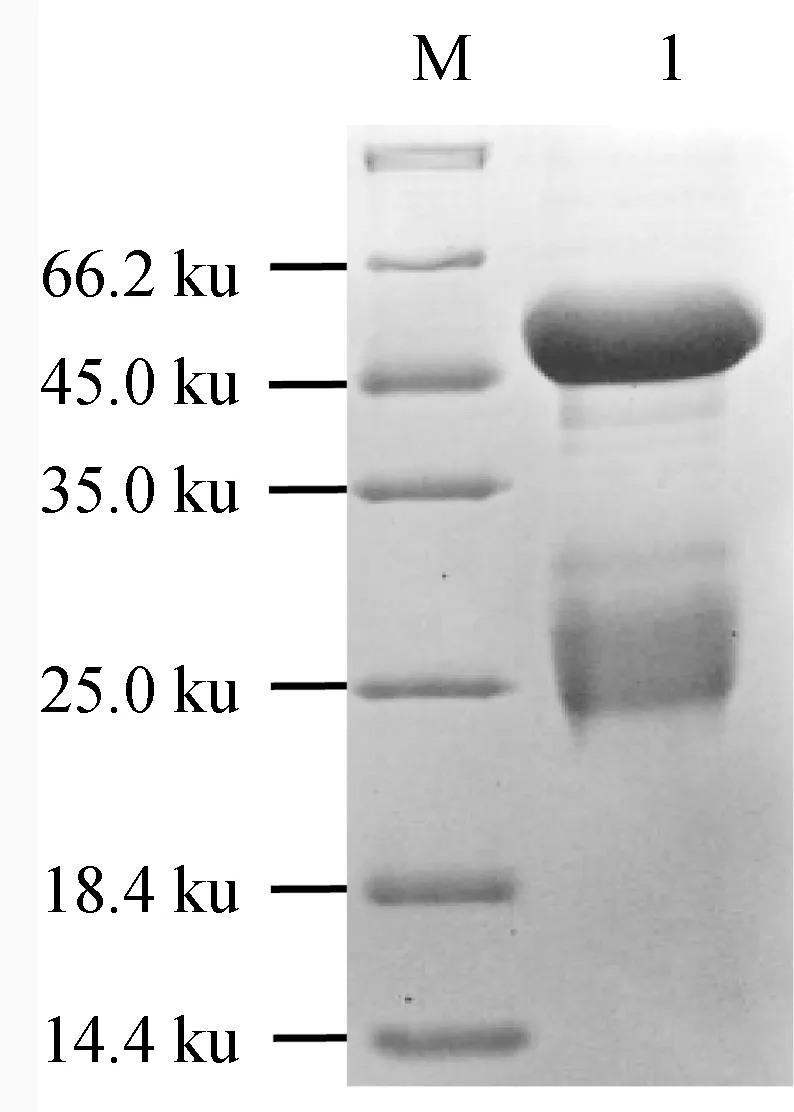
图9 纯化的MyD88抗体SDS-PAGE电泳检测M.蛋白质Marker; 1.纯化的抗体.
3 讨 论
MyD88蛋白作为TLR信号通路中的一个关键接头分子,在传递上游信息和疾病发生发展中具有重要的作用。迄今为止,MyD88基因在鱼类免疫相关的研究中仍较少,鱼类MyD88蛋白与抗体的研究则更少,Huang等[30]发现,MyD88与DNA疫苗acfA共同注射斑马鱼,可明显提高MHCⅠα、MHCⅡα、CD4、CD8α、IL-1β、TNFα等免疫相关基因的特异性抗体水平和表达水平;MyD88蛋白可增强acfA对溶藻弧菌(Vibrioalginolyticus)感染的免疫保护作用。罗非鱼MyD88基因序列已被克隆,其表达情况研究已有报道[31],但其功能尚不清楚,目前也无商业化可用的抗体用于MyD88蛋白研究,所以,笔者进行罗非鱼MyD88基因的表达及其抗体的制备研究,对该基因的功能研究具有重要意义。
3.1 原核克隆表达载体的选择
由于在动物先天性免疫信号通路中发挥着核心角色[32],MyD88蛋白引起了学术界的广泛重视。然而,组织中蛋白质的低丰度导致难以从组织中获得令人满意的蛋白含量,限制了对其深入的研究;而作为天然提取的有效替代方法,异源表达提供了生产大量蛋白的简单且廉价的手段[33-36]。大肠杆菌表达系统是最早开发和最成熟的外源蛋白原核表达系统。由于具有清晰的遗传背景、低成本,表达效率高和操作简单等优点,大肠杆菌表达系统已被广泛用于基因的表达研究。目前pGE、pQE和pET系列质粒已广泛用于科学研究和工业生产,而pET系列质粒由于其克隆和表达重组蛋白的高效性,以及具有多个候选融合标签,已成为目前最常用的表达载体之一。采用大肠杆菌表达外源蛋白时,蛋白表达量的多少受多种因素的影响,如表达载体的选择、宿主的选择、外源基因中密码子的使用,以及培养条件等[37]。本试验采用金开瑞公司开发的融合表达载体pET-B2m,以大肠杆菌B21作为表达宿主,在细菌对数生长期即600 nm吸光度为0.6时,采用0.5 mmol/L IPTG作为诱导浓度,经3 h的诱导,实现了MyD88重组蛋白的高效表达,也说明pET-B2m是一种较好的表达载体,对尼罗罗非鱼MyD88基因的表达具有高效性。重组蛋白的获得不仅是制备抗体的基础,也具有较高的实际应用价值。
3.2 表达蛋白的存在形式及包涵体的形成
本试验采用IPTG对构建的重组表达体系进行诱导表达,经超声波破菌后,对上清液以及沉淀进行SDS-PAGE检测。发现上清液与沉淀均在48.9 ku处出现1条带纹,且沉淀中的量显著高于上清液中的量,说明所表达的重组蛋白以可溶性蛋白及不溶性的包涵体形式存在,但主要的存在形式为包涵体。包涵体是重组细菌中出现的功能性的无毒性的淀粉状蛋白,与哺乳动物内分泌系统的分泌颗粒类似。包涵体形成是基因克隆表达中经常出现的一种情况,这是重组菌作为重组“细菌工厂”的内在的、通常不可避免的特质[38]。在强启动子系统下,使用高温、高诱导浓度进行蛋白诱导表达,通常会导致目的蛋白以高翻译率表达,这会导致细菌蛋白质质量控制系统耗竭,从而引起部分折叠或错误折叠的蛋白分子聚集而形成包涵体[39]。蛋白表达量的多少也会影响包涵体的形成,表达量越高越容易形成包涵体,一般来说,当蛋白质的表达水平超过其细胞总蛋白的2%,就会导致包涵体的形成[40]。而细菌胞浆环境条件的降低[41],缺乏真核伴侣和翻译后机制,也有助于包涵体的形成[42]。为了减少包涵体的形成,增加可溶性蛋白的量,研究人员已经提出了许多对策,包括遗传方法(如降低基因表达量或基因表达效率)、物理方法(如降低培养温度和诱导浓度)、生理学方法(如同时生成伴侣分子和折叠调节剂)以及调整有效的养分(如碳源限制)[43-44]等。而最近的研究表明,包涵体中的大部分蛋白质是有功能的,可以用于多种应用而不用溶解和重新折叠[45]。由于本研究的目的主要是制备多克隆抗体,包涵体的形成不会对抗体的制备造成影响,因此,在进行MyD88蛋白的表达时未考虑降低包涵体的形成。
3.3 多克隆抗体的特异性及效价
特异性抗体是研究基因功能重要的工具之一,虽然一些抗体可通过商业途径获得,但有时所需的抗体比较特殊,或所需抗体的量较大,商业途径往往难以满足要求,这时就需要自己制备。在抗体制备的几种方法中,多克隆抗体制备通常是实验室的首选,因其操作简单,成本低,且不需要复杂的设备[46]。目前尚无可用的尼罗罗非鱼MyD88蛋白抗体,本研究采用MyD88融合蛋白作为抗原来刺激日本大耳兔产生多克隆抗体,应用制备的多克隆抗体与原核诱导表达的MyD88蛋白进行Western Blot检测,在约48.9 ku处出现了1条明显的目的条带,表明多克隆抗体已成功制备,且可以特异性的识别原核表达的MyD88菌体蛋白。ELISA检测结果显示,血清抗体的效价为1∶2 048 000,说明免疫大耳兔以后,获得了良好的免疫反应,抗体效价较高。
本研究成功构建了尼罗罗非鱼MyD88基因原核表达载体,并在大肠杆菌中诱导表达获得了MyD88重组蛋白,将该重组蛋白免疫大耳兔后获得了能特异性识别纯化的MyD88蛋白的多克隆抗体,该重组蛋白及其抗体的制备,为后续MyD88蛋白的功能研究提供了有用的工具,也为进一步深入研究MyD88蛋白在鱼类先天性免疫反应中的作用奠定了基础。

